查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
骨关节炎(Osteoarthritis,OA)是一种常见的慢性关节疾病,其病理变化包括关节软骨的颤动和退化、软骨下骨硬化、骨赘的形成以及炎症反应。目前,药物治疗以缓解疼痛为主,暂无改善疾病的治疗方法。因此,识别和定义OA早期阶段的细胞和分子级联反应将有利于OA初始阶段的诊断和治疗,最终促进关节稳态的恢复。ZBTB20作为ZBTB蛋白家族成员,具有转录抑制作用,参与器官发育及代谢调控,其在关节软骨中通过抑制Sox9调节肥厚性软骨细胞的终末分化。然而,ZBTB20在OA病理发展中的功能仍不清楚。

西安交通大学及西北大学颉强团队、第四军医大学杨柳团队联合在Bone Reaserch(IF:14.3)上发表研究论文《LATS1-modulated ZBTB20 perturbing cartilage matrix homeostasis contributes to early-stage osteoarthritis》,发现ZBTB20在OA早期易位至细胞核,其核内聚集水平随着病程发展逐渐减弱;ZBTB20通过抑制Pten表达,激活PI3K-Akt-NF-κB信号来破坏细胞外基质(ECM)的代谢平衡;此外,ZBTB20的亚细胞定位和转录活性可被上游调控因子LATS1调节,应用LATS1抑制剂TRULI和SGLT2抑制剂DAPA干预可有效逆转由ZBTB20介导的ECM代谢紊乱,缓解OA发展和软骨退化。在本研究中,作者使用汉恒生物提供的cre过表达重组腺病毒Ad-Cre-GFP实现了Zbtb20fl/fl小鼠原代软骨细胞的Zbtb20基因敲除、Zbtb20过表达重组腺病毒Ad-mZbtb20-GFP感染野生型原代软骨细胞实现了Zbtb20的外源性过表达。

接下来,我们一起看看本研究的主要结果。
首先,作者使用白细胞介素-1β(IL-1β)处理原代软骨细胞建立了体外炎症模型,选取0、6 h(快速反应)、48 h(长期反应)时间点进行转录组测序(RNA-seq)和染色质可及性分析(ATAC-seq)。对各组中TF结合基序的分析结果显示,6 h组富集了具有锌指结构域的转录因子,提示锌指蛋白被激活。单细胞测序结果显示锌指蛋白ZBTB20这一具有炎症反应调节功能的基因在软骨细胞簇中显著表达。作者通过小鼠内侧半月板失稳(DMM)手术构建OA模型,对关节软骨切片进行免疫荧光染色,证实了术后2周软骨细胞中的ZBTB20发生核转位,随着病程发展核转位逐渐减少,这一变化与COLII相关。在体外培养的软骨细胞中,ZBTB20的蛋白水平在IL-1β刺激后表现出下调趋势。为了排除个体异质性干扰,作者使用同一OA患者胫骨平台两侧的软骨进行对比,免疫组化结果显示受损区域ZBTB20的表达显著降低。这表明ZBTB20的激活与OA早期的发病机制之间存在强相关性。
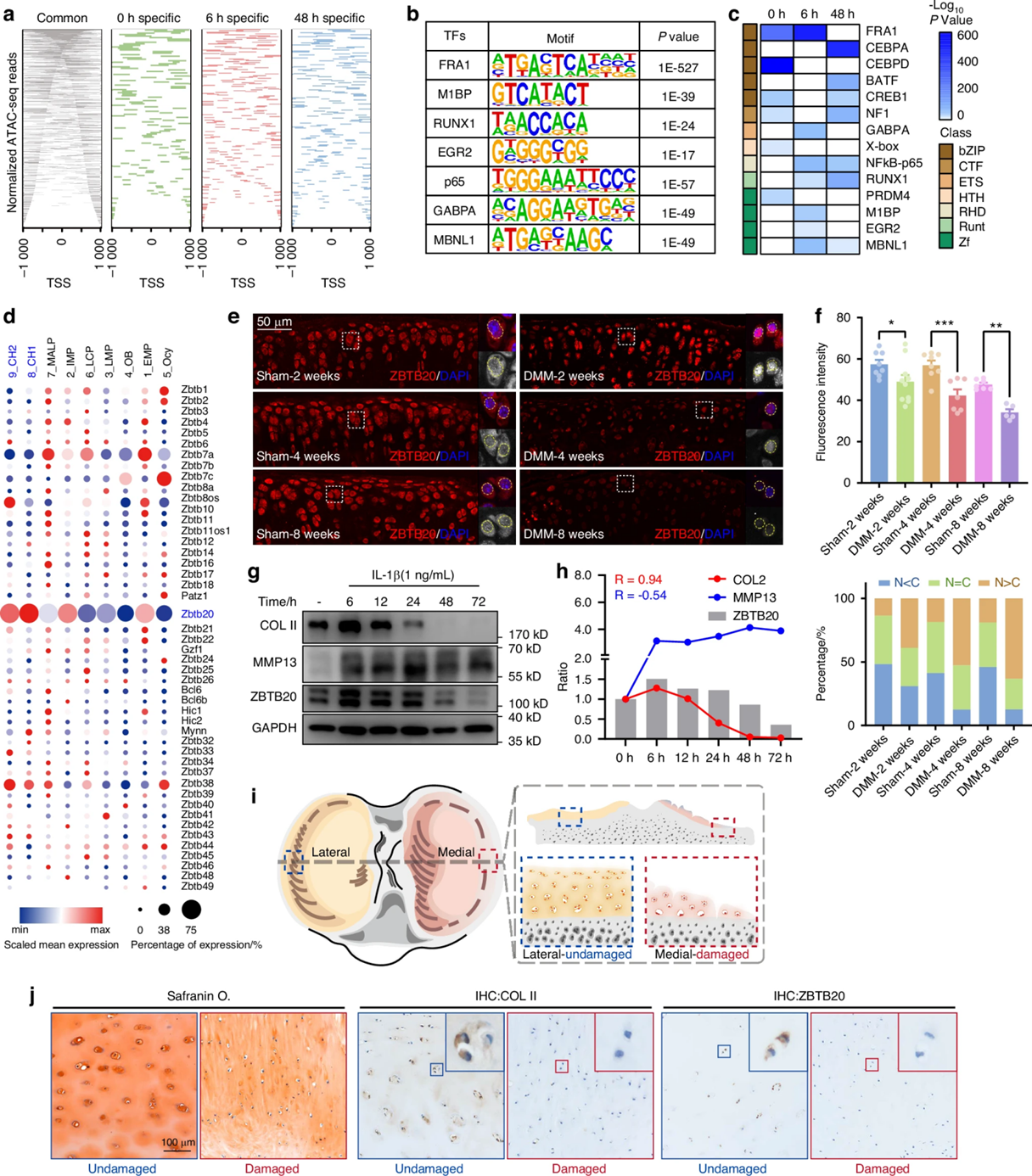
图1 转录因子ZBTB20在OA早期被激活
为进一步探究ZBTB20在OA病理进程中的功能,作者使用野生型和诱导型软骨特异性ZBTB20敲除小鼠构建OA模型。他莫昔芬注射2周后进行内侧半月板失稳(DMM)手术,组织学分析显示野生型小鼠OA模型组增生性软骨细胞数量的增加、OARSI评分升高、骨赘体积和软骨下骨板厚度的增加,提示模型建立成功,而Zbtb20敲除减轻了这些症状。ECM合成代谢和分解代谢的不平衡是软骨退化的主要原因,因此,作者检查了参与ECM稳态的蛋白的表达。免疫荧光染色结果显示Zbtb20敲除可显著恢复由DMM手术所引起的软骨ECM成分(COL II和ACAN)的减少,以及ECM降解酶(MMP13和ADAMTS5)的异常表达。此外,使用Cre腺病毒在Zbtb20f/f小鼠分离培养的软骨细胞中敲除Zbtb20抑制了IL-1β诱导的ECM稳态破坏,包括抑制MMP3、MMP13、ADAMTS5的异常上调和COL II的异常下调,而Zbtb20过表达则加剧了稳态的破坏。这些发现共同表明ZBTB20可通过破坏ECM稳态来加速OA疾病发展。
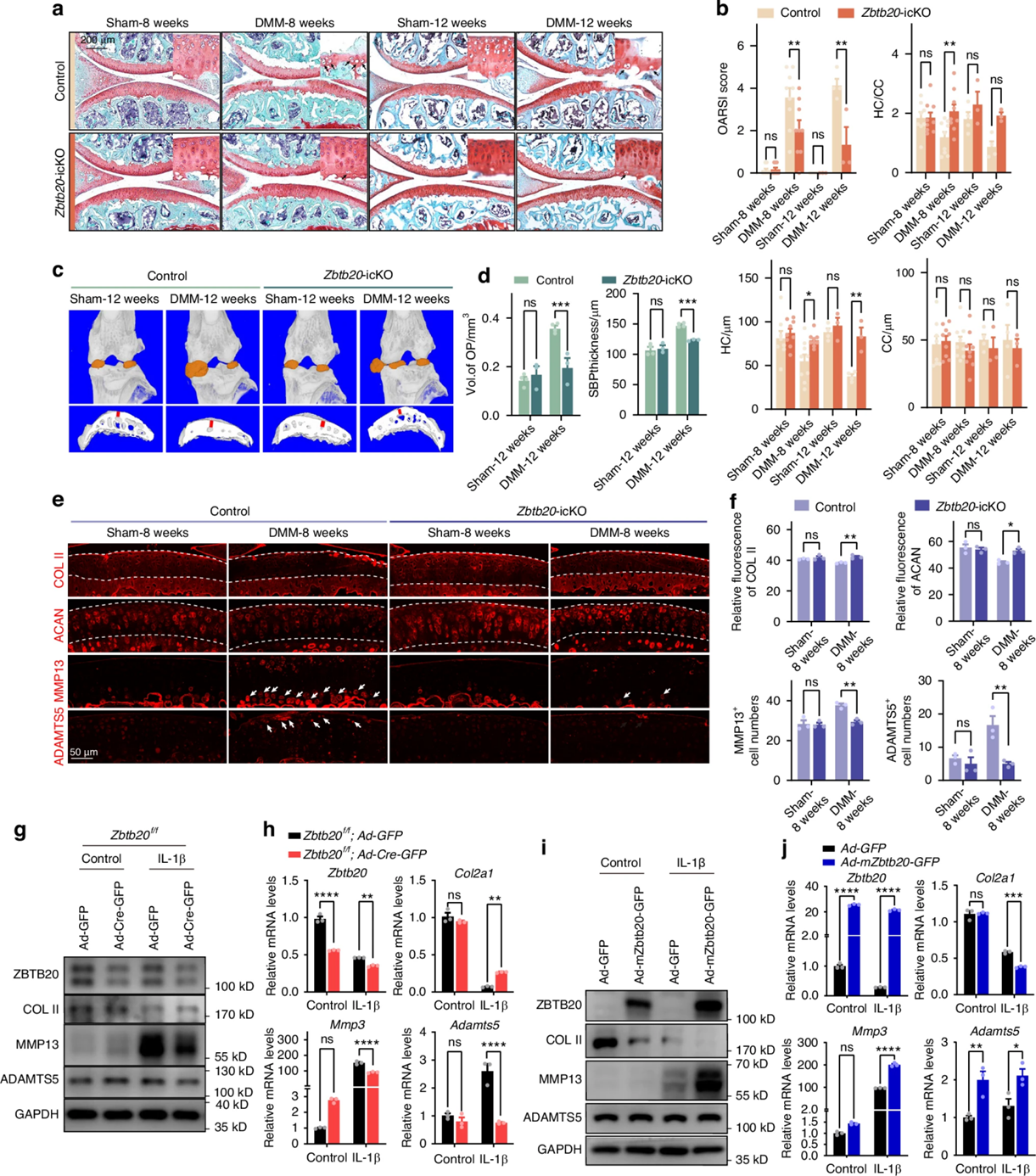
图2 ZBTB20的下调减弱OA发展
在前期实验中,作者发现NF-κB信号在IL-1β处理的软骨细胞中特异性上调,且Zbtb20缺失抑制了NF-κB信号激活,这表明ZBTB20可能触发了NF-κB信号传导。为了阐明ZBTB20激活NF-κB信号的潜在方式,作者对比WT和Zbtb20敲除软骨细胞的转录组差异,结果显示差异基因在PI3K-Akt信号通路中高度富集,WB结果显示IL-1β处理和过表达Zbtb20均可显著上调AKT蛋白磷酸化水平,而敲除Zbtb20抑制了IL-1β诱导的AKT蛋白磷酸化水平上升,这一结果提示PI3K-Akt信号是ZBTB20的下游效应通路。通过CUT&Tag-seq和ChIP-qPCR分析,作者发现Pten基因是ZBTB20与PI3K-Akt信号通路之间的关键调控因子,ZBTB20可与Pten的启动子区域结合。Zbtb20过表达或敲除的软骨细胞中的功能实验显示,PTEN表达变化与p65(NF-κB亚基)磷酸化呈负相关,进一步表明了ZBTB20对PTEN的抑制作用。此外,RT-qPCR的结果显示在IL-1β诱导的软骨细胞中,SC79(PI3K-Akt信号激活剂)破坏了Zbtb20敲除介导的ECM稳态恢复,MK2206(PI3K-Akt信号抑制剂)则恢复了Zbtb20过表达诱导的ECM稳态失衡。这些结果表明NF-κB介导的ZBTB20对ECM稳态的干扰需要ZBTB20抑制Pten表达,激活下游PI3K-Akt信号。
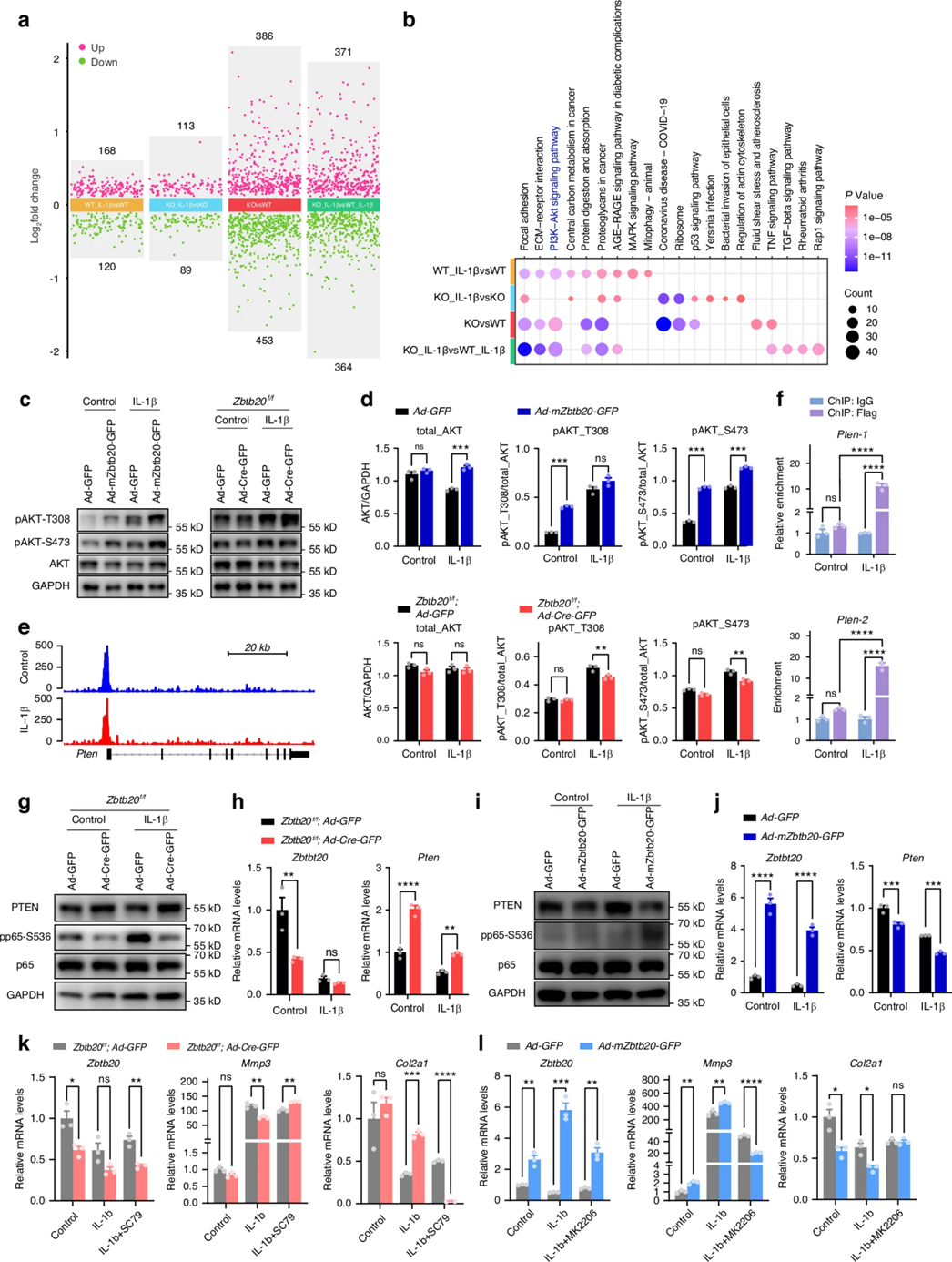
图3 ZBTB20通过抑制Pten激活NF-κB信号
研究团队在观察ZBTB20细胞亚定位时发现,软骨细胞中ZBTB20的细胞核积累以IL-1β剂量依赖性增加。基于果蝇研究中Warts激酶(又称LATS1)直接与ZBTB20同源物Lola相互作用的机制基础,作者探索了LATS1对ZBTB20的调控作用。WB结果显示IL-1β处理的软骨细胞以及DMM诱导的OA软骨中LATS1的磷酸化修饰增加;使用Flag-ZBTB20/Myc-LATS1共转染的Co-IP实验和TurboID临近标记技术的结果均验证了ZBTB20和LATS1之间存在相互作用,并且该作用可被IL-1β抑制。此外,TRULI(LATS1/2抑制剂,可抑制LATS1磷酸化)可抑制IL-1β诱导的ZBTB20细胞核积聚。这些结果共同揭示了,激酶LATS1可被IL-1β诱导磷酸化,通过减弱与ZBTB20的相互作用,进而驱动ZBTB20核易位以执行转录调控功能。
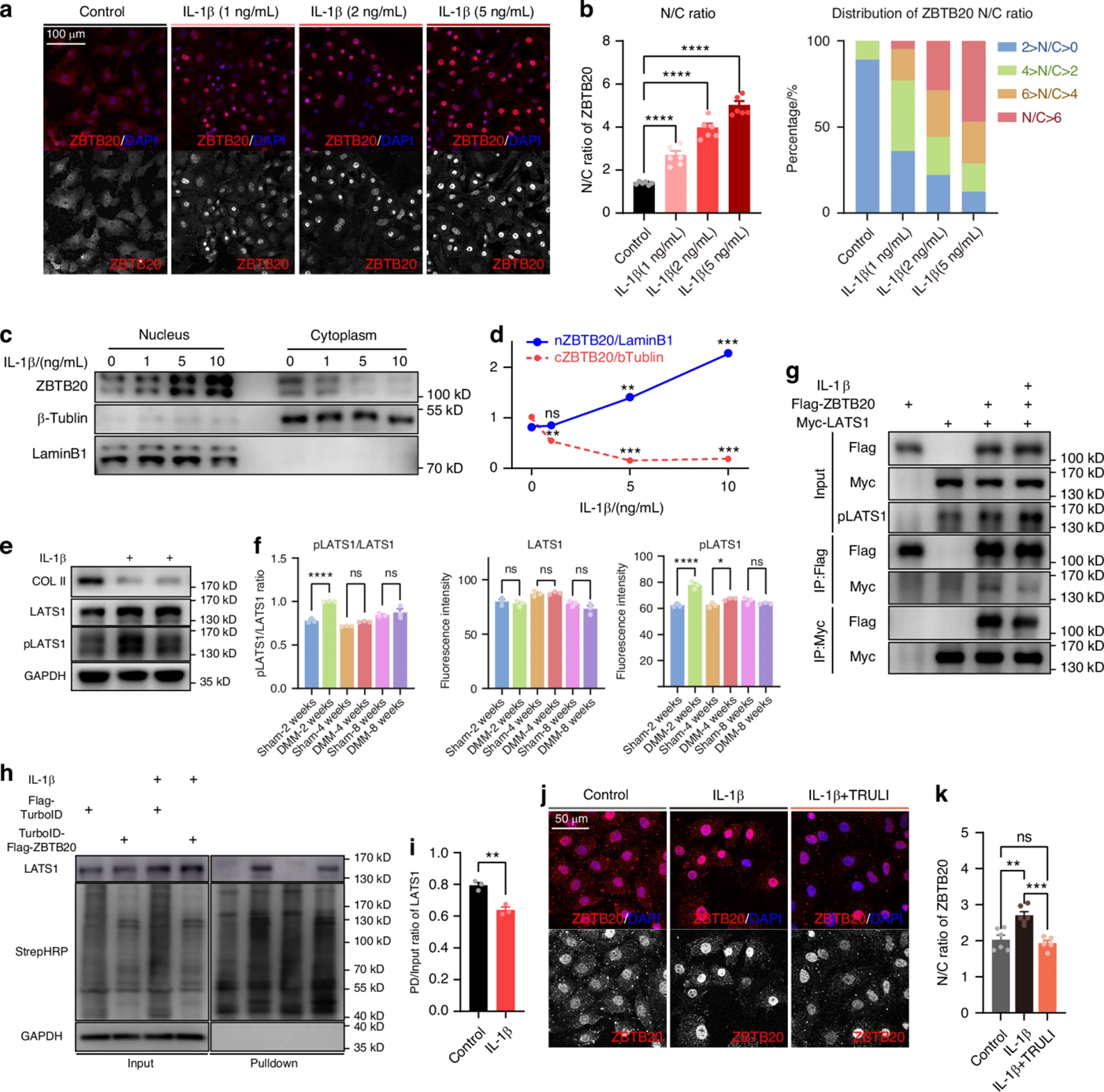
图4 LATS1调控ZBTB20的细胞亚定位
接下来,作者评估了靶向干预策略恢复ECM平衡的可行性。结果表明,TRULI在IL-1β诱导刺激下以剂量依赖的方式恢复了的ECM的合成、阻断了ECM的降解。另一种潜在的Zbtb20治疗药物达格列净(DAPA)可在IL-1β处理的软骨细胞中抑制Zbtb20表达,上调PTEN表达,并以剂量依赖性方式恢复ECM平衡。免疫荧光与WB分析证实,TRULI和DAPA抑制了IL-1β诱导的p65核转位。综上所述,靶向LATS1-ZBTB20信号轴或直接抑制ZBTB20表达的两种独立策略均可通过触发NF-κB信号传导,恢复ECM稳态。
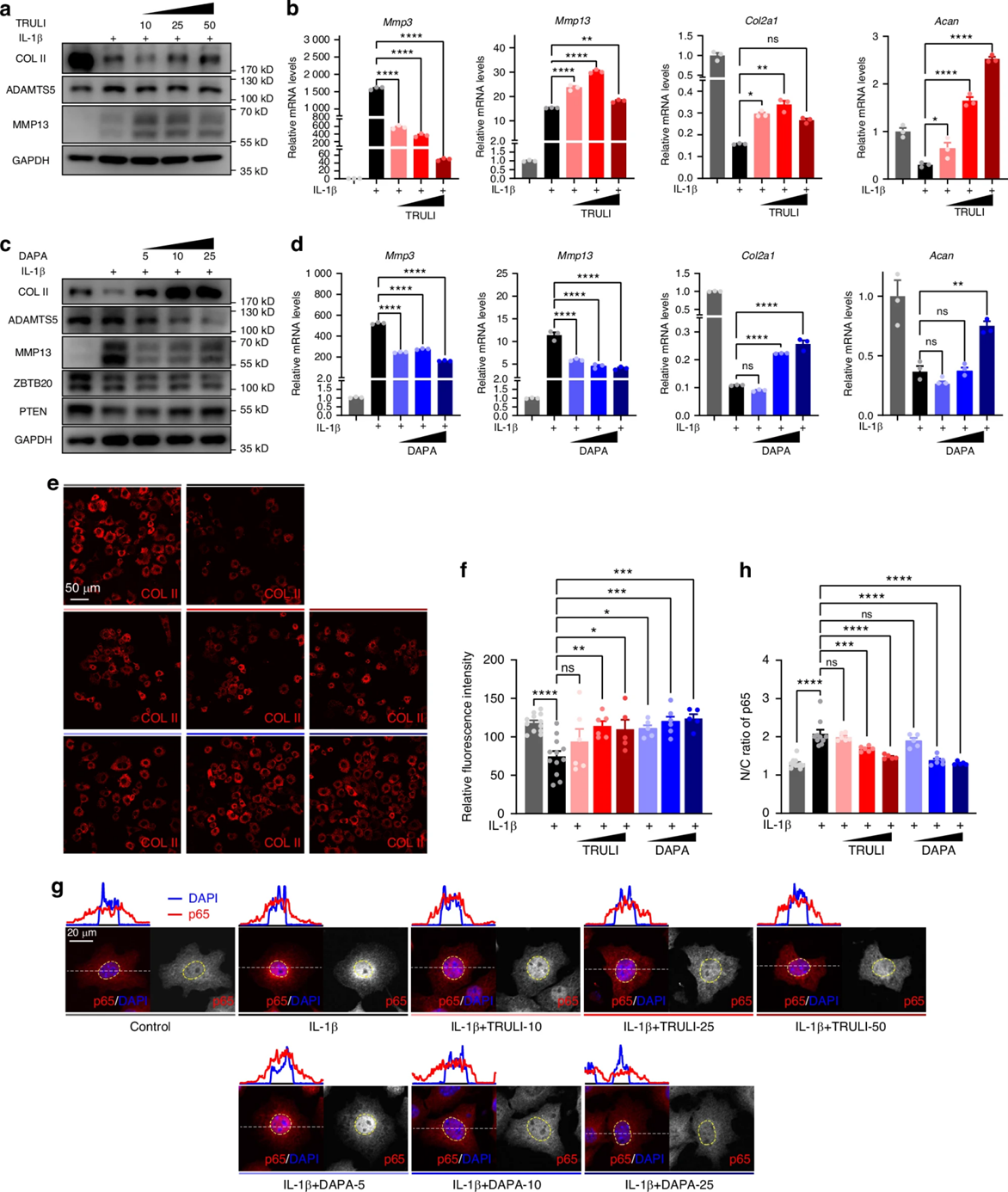
图5 TRULI和DAPA恢复软骨细胞的ECM稳态
前期研究已经证实DMM术后两周是OA发病机制的关键阶段,在此期间LATS1磷酸化,引起ZBTB20发生核转位。为了评估TRULI和DAPA在体内的潜在保护能力,作者评估了手术后立即给药和手术后2周给药的小鼠行为和组织病理变化。行为学结果显示,DMM手术导致小鼠腿部的绝对爪角增加、爪面积减少、站立时间缩短和摆动时间延长,手术后立即或2周后使用TRULI或DAPA可改善异常行为;在病理上,给药组的软骨基质丢失和软骨外围侵蚀均得到改善。在体外培养人软骨外植体的研究中,番红O(Safranin O)染色结果显示:TRULI或DAPA可显著且剂量依赖性地改善由IL-1β导致的蛋白多糖表面侵蚀和丢失;二甲基亚甲基蓝(DMMB)测定结果显示:药物组中软骨的糖胺聚糖(GAG)释放被显著抑制。最后,作者对原代软骨细胞进行了RNA-seq分析,发现TRULI和DAPA治疗可抑制多种炎症相关的通路:TRULI主要影响细胞周期调控通路,而DAPA主要靶向蛋白聚糖和ECM受体相互作用。这些发现表明TRULI和DAPA可通过不同机制缓解OA发展。
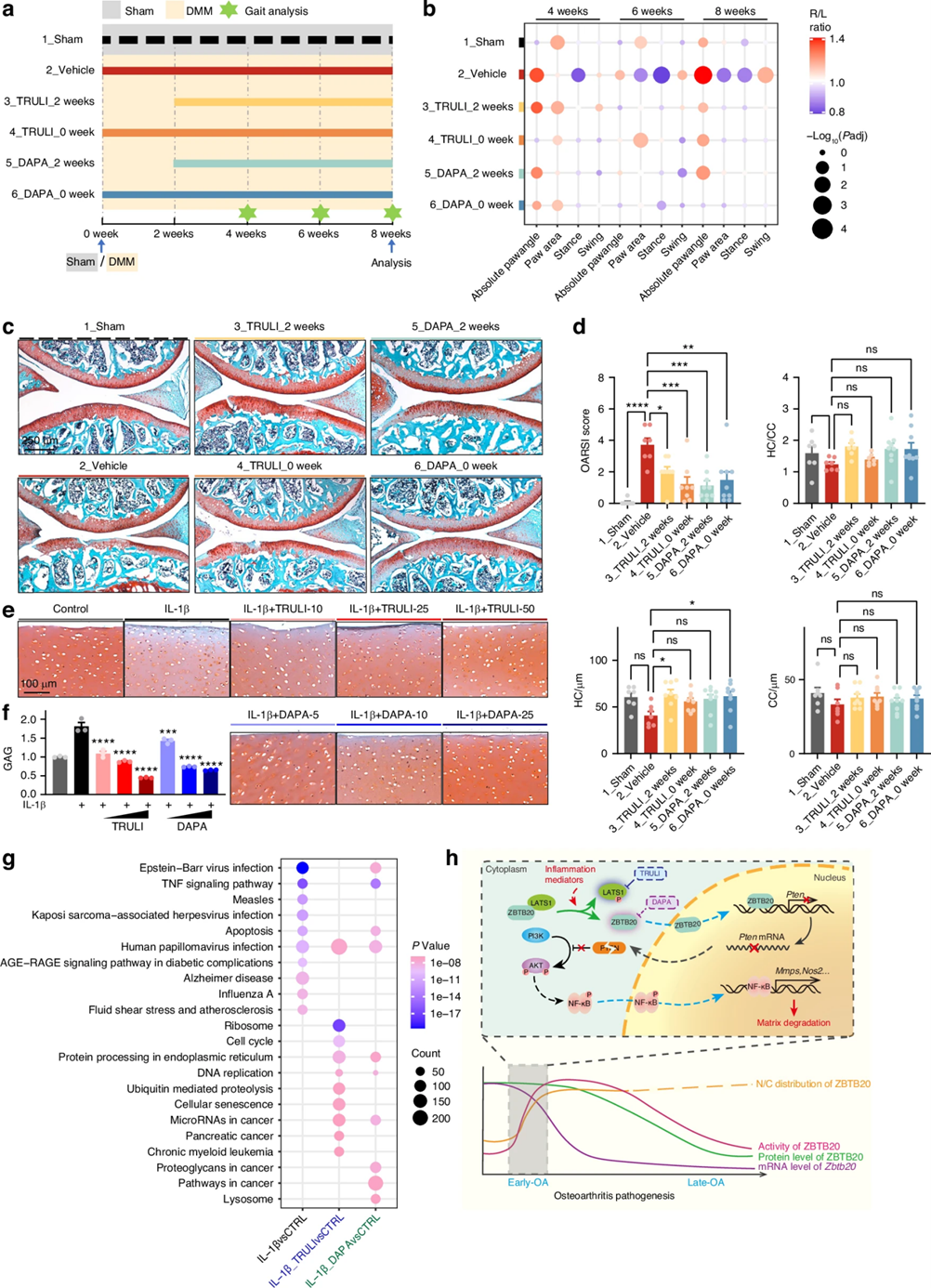
图6 TRULI和DAPA均可缓解OA病程发展
综上所述,本研究探索了转录因子ZBTB20对早期OA炎症反应和ECM稳态的关键作用,发现ZBTB20通过抑制Pten激活PI3K-Akt信号通路,进而激活NF-κB信号,破坏ECM稳态,而激酶LATS1通过磷酸化调控ZBTB20的亚细胞定位,促使其入核激活下游炎症通路。研究还证明小分子化合物TRULI和DAPA可调控ZBTB20可恢复ECM稳态,改善OA症状,这发现提出了以LATS1或ZBTB20为靶点早期OA的诊断和治疗提供了新靶点和潜在药物。

查看更多

查看更多

查看更多

联系我们

返回顶部