查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
肝细胞癌(HCC)占原发性肝癌的80%,是全球第六大常见癌症和第三大癌症相关死因。据研究预测,到2040年,全球肝癌的年发病率将上升55.0%,预计新增HCC病例约140万例,死亡病例约130万例。由于诊断较晚,HCC患者往往无法从手术治疗中获益,术后复发率也很高,5年复发率在50%至70%之间。尽管免疫检查点抑制剂等疗法取得了显著进展,但患者5年生存率仍低于20%。因此,深入了解 HCC 的发病机制对于靶向治疗和打破患者低生存率等瓶颈具有重要的研究意义。接下来要介绍的这篇文章主要介绍了靶向抑制ARD1(N-alpha-acetyltransferase 10,NatA catalytic subunit)可增强索拉非尼诱导的铁死亡,为HCC治疗提供新策略,我们一起来看看吧。

2025年8月21日,武汉大学袁玉峰教授团队在Cancer Research(IF=16.6)发表题为“The Acetyltransferase ARD1 Induces Glutathione Synthesis to Facilitate Ferroptosis Evasion in Hepatocellular Carcinoma”的研究论文,在这项研究中,作者先通过全基因组CRISPR-Cas9技术筛选确定了乙酰转移酶-ARD1是肝癌中谷胱甘肽(Glutathione,GSH)合成的关键因子,并发现ARD1以GSH依赖的方式促进肝癌细胞增殖并抑制铁死亡,通过代谢组学和免疫沉淀串联质谱等方法,作者发现ARD1通过稳定γ-谷氨酰半胱氨酸合成酶(glutamate-cysteine ligase catalytic subunit,GCLC)的mRNA来促进GSH的合成。在机制上,ARD1对PABPC1(poly(A) binding protein cytoplasmic 1)的K167处进行乙酰化,阻止其进入细胞核,并与eIF4G(Eukaryotic Translation Initiation Factor 4 Gamma)互作稳定GCLC mRNA,阻止其降解,增加GSH合成,最终赋予肝癌细胞抵抗铁死亡的能力。此研究表明ARD1是肝细胞癌的一种潜在治疗靶点,并为肝细胞癌细胞中GSH代谢的重新编程以及铁死亡的调控网络提供了新的见解。在此研究中,作者使用了汉恒生物提供的AAV8-shARD1成功敲低了小鼠肝脏中的ARD1。
下面我们一起来具体了解下这篇文章吧。
首先,作者通过靶向代谢组学以及TCGA数据库分析发现肝癌组织中GSH的代谢异常,随后,通过全基因组CRISPR/Cas9文库筛选发现ARD1是促进GSH合成及抵抗GSH耗竭的关键基因,敲除ARD1能显著降低γ-谷氨酰半胱氨酸(γ-GC)和GSH水平,并增强铁死亡敏感性。患者样本显示ARD1在肝癌组织中表达升高且与肿瘤分化程度呈负相关,Kaplan-Meier生存分析表明,ARD1的高表达提示患者生存期缩短,另外,与正常肝细胞相比,肝癌细胞中ARD1的表达水平更高。这些结果表明 ARD1 是GSH合成的关键调节因子,可作为肝癌患者的预后标志物。
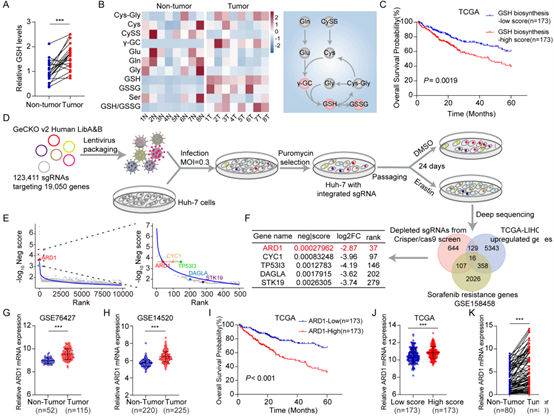
图1. ARD1是GSH合成过程中的关键促进因子,并且在肝癌患者中具有潜在的预后价值
为探究ARD1在肝癌发展中的具体作用,作者敲低了肝癌细胞中ARD1的表达,发现与对照组相比,ARD1敲低组中肝癌细胞的增殖显著被抑制,而过表达则相反,体内实验证实敲低ARD1可以抑制皮下肿瘤的生长。转录组学分析显示,ARD1水平与GSH代谢呈正相关。另外,作者发现即使无H2O2处理,敲低ARD1仍可升高细胞内ROS水平,而补充GSH前体—N-乙酰半胱氨酸(NAC)可部分逆转ARD1敲低导致的肿瘤细胞的增殖抑制,瘤内注射NAC能显著恢复ARD1敲低组中肿瘤的增殖能力。综上所述表明,ARD1通过调节GSH代谢来促进肝癌细胞的增殖。
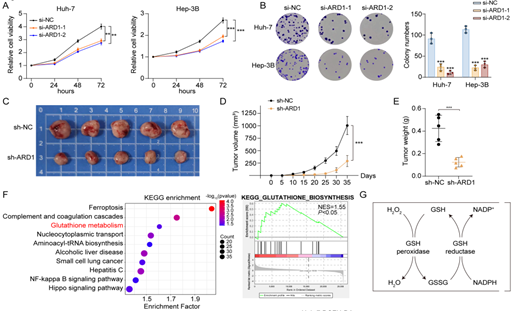
图2. ARD1通过调节GSH代谢来促进肝癌细胞的增殖
为了阐明ARD1在GSH合成中的作用,作者利用LC-MS/MS技术结合稳定同位素标记代谢组学研究了葡萄糖的代谢途径,结果显示ARD1缺失导致γ-GC及GSH水平显著降低,而对谷氨酸、丝氨酸等前体无影响,且m+2标记的[13C]-γ-GC及m+4标记的[13C]-GSH同工体水平下降,表明ARD1通过增强γ-GC生成来促进GSH的从头合成。随后,作者发现敲低ARD1抑制了GCLC的mRNA及蛋白水平,RNA稳定性实验揭示ARD1敲低会缩短GCLC mRNA的半衰期,但由于ARD1没有结合RNA的能力,所以作者推测其在稳定GCLC mRNA中的作用由其他蛋白介导,Co-IP结合RIP-qPCR实验证实PABPC1能直接结合GCLC mRNA,过表达PABPC1可逆转ARD1敲低导致的GCLC mRNA稳定性降低及增殖抑制,并能部分恢复ARD1敲低细胞的GSH合成能力。总之,这些分析表明ARD1通过PABPC1稳定GCLC mRNA,进而调控GSH的合成通路。
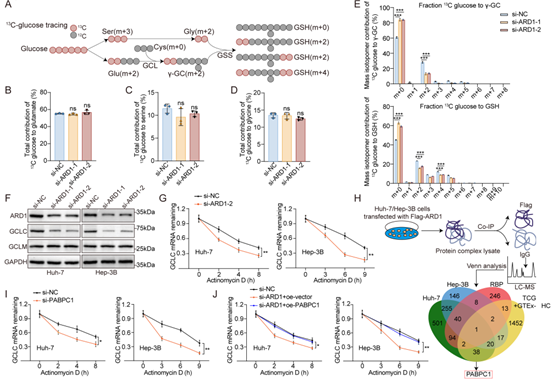
图3. ARD1通过PABPC1稳定GCLC mRNA,进而促进GSH的从头合成
随后,作者探究了ARD1与PABPC1之间互作的分子机制。Co-IP实验证实ARD1可以直接结合PABPC1,免疫荧光和双分子荧光互补实验显示二者存在共定位,IP结果显示ARD1通过C端结构域与PABPC1结合,体外乙酰化实验及截短突变体分析确认,PABPC1的K167位点能特异性地被ARD1乙酰化修饰。有研究表明,PABPC1在细胞质和细胞核之间穿梭移动,其细胞质形式主要是与eIF4G结合,通过诱导mRNA的环化来稳定mRNA,所以,作者接下来研究了乙酰化修饰对其蛋白定位的影响。PABPC1-K167Q(模拟乙酰化)与PABPC1-WT或PABPC1-K167R(模拟去乙酰化)相比,与eIF4G的结合能力最强,而PABPC1-K167R最弱。免疫荧光及蛋白互作实验证实importin α7是PABPC1核定位的主要介导因子,在与importin α7的结合能力上,PABPC1-K167Q<PABPC1-WT< PABPC1-K167R,而ARD1过表达可增加PABPC1的细胞质定位水平。综上所述,ARD1通过乙酰化PABPC1 K167位点削弱其与importin α7的互作,促进细胞质滞留,进而调控mRNA稳定性与翻译效率。
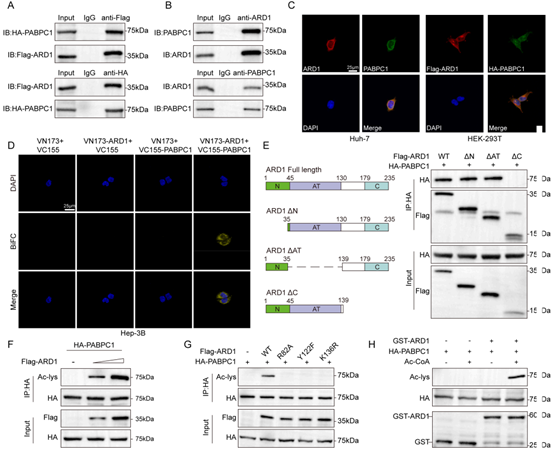
图4. ARD1在PABPC1的K167 位点对其进行乙酰化修饰,促进细胞质定位
作者进一步研究了PABPC1 K167乙酰化对GCLC mRNA稳定性的影响。与野生型PABPC1相比,K167Q突变体显著提高了GCLC的表达水平和mRNA稳定性。RNA免疫共沉淀实验显示,ARD1过表达显著增加了PABPC1在肝癌细胞中与GCLC mRNA的直接结合。此外,与PABPC1-WT相比,PABPC1-K167Q更有效地缓解了ARD1敲低对肝癌细胞的生长抑制和GSH从头合成的影响,流式细胞术分析表明,PABPC1-K167Q更有效地减少了由ARD1缺失导致的铁死亡标志物的增加。综上所述,PABPC1 K167乙酰化通过稳定GCLC mRNA调控肝癌细胞的氧化还原平衡。
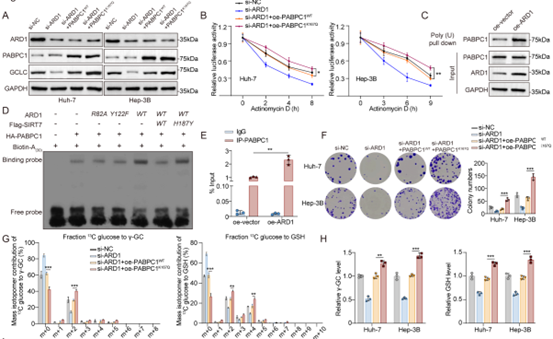
图5. PABPC1的K167乙酰化增加了其对GCLC mRNA的亲和力
为了探究 PABPC1的乙酰化是否受特定性生理因素的调控,作者对肝癌细胞进行应激处理,结果显示,在H2O2处理组中,PABPC1的乙酰化水平显著提高,并具有剂量依赖性,而H2O2处理能上调ARD1蛋白表达,但mRNA不变,研究发现是因为氧化应激降低了ARD1通过泛素途径进行的降解。作者进一步研究了氧化应激对谷胱甘肽合成过程中 ARD1-PABPC1-GCLC轴的影响,发现H2O2处理后,PABPC1的细胞质滞留增加,PABPC1与importin α7的结合减少,而与GCLC mRNA的结合增强,因此提高了GCLC mRNA稳定性及表达水平。另外同位素追踪实验表明,H2O2处理显著增加了γ-GC和GSH的含量。这些结果表明,氧化应激会引发PABPC1的乙酰化,并通过减少ARD1的泛素化降解来调节GSH的代谢。
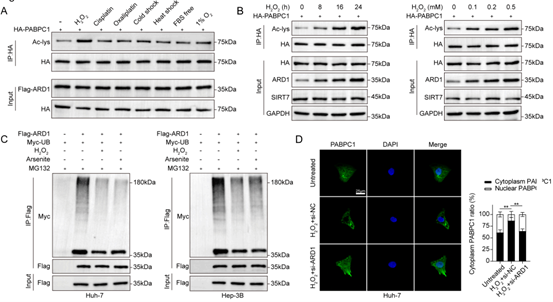
图6. 氧化应激可诱导ARD1介导的PABPC1乙酰化
为了探究 ARD1 在肝癌发展过程中的作用,作者构建了一个原位肝癌小鼠模型,结果表明 ARD1 缺失显著抑制了肿瘤的生长并减少了肿瘤组织中的γ-GC和GSH水平。另外,ARD1肝特异性敲除小鼠的肝癌模型中,敲除ARD1导致肝体重和体积降低,肝癌结节减少,而过表达则逆转此表型,同位素示踪实验显示,敲除ARD1可减少γ-GC和GSH,而恢复ARD1的表达可恢复代谢流。鉴于 ARD1 在GSH合成和铁死亡中的作用,作者评估了其与索拉非尼的协同效应。作者构建了人源肿瘤异种移植模型(patient-derived xenograft,PDX),并给与索拉非尼和/或AAV8-shARD1治疗,对于表达ARD1低水平的PDX中,对索拉非尼单药治疗的反应更好,对于表达ARD1高水平的PDX中,联合使用 AAV8-shARD1和索拉非尼显示出显著的抗肿瘤效果。临床样本分析发现在肝癌组织中GCLC和ARD1的表达之间存在显著的正相关关系,Kaplan-Meier分析显示,低表达 ARD1和GCLC与更好的预后相关。总之,结果表明,ARD1在体内可促进肝癌的发展,并且是改善索拉非尼疗效的治疗靶点。
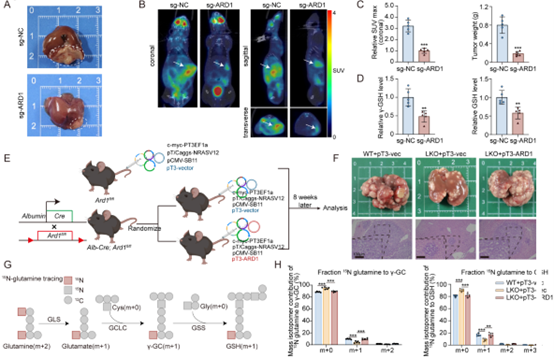
图7. ARD1在体内可促进肝癌的发展,并且是改善索拉非尼疗效的治疗靶点
综上所述,该研究阐明了乙酰转移酶ARD1会促进肝癌的发展,它通过上调GCLC来抑制铁死亡,从而促进谷胱甘肽的重新合成,并且可以通过靶向作用来提高索拉非尼的疗效,为基于铁死亡的肝癌靶向治疗提供了新策略。

查看更多

查看更多

查看更多

联系我们

返回顶部