查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
Netrin-1是一种胚胎分泌型层粘蛋白相关糖蛋白,在神经元信息传递、血管生成和细胞存活中发挥着关键作用。Netrin-1主要在胚胎发育过程中表达,但在很大一部分人类肿瘤中,它被癌细胞和肿瘤微环境重新表达。特别是在炎症相关的结肠直肠癌、转移性乳腺癌、肺癌、神经母细胞瘤、淋巴瘤和黑色素瘤中,这种情况已经得到证实。在模拟这些疾病的临床前模型中,网织蛋白-1 及其受体之间的干扰足以引发癌细胞死亡并诱导肿瘤生长抑制。基于这些发现,一种能中和网织蛋白-1 并阻断网织蛋白-1-UNC5B 相互作用的单克隆抗体(mAb)被开发出来。
2023年8月2日,发表在《Nature》杂志上的一篇题为“Netrin-1 blockade inhibits tumour growth and EMT features in endometrial cancer”的文章,研究了Netrin-1在子宫内膜癌(endometrial carcinomas,ECs)中的表达情况,实验结果也表明了使用抗Netrin-1抗体(NP137)可以有效减少EC小鼠模型中的肿瘤进展。
现汉恒有Netrin-1相关基因产品,超值限量活动!

首先,作者使用Pten f/f缺失小鼠模型(即他莫昔芬诱导的CAG-CreERT+/-启动子)来重现EC进展情况。用NP137(10 mg kg-1,每周三次)处理对照组和Pten缺失小鼠3-4周,并分析netrin-1的表达和肿瘤进展。Pten 基因缺失后,小鼠肿瘤中的 netrin-1 上调,而 NP137 治疗后这种上调降低。病理学家观察到NP137 治疗后癌细胞数量减少,子宫内膜组织更健康。同样,在用 NP137 治疗的小鼠甲状腺中也观察到了抗肿瘤活性。这些结果表明,在EC中靶向netrin-1可抑制肿瘤进展。
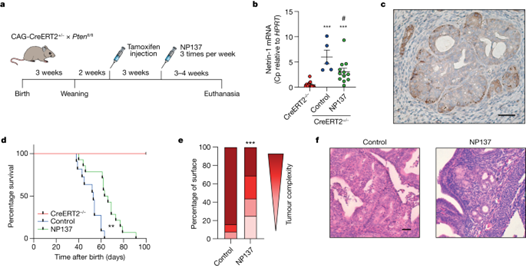
图1. 阻断 Netrin-1 可抑制临床前模型中子宫内膜腺癌的发展
之前的研究结果表明,阻断内皮素-1 是一种可行的癌症治疗策略,基于此,作者开发了一种用于临床的netrin-1阻断抗体,目前正在进行 I/II 期评估。从正在进行的 1 期研究中提取了 14 例 EC 患者的疗效数据。在这项研究中,NP137 作为单药疗法每两周给药一次(Q2W),直到临床/放射学进展为止。没有观察到剂量限制性毒性,超过半数的患者(14 人中有 8 人)的最佳反应是疾病控制(疾病稳定)(最佳总体反应,疾病稳定,57.1%)。此外,一名 74 岁的女性晚期心肌梗死患者获得了 RECIST1.1 定义的部分反应。该患者最初的诊断结果显示其为子宫内膜样病变,微卫星表型稳定,表达 CK7、PAX8 和雌激素受体,但没有表达 CK20 或孕酮受体。在使用 NP137 之前,她曾接受过多种治疗尝试,包括辅助放疗和卡铂-紫杉醇治疗,然后使用鲁比替丁作为转移性疾病的一线治疗,以及第二次使用卡铂-紫杉醇治疗,但尽管使用了这些治疗方法,肝转移灶仍出现了进展。入院时进行的正电子发射计算机断层扫描(PET-CT)证实了氟脱氧葡萄糖的强烈摄取(C1D1之前)。她接受了 14 毫克/公斤-1 静脉注射 NP137 Q2W,并在 6 周后(即 NP137 第 3 周期后)接受了 PET-CT 扫描,结果显示,根据 RECIST v.1.1 标准,肝脏靶病灶缩小了 51%,出现了部分反应。3 个月时 PET-CT 扫描证实了初步反应,6 个月时靶病灶缩小 55%,再次证实了初步反应。该患者在接受了 17 个周期的 NP137 治疗后,最终出现了疾病进展,并继续接受了来曲唑 A、免疫疗法和他莫昔芬等其他治疗,但未再出现客观肿瘤反应。
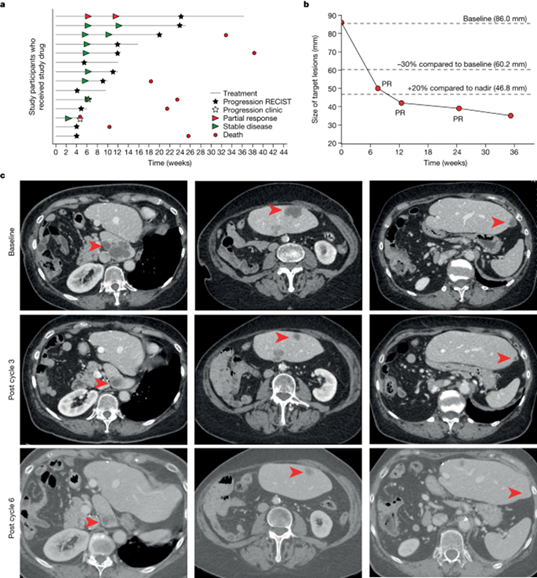
图2. EC患者接受NP137治疗后的临床反应
为了深入了解将netrin-1阻断与肿瘤生长抑制联系起来的潜在机制,首先根据netrin-1阻断的假设作用模式,分析了在用NP137治疗的Pten f/f肿瘤中,肿瘤生长抑制是否与肿瘤细胞死亡有关。通过对活性 caspase-3 的 IHC 检测,NP137 增加了癌症凋亡。接下来,对接受 NP137 治疗与未接受治疗的 Pten f/f 小鼠肿瘤进行了 RNA 序列分析。在服用 NP137 后改变的通路/基因中,观察到 EMT 相关基因在治疗后有所减少。一些体外研究表明,netrin-1参与了EMT,它通常与PI3K/AKT通路有关,而PI3K/AKT通路在子宫内膜癌中经常发生改变。随后研究了 NP137 是否会影响 Pten f/f 小鼠模型中肿瘤的 EMT。首先评估了对照组与经 NP137 处理的肿瘤中 EpCAM 上皮标记物的表达情况,结果发现经 NP137 处理的肿瘤中这种上皮标记物的表达有统计学意义的显著增加。为了更全面地了解肿瘤基因的表达情况,采用了一种常用的胰腺癌 EMT 特征,该特征可用于确定 EMT 评分。观察到,用NP137治疗后,EMT评分降低,间质基因表达减少,上皮基因表达增加。这些临床前数据支持这样一种观点,即阻断netrin-1对肿瘤细胞具有双重作用:引发癌细胞死亡和抑制EMT特征,使NP137处理过的肿瘤总体上更具上皮性。
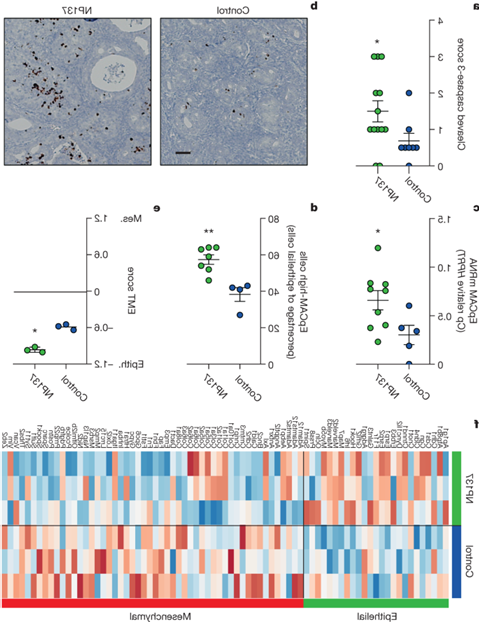
图3. 在临床前小鼠模型中,阻断 Netrin-1 可诱导细胞凋亡并抑制 EMT
接下来要确定的是,在临床前模型中观察到的对EMT特征的抑制是否也发生在接受NP137治疗的患者身上。在 NP137 1 期试验中,在上述 EC 患者中收集了纳入时(C1D1)和使用抗网状蛋白-1 复合物治疗 1 个月后(即第三次输注 NP137 之前(C3D1))的配对活检组织。对治疗前和治疗时的 12 个成对活检组织成功进行了大容量 RNA 序列分析。发现注射两次NP137就足以使上述胰腺癌EMT评分显著下降,这表明在接受NP137治疗1个月后,患者的肿瘤表型总体上更加上皮化。在接受 NP137 治疗的患者肿瘤样本中,EpCAM IHC 染色增加,证实了肿瘤上皮表型的转变。还观察到共同表达泛影角蛋白和波形蛋白的肿瘤细胞比例有所下降。

图4. NP137治疗可抑制EC患者的EMT
为了将这些研究扩展到单细胞水平,直接对一名晚期 EC 患者在 NP137 试验中纳入时(C1D1,9,216 个细胞)和治疗 1 个月后(C3D1,7,159 个细胞)获得的新鲜活检组织进行了 3′单细胞 RNA-seq 分析(10x Genomics Next GEM 3′kit)。无监督聚类显示存在不同的细胞群,包括肿瘤细胞(表达 EpCAM、PGR 和 TFF3,这些都是 EC 的标记)、免疫细胞(以 CD45 (PTPRC) 表达为标志)、癌症相关成纤维细胞(CAF,以 αSMA (ACTA2) 为标志)和内皮细胞(PECAM1 阳性)。使用NP137治疗后,肿瘤细胞区系的减少在统计学上有显著意义。NP137 治疗两个周期后,抗netrin-1治疗后的肿瘤细胞比例降低了 3.19 倍。值得注意的是,除了癌细胞的净减少外,还注意到整个肿瘤区的 EMT 评分也有统计学意义的显著下降,这表明 NP137 治疗后肿瘤表型总体上更加上皮化。
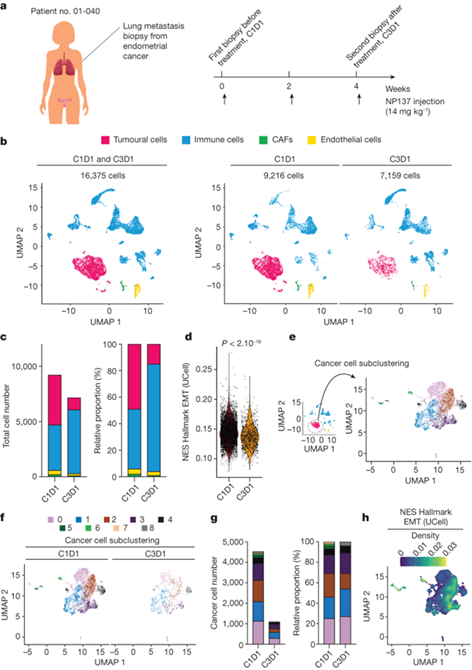
图5. 一名心肌梗死患者活检前后的单细胞 RNA 序列分析
肿瘤区发生的变化也与基质细胞的变化有关。值得注意的是,NP137 处理似乎对免疫细胞产生了明显的影响。更具体地说,在 NP137 治疗后,观察到具有细胞毒性功能的淋巴细胞(CD8+ T 细胞和自然杀伤(NK)细胞)有所增加。值得注意的是,NP137 治疗后,在 01-40 号患者的单细胞分析以及 01-034 和 01-039 号患者的空间转录组数据中发现,T 细胞与肿瘤细胞之间的相互作用在数量和强度上都有所增加。特别是,单细胞RNA-seq数据显示,CD8+ T细胞与肿瘤细胞之间相互作用的数量和强度都有所增加。NP137 治疗与更有效的抗原递呈细胞 (APC) 有关,因为观察到与癌细胞相互作用的抗原递呈细胞明显从 C1D1 中的单核细胞转变为 C3D1 中的树突状细胞。
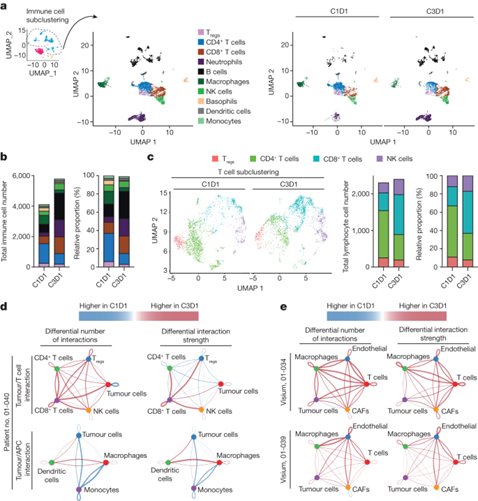
图6. 从一名子宫内膜腺癌患者活检前后的单细胞 RNA 截图分析中观察到的免疫学变化
总之,本研究利用临床前模型以及EC患者治疗前和治疗中的活组织切片证明,NP137的全身治疗可减少肿瘤的EMT特征。通过单细胞分析表明,EMT 特征的变化与肿瘤微环境的变化有关。该结果表明,Netrin-1阻断是一种临床策略,可同时触发肿瘤剥脱和EMT抑制,从而有可能减轻对标准疗法的耐药性。

查看更多

查看更多

查看更多

联系我们

返回顶部