查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期文章主要阐述了NADPH氧化酶(NOXs)在铁死亡中的作用,NOX生成活性氧(ROS)引发脂质过氧化进而诱导细胞铁死亡,除NOXs外,脂氧合酶(LOXs)、细胞色素P450酶(CYP450)和环氧合酶(COXs)均在生成ROS诱导细胞铁死亡的过程中发挥了重要作用。它们在ROS生成过程中扮演了什么角色?又是通过什么途径诱导了细胞的铁死亡呢?本期文章将着重介绍LOXs在铁死亡中的作用。

LOXs是一个脂质过氧化酶家族,能够将多不饱和脂肪酸(PUFA)氧化成相应的氢过氧化物衍生物[1]。1975年科学家首次在动物体内发现LOXs[2],1988年在人源细胞中检测到LOXs[3],目前在人类基因组中已发现6种亚型:ALOX5、ALOX15、ALOX15B、ALOX12、ALOX12B、ALOXE3,其中ALOX15和ALOX12在神经退行性疾病和癌症方面有大量研究报道,这两个基因与铁死亡密切相关;LOXs的其他几个成员暂未发现与铁死亡有直接关联,可能参与哮喘、动脉粥样硬化和神经退行性疾病的发生。接下来,小恒将一一阐述其功能。
1. ALOX15——诱导铁死亡的关键因子
ALOX15参与的铁死亡信号通路上游主要有两个基因ACSL4和LPCAT3(图1)。ACSL4优先识别细胞内的花生四烯酸(AA)和肾上腺素酸(AdA),将其与辅酶A(CoA)连接,生成AA-CoA和AdA-CoA,接着通过LPCAT3并入溶血磷脂酰乙醇胺(lysoPE)得到PE-AA和PE-AdA[4]。PE-AA和PE-AdA则是铁死亡信号传导过程中最关键的磷脂(PL)[5]。ALOX15是如何选择性地氧化PUFA-PL底物呢?Wenzel等[6]人利用各种表达ALOX15的细胞类型,报道了一种混杂的小支架蛋白——磷脂酰乙醇胺结合蛋白1(PEBP1),该蛋白会与ALOX15形成复合物。PEBP1含有多个结合游离AA的位点,并通过结合降低了可用于氧化的AA水平,通过“消耗”内源性AA并与ALOX15结合,PEBP1将PE-AA定向为ALOX15的酶底物。接着ALOX15将PE-AA和PE-AdA氧化成PE-AA-OOH和PE-AdA-OOH,当OOH-PE产物在细胞中大量积累,这些细胞就会通过铁死亡被清除。
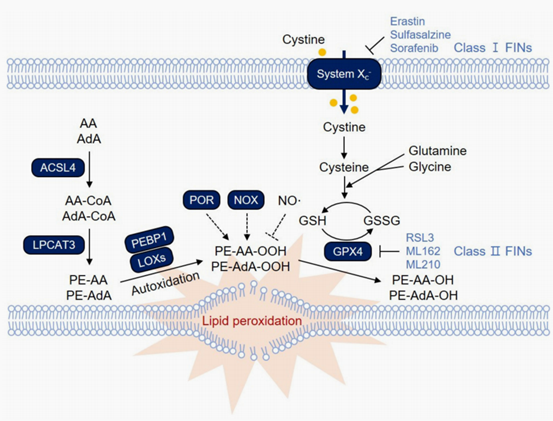
图1 脂质过氧化信号通路[4]
然而ALOX15引发脂质过氧化诱导铁死亡的过程并非“一帆风顺”,多项研究表明ALOX15引发的脂质过氧化可被GPX4抑制。GPX4是谷胱甘肽(GSH)依赖性抗氧化剂,是细胞防御脂质过氧化的主要酶,其活性的抑制是铁死亡发生的关键因素[7]。GPX4通过减少膜结合的过氧化磷脂,促进细胞中磷脂氢过氧化物(OOH-PL)的还原,并通过将OOH-PL转化为无毒的脂质醇来抑制细胞中的铁死亡,沉默GPX4会增强ALOX15依赖的脂质过氧化[8]。但GPX4的还原作用也会被过量的ALOX15抑制,ALOX15产生OOH-PE代谢物与GPX4将其还原为羟基(OH)代谢物之间的平衡是细胞存活和铁死亡之间的枢纽点[5]。
铁死亡过程中ALOX15氧化PE-AA和PE-AdA的过程中释放大量ROS,这在一定程度上也会影响Fenton反应。ROS是由于氧的不完全还原而形成的,包括超氧阴离子(O2·−)、H2O2和羟基自由基(HO·),其中H2O2与Fe2+反应生成Fe3+、HO·和OH-,这一过程称为Fenton反应。该反应产生的自由基离子对各种成分造成氧化损伤,包括膜脂、蛋白质和核酸。随着ROS浓度持续增加,超过正常生理范围,将进一步影响生物膜功能和结构,引起细胞铁死亡[9]。
2. ALOX12——参与P53介导的铁死亡
相比ALOX15参与铁死亡的众多研究报道,ALOX12在铁死亡中的作用直至2019年才被揭示。P53能够通过下调SLC7A11间接激活ALOX12,导致ROS的生成和积累进而诱导铁死亡[10]。与上述信号通路不同的是,P53介导的铁死亡无法通过GPX4抑制,需上调SLC7A11或沉默ALOX12来抑制。另外,P53介导的铁死亡中也有ALOX15的身影,ALOX15受到SAT1的间接调控,而SAT1是P53的转录靶基因。有研究表明,P53通过激活SAT1上调ALOX15的表达水平,进而导致ROS积累引起脂质过氧化和铁死亡[11],而SAT1调控ALOX15的分子机制尚不清楚。
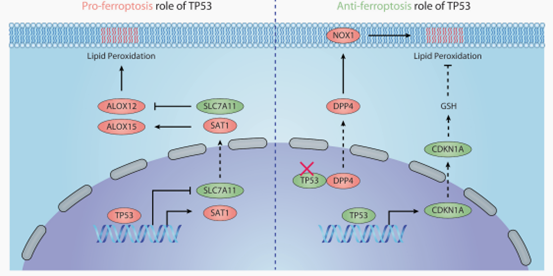
图2 TP53介导的铁死亡[12]
3. LOXs其他成员——暂未发现与铁死亡有密切关联
ALOX5是免疫反应中的关键调节因子,主要催化AA的氧化反应,生成5-羟基花生四烯酸(5-HETE),进而生成白细胞三烯B4(LTB4),促进中性粒细胞的趋化和激活,参与多种炎症性疾病的发生发展[13]。此外,也有诸多该基因与动脉粥样硬化、阿尔兹海默症和癌症相关的研究报道[14]。而ALOX5与铁死亡之间的研究较为有限,主流观点认为ALOX5催化AA过程中可能产生ROS,ROS的积累间接推动铁死亡的发生[15]。
ALOX12B、ALOXE3、ALOX15B这三个亚型目前相关研究相对较少。ALOX12B和ALOXE3主要在上皮细胞中表达,在角质层脂质膜的合成和皮肤水分流失屏障的建立中起着至关重要的作用,二者的突变体(包括提前终止和移码)都可能导致鱼鳞病和非毛囊性先天性鱼鳞病样红皮病[16]。ALOX15B在皮肤、前列腺、肺、角膜和巨噬细胞中表达,有研究显示其在前列腺癌[17]和乳腺癌[14]中具有抑癌作用。研究人员在颈动脉斑块巨噬细胞中检测到ALOX15B表达上调,敲低ALOX15B后巨噬细胞中脂质积累减弱,认为该基因与动脉粥样硬化的发病机制有关[18]。目前尚未有研究表明这三个基因与铁死亡相关。
在小鼠基因组中,除了与人类同源的6种亚型,还有ALOX5AP亚型,其主要在骨髓细胞中表达,能够激活ALOX5的表达,参与哮喘、动脉粥样硬化和神经退行性疾病的发生发展。
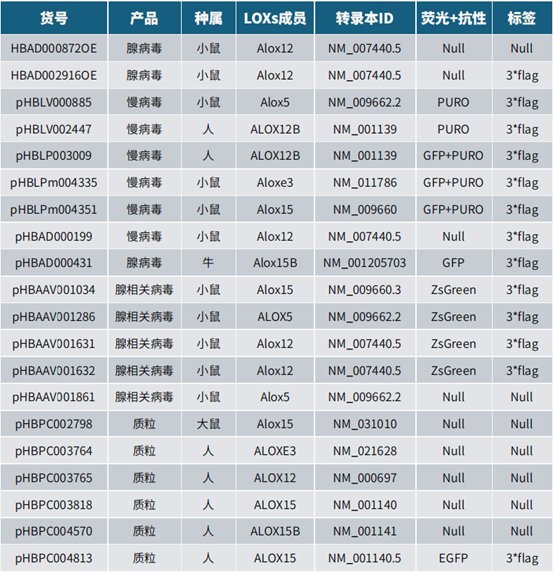
本期主要介绍了LOXs家族中各个亚型的功能,并详细阐述了ALOX12和ALOX15诱导铁死亡的分子机制。汉恒生物专营病毒包装十余载,建立了庞大的基因研究现货工具库,现可提供LOXs基因过表达相关产品,也可定制靶向特异性组织或细胞的基因调控工具,包括慢病毒(Lentivirus,LV)、腺病毒(Adenovirus,AD)、腺相关病毒(Adeno-associated-virus,AAV)以及质粒等,如有技术或产品需求,欢迎随时咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。本期内容到这里就结束了,下期我们将会继续分享参与铁死亡调控的基因,敬请关注。
表1 汉恒生物LOXs相关现货
参考文献:
[1] KUHN H, WALTHER M, KUBAN R J. Mammalian arachidonate 15-lipoxygenases structure, function, and biological implications [J]. Prostaglandins Other Lipid Mediat, 2002, 68-69(263-90.
[2] SCHEWE T, HALANGK W, HIEBSCH C, et al. A lipoxygenase in rabbit reticulocytes which attacks phospholipids and intact mitochondria [J]. FEBS Lett, 1975, 60(1): 149-52.
[3] SIGAL E, GRUNBERGER D, CASHMAN J R, et al. Arachidonate 15-lipoxygenase from human eosinophil-enriched leukocytes: partial purification and properties [J]. Biochem Biophys Res Commun, 1988, 150(1): 376-83.
[4] LEE J Y, KIM W K, BAE K H, et al. Lipid Metabolism and Ferroptosis [J]. Biology (Basel), 2021, 10(3): 184.
[5] KAGAN V E, MAO G, QU F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis [J]. Nat Chem Biol, 2017, 13(1): 81-90.
[6] WENZEL S E, TYURINA Y Y, ZHAO J, et al. PEBP1 Wardens Ferroptosis by Enabling Lipoxygenase Generation of Lipid Death Signals [J]. Cell, 2017, 171(3): 628-41.e26.
[7] FORCINA G C, DIXON S J. GPX4 at the Crossroads of Lipid Homeostasis and Ferroptosis [J]. Proteomics, 2019, 19(18): e1800311.
[8] SCHNURR K, BELKNER J, URSINI F, et al. The selenoenzyme phospholipid hydroperoxide glutathione peroxidase controls the activity of the 15-lipoxygenase with complex substrates and preserves the specificity of the oxygenation products [J]. J Biol Chem, 1996, 271(9): 4653-8.
[9] STOCKWELL B R, JIANG X, GU W. Emerging Mechanisms and Disease Relevance of Ferroptosis [J]. Trends Cell Biol, 2020, 30(6): 478-90.
[10] CHU B, KON N, CHEN D, et al. ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway [J]. Nat Cell Biol, 2019, 21(5): 579-91.
[11] KANG R, KROEMER G, TANG D. The tumor suppressor protein p53 and the ferroptosis network [J]. Free Radic Biol Med, 2019, 133(162-8.
[12] CHEN X, LI J, KANG R, et al. Ferroptosis: machinery and regulation [J]. Autophagy, 2021, 17(9): 2054-81.
[13] ZHURAVLEV A, GAVRILYUK V, CHEN X, et al. Structural and Functional Biology of Mammalian ALOX Isoforms with Particular Emphasis on Enzyme Dimerization and Their Allosteric Properties [J]. Int J Mol Sci, 2024, 25(22): 12058.
[14] WU Z H, TANG Y, YU H, et al. The role of ferroptosis in breast cancer patients: a comprehensive analysis [J]. Cell Death Discov, 2021, 7(1): 93.
[15] UN Q Y, ZHOU H H, MAO X Y. Emerging Roles of 5-Lipoxygenase Phosphorylation in Inflammation and Cell Death [J]. Oxid Med Cell Longev, 2019, 2749173.
[16] ZHENG Y, YIN H, BOEGLIN W E, et al. Lipoxygenases mediate the effect of essential fatty acid in skin barrier formation: a proposed role in releasing omega-hydroxyceramide for construction of the corneocyte lipid envelope [J]. J Biol Chem, 2011, 286(27): 24046-56.
[17] SURANENI M V, SCHNEIDER-BROUSSARD R, MOORE J R, et al. Transgenic expression of 15-lipoxygenase 2 (15-LOX2) in mouse prostate leads to hyperplasia and cell senescence [J]. Oncogene, 2010, 29(30): 4261-75.
[18] MAGNUSSON L U, LUNDQVIST A, ASP J, et al. High expression of arachidonate 15-lipoxygenase and proinflammatory markers in human ischemic heart tissue [J]. Biochem Biophys Res Commun, 2012, 424(2): 327-30.

查看更多

查看更多

查看更多

联系我们

返回顶部