查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
重度抑郁症是全球最严重的心理障碍之一,其终生患病率为10.6%。压力是抑郁的重要风险因素,在日常生活中普遍存在,短期的适度压力对生存有益,而长期的压力暴露会扰乱情绪稳态并导致抑郁。大脑如何动态应对压力仍然是一个谜团,因此理解特定神经回路中压力下细胞的动力学机制对于开发更有效的抗抑郁治疗方案至关重要。

2025年4月9日,来自浙江大学医学院崔一卉和张翔南课题组在Nature(IF=50.5)上发表了题为“Stress dynamically modulates neuronal autophagy to gate depression onset”的文章,该研究揭示了应激动态调节神经元自噬对抑郁症发病的关键影响及其机制。急性应激激活抑郁核心脑区外侧缰核(LHb)的自噬,慢性应激则抑制自噬,慢性应激下受损的LHb自噬导致谷氨酸受体在突触后过度积累,神经元过度活跃,引发抑郁样行为。增强LHb自噬可通过降解谷氨酸受体,调节神经元兴奋性、突触传递和可塑性,发挥快速且持续的抗抑郁作用,且是不同抗抑郁药物发挥作用的共同机制靶点。这一发现为抑郁症的治疗提供了新的潜在策略和靶点。值得注意的是,在本研究中,作者使用了汉恒生物提供的AAV2/9-hSyn-shRNA-Atg5-ZsGreen腺相关病毒成功实现了小鼠脑神经元Atg5基因的敲低,还使用了AAV2/9-CMV-mCherry-EGFP-LC3腺相关病毒成功观察了LHb区域的自噬通量。

首先,作者为了探究应激对LHb自噬的影响,明确其在抑郁症发生中的作用机制。在完成强迫游泳实验(FST)后,比较了对照组与慢性应激(CRS)模型组小鼠的转录组特征。在CRS小鼠多个脑区中,LHb显示出最显著的自噬相关信号通路(尤其是巨自噬通路)富集。CRS小鼠LHb中自噬相关基因表达下调,如Becn1、Atg10等基因的mRNA表达显著降低,同时自噬相关蛋白p62水平升高,Beclin-1水平降低。随后,作者又设计了一次应激实验,主要通过单次或者长期的束缚应激(物理性)、社交挫败(心理社会性)和足底电击(伤害性),来评估急性应激小鼠模型和慢性应激小鼠模型中自噬受损。与转录组数据一致,各慢性应激模型均导致缰核自噬功能受损,蛋白水平检测显示自噬相关指标显著降低。在急性应激组,小鼠LHb自噬相关蛋白呈现相反变化,p62水平降低,Beclin-1水平升高。对自噬通量的检测发现,急性应激增强了自噬通量,表现为LC3 puncta荧光增强、自噬体数量增加;慢性应激则减弱了自噬通量,LC3 puncta荧光减少、自噬体数量下降。以上结果表明,急性应激激活LHb自噬,慢性应激抑制自噬,且自噬功能的变化与小鼠抑郁样行为相关,说明LHb自噬可能在抑郁症发生中起重要作用。
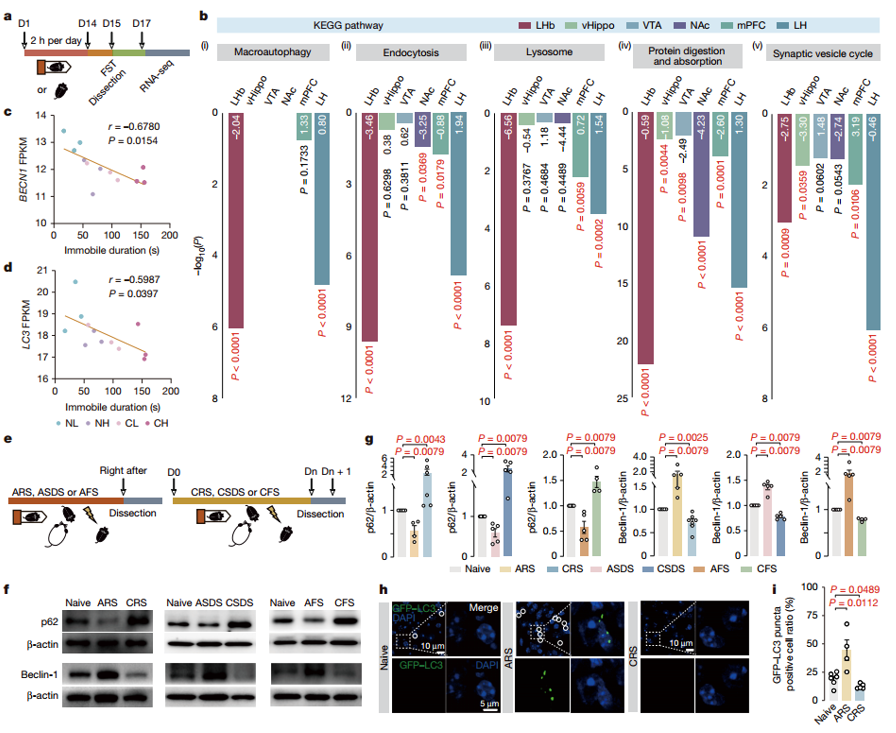
图1.急性应激激活LHb自噬,而慢性应激抑制LHb自噬
mTOR抑制和AMP活化蛋白激酶(AMPK)激活是自噬的两大经典诱导途径,作者检测了急/慢性应激下缰核(LHb)中AMPK与mTOR磷酸化水平的变化。研究发现,急性应激激活AMPK,使p-AMPK 水平升高,而对p-mTOR 和下游p-S6K水平无影响;慢性应激则激活mTOR,导致p-mTOR和p-S6K 水平升高,不影响p-AMPK。为了确定急性应激期间自噬启动是否需要AMPK,作者在ARS之前将AMPK-ULK1(Unc51样自噬激活激酶1)磷酸化的选择性抑制剂SBI-0206965(SBI)局部注入LHb,结果表明急性应激诱导的自噬被抑制,p62水平升高,Beclin-1和p-AMPK水平降低。同时,SBI处理还影响了突触可塑性,急性应激后突触增强的逆转被阻断,小鼠在蔗糖偏好测试中表现出类似快感缺失的表型。这说明AMPK和mTOR信号通路在调节LHb自噬中发挥独立且相反的作用,急性应激通过激活 AMPK 启动自噬,慢性应激通过激活 mTOR 终止自噬,AMPK信号通路对急性应激诱导的自噬及相关行为至关重要。
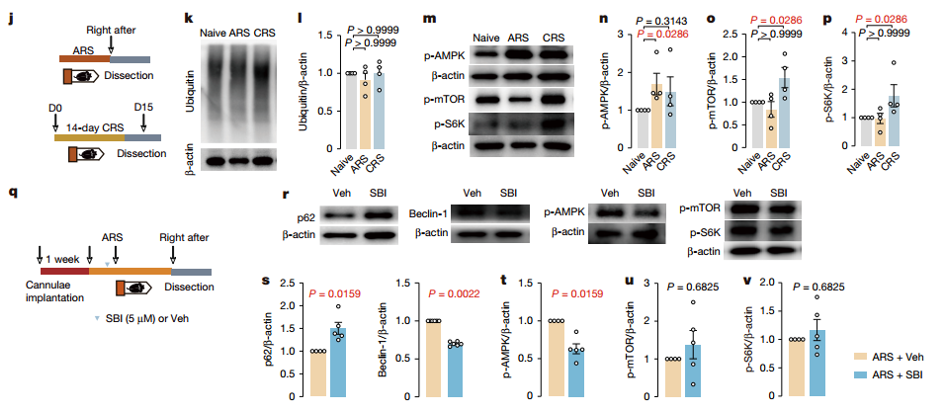
图2. 应激对LHb自噬调节的信号通路
基于慢性应激后mTOR信号通路激活的发现,作者通过给CRS小鼠注射mTOR抑制剂雷帕霉素来验证mTOR抑制的抗抑郁效应。发现雷帕霉素缓解了抑郁样行为,在强迫游泳测试(FST)和蔗糖偏好测试(SPT)中表现改善,且雷帕霉素增强了LHb的自噬。为了评估雷帕霉素的抗抑郁样作用是否需要LHb自噬的参与,作者通过AAV2/9-hSyn-shRNA-Atg5-ZsGreen敲低Atg7,阻断LHb自噬后,雷帕霉素的抗抑郁效果消失。这些结果揭示了LHb自噬在雷帕霉素抗抑郁作用中的必要作用。为了进一步探讨不同抗抑郁药是否需要激活LHb自噬的参与,作者测试了帕罗西汀和氯胺酮在LHb自噬缺陷小鼠中的抗抑郁样作用,结果发现帕罗西汀和氯胺酮治疗的抗抑郁样作用在Atg7条件性敲除的小鼠中部分丧失。
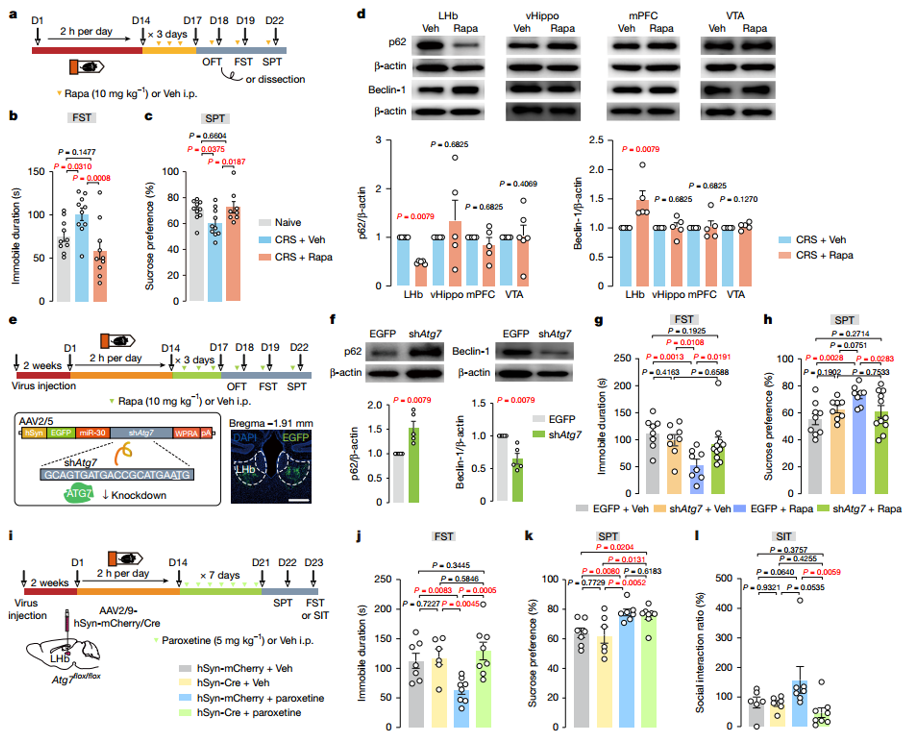
图3. 不同抗抑郁药的作用通常需要LHb自噬作用来参与
由于雷帕霉素、帕罗西汀和氯胺酮都参与了自噬以外的其他生物过程,作者进一步评估了LHb自噬的特异性激活是否直接调节了抑郁样行为,向小鼠LHb中注入Beclin-1的选择性激动剂TAT-Beclin-1肽(tBP),结果发现能快速逆转CRS或慢性社会挫败应激(CSDS)诱导的抑郁样行为,且这种效果至少持续7天。同时,tBP处理还能降低LHb神经元的兴奋性,减少神经元的爆发式放电和整体自发活动。以上结果表明,LHb自噬是不同抗抑郁药物发挥抗抑郁作用的通路,增强LHb自噬能产生快速且持续的抗抑郁效果。
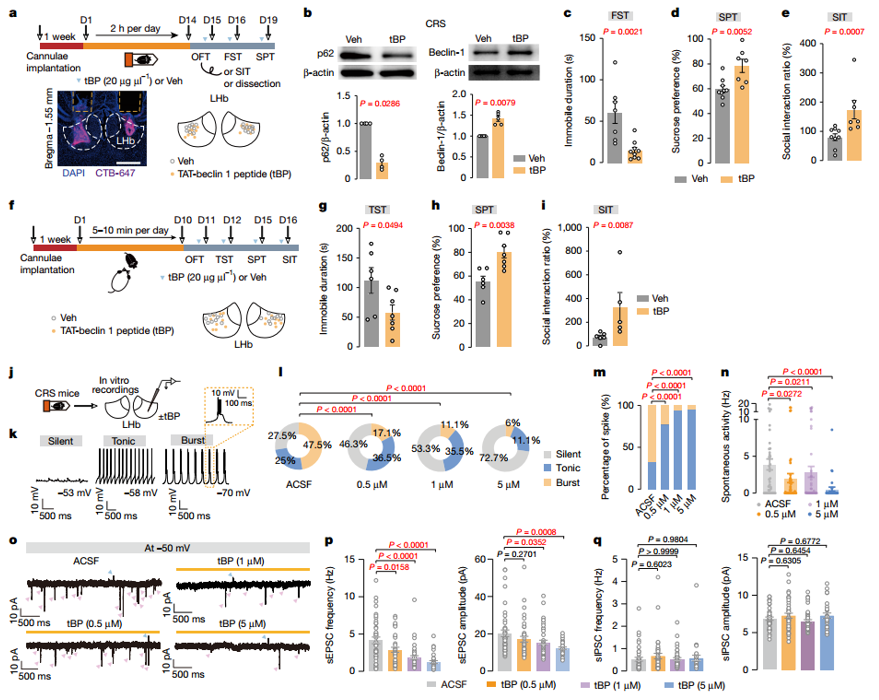
图4. 增强LHb自噬通过使慢性应激小鼠的神经元过度活跃状态和突触缺陷正常化,迅速发挥抗抑郁样作用
接下来,作者确定了LHb自噬的主要作用靶点,解释其抗抑郁作用的分子机制。作者观察到CRS小鼠LHb膜组分中谷氨酸受体(GluRs)GluA1、GluA2和GluN1亚基的蛋白质水平增加,相反,在LHb中局部输注tBP会迅速逆转GluRs的膜蛋白水平,表明增强LHb自噬足以按需促进过量GluRs的降解。为了进一步测量tBP在LHb神经元和突触活动中的作用开始时间,将tBP直接灌注到CRS小鼠的LHb切片上,发现tBP立即(在几秒钟内)消除了爆发和紧张性放电活动,降低了神经元的兴奋性,并以剂量依赖的方式减弱了LHb神经元的兴奋而非抑制性神经传递。这种即时沉默效应表明,tBP通过直接使LHb神经元和突触多动正常化来发挥快速的抗抑郁样作用。tBP与Dyngo-4a(一种内吞作用阻断剂)的联合灌注完全消除了这种瞬时沉默效应,表明内吞作用在LHb自噬介导的GluRs快速降解中起着必要的作用。在行为水平上,联合输注Dyngo-4a或TAT-GluA23Y(一种靶向GluA2亚基内吞作用的特异性阻断剂)则完全消除了tBP的抗抑郁样作用。总的来说,这些发现表明GluRs是自噬介导的降解的主要靶点,可以逆转LHb过度活跃和抑郁样行为。
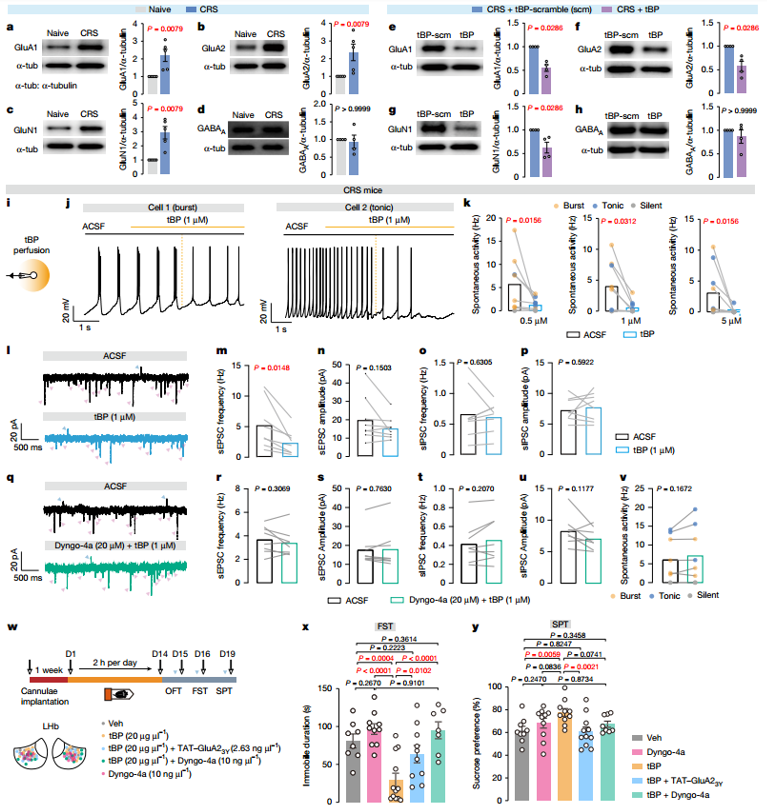
图5. 增强LHb自噬促进突触GluRs降解,使神经元过度活跃状态和抑郁样行为正常化
最后,为了剖析由LHb神经元自噬受损所诱导的类似抑郁行为的神经元基础,作者监测了Atg7基因LHb神经元缺失小鼠(Atg7 LHb−/−)的自噬缺陷型LHb神经元对应激源的钙反应。与对照组相比,Atg7 LHb−/−小鼠的神经元对多种应激源(束缚、足底电击和社交挫败)表现出两倍大的钙反应,这表明在体内Atg7 LHb−/−小鼠的神经元对应激的编码效率有所提高。为了解构自噬受损对LHb神经元的影响,作者检测了Atg7或 Atg5基因敲除的LHb神经元的放电活动和神经传递情况。Atg7或Atg5基因缺陷的LHb神经元表现出过度活跃,具体表现为爆发性活动增强、兴奋性神经传递增加以及抑制性神经传递减少。还观察到,在Atg7 LHb−/−小鼠的外侧缰核细胞膜组分中,谷氨酸受体(GluR)的 GluA1、GluA2 和 GluN1 亚基的蛋白质水平升高,这表明自噬在降解突触部位的谷氨酸受体方面起着固有作用,从而维持LHb中的神经元稳态。接着作者通过化学遗传的方法抑制了自噬缺陷的LHb神经元活动,成功缓解了Atg7 LHb−/−小鼠的抑郁样行为,证实可以通过使LHb的过度活跃恢复正常来逆转Atg7 LHb−/−小鼠的这些类似抑郁的表型。这些结果表明,外侧缰核(LHb)的过度活跃是外侧缰核自噬受损所引发的类似抑郁状态的细胞基础。
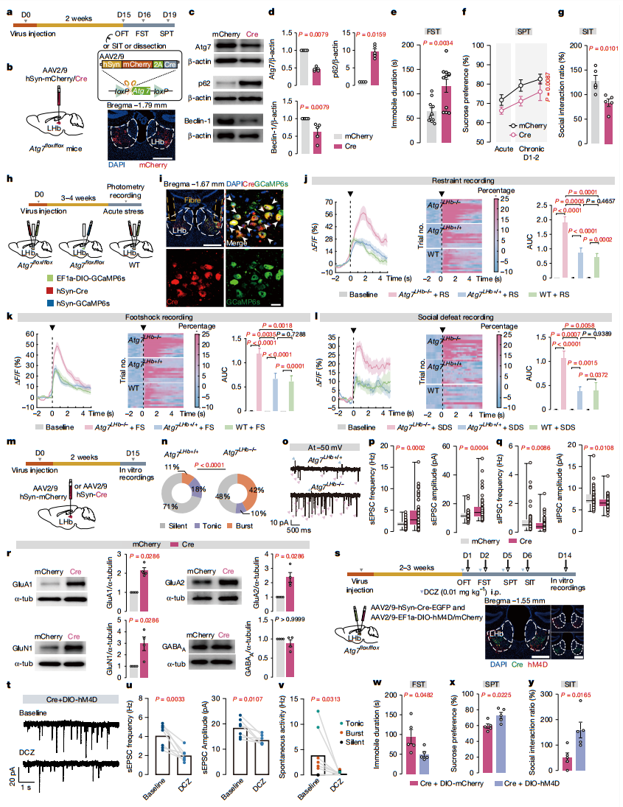
图6. LHb神经元自噬的基因敲除会直接引发类似抑郁的表型以及神经元的过度活跃
总结
综上所述,该研究发现应激通过动态调控神经元自噬影响抑郁发生,揭示了慢性与急性应激的差异化作用通路与机制。慢性应激通过激活下丘脑室旁核(PVN)CRH神经元中的mTOR通路抑制自噬,导致神经元过度兴奋和抑郁样行为;而急性应激则通过AMPK磷酸化启动自噬短暂增强自噬发挥保护作用。从作用机制看,LHb自噬主要降解突触后谷氨酸受体,借此控制神经元兴奋性、突触传递和可塑性。此外,LHb自噬是不同抗抑郁药物发挥作用的共同靶点,多种抗抑郁药或通过抑制Akt-mTOR信号通路激活LHb自噬。这些研究揭示了自噬在抑郁发病中的“闸门”作用(gate depression onset),为理解抑郁症的神经生物学机制提供了新视角,并提示调控自噬通路可能成为抗抑郁治疗的潜在策略。这些发现不仅深化了对压力相关精神疾病的认识,也为开发靶向自噬的新型干预手段奠定了理论基础。

查看更多

查看更多

查看更多

联系我们

返回顶部