查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
肿瘤诱导的免疫抑制是癌症逃避免疫监视和免疫攻击的主要原因。目前,免疫检查点疗法(ICT)在一些癌症的临床治疗中有很好的效果,其通过靶向细胞毒性T淋巴细胞相关抗原4(CTLA-4)和程序性细胞死亡蛋白1(PD-1)来逆转T细胞的免疫抑制。但是仍有大约70%的癌症患者对ICT不敏感,因此,寻找有效的ICT靶点是非常必要的。最新的研究表明,中枢神经系统可以调节癌症的发展和免疫系统的活动,其中主要途径是通过神经内分泌系统。垂体是神经内分泌系统的“指挥中心”,其一些下游激素或效应物在癌症患者中升高,提示神经内分泌系统和垂体单位可能参与调控肿瘤免疫,然而其中的机制仍不清楚。
2022年8月4日,中国科学技术大学周荣斌教授作为第一通讯作者在《Science》(IF=63.714)上发表了题为《Pituitary hormone α-MSH promotes tumor-induced myelopoiesis and immunosuppression》的研究论文,深入探究了神经内分泌系统促进肿瘤相关的骨髓生成和免疫抑制及其机制。研究发现阿黑皮素原(POMC)经切割会产生α促黑激素(α-MSH),α-MSH则通过相应的受体MC1R—MC5R发挥生物学功能。研究结果发现,MC5R与α-MSH促进肿瘤发展密切相关,并提示MC5R是癌症免疫治疗非常有前景的一个靶点。值得注意的是,汉恒生物提供的腺相关病毒HBAAV2/9-Hspa9 shPOMC-GFP成功敲低了小鼠垂体中的POMC,为作者阐明相关机制提供了有力的病毒载体工具。
下面我们一起来看看作者是如何探索其中的机制:
作者首先研究了垂体单位在肿瘤免疫中的作用。为此构建了皮下移植瘤小鼠模型并检测了垂体激素的水平变化,皮下移植的细胞系包括免疫检查点疗法耐药的细胞系(LLC肺癌细胞和GMCSF过表达的B16F10黑色素瘤细胞)和免疫检查点疗法敏感的细胞系(MC38结肠癌细胞系和MCA205纤维肉瘤细胞)。结果发现,荷瘤小鼠模型血清中α促黑激素(α-MSH)的产生明显增加(图1 A,B)。阿黑皮素原(POMC)经加工可产生α-MSH,且正常情况下POMC主要在垂体中表达(图1 C)。相比于对照组小鼠,荷瘤小鼠的垂体中叶中POMC表达增加(图1 D,F)。同时发现,荷瘤小鼠的下丘脑室旁核神经元激活(图1 F,G),而下丘脑可以调控垂体产生α-MSH。此外,作者用HBAAV2/9-Hspa9 shPOMC-GFP敲低了小鼠脑下垂体POMC的表达,显著降低了荷瘤小鼠血清中α-MSH的水平(图1 H, I)。这些结果表明荷瘤小鼠可以激活下丘脑并促进垂体产生α-MSH。
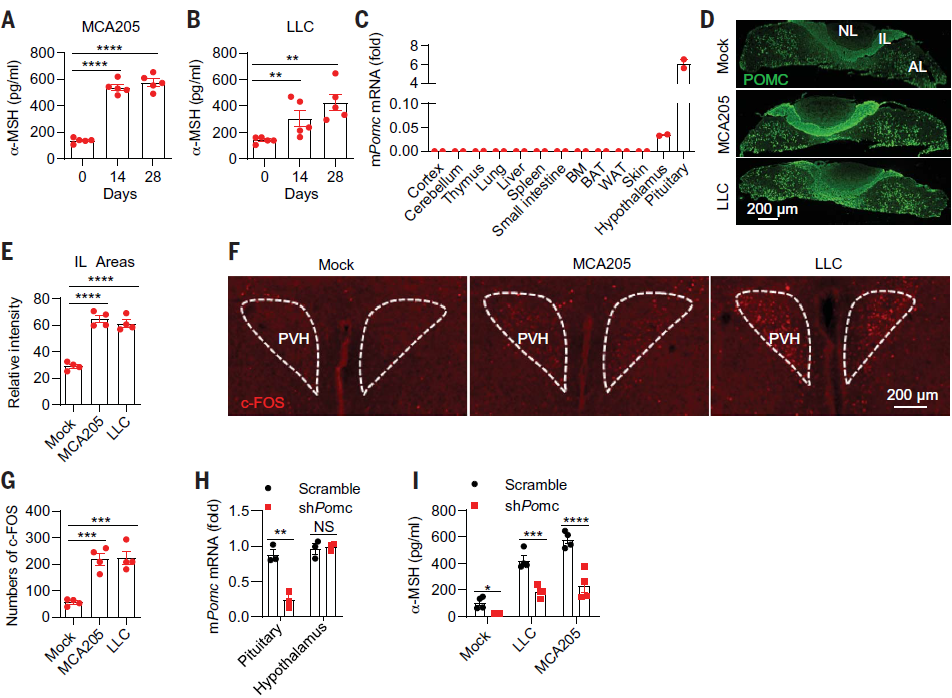
图1. 荷瘤小鼠促进下丘脑的激活和垂体源性α-MSH的产生
接着,作者探讨了垂体来源的α-MSH在肿瘤生长中的作用。研究发现,抑制垂体中POMC的表达对荷瘤小鼠没有明显的毒性,并且抑制了LLC肿瘤的生长,同时增强了肿瘤中CD8+T、CD4+T、NK和NKT细胞的浸润,IFN-γ也在这些免疫细胞中表达上调(图2 A-D)。然而,补充α-MSH逆转了POMC的表达抑制对肿瘤生长和抗肿瘤免疫的影响。采用抗CD4和抗CD8抗体处理小鼠,耗尽肿瘤中CD4+和CD8+T细胞,结果发现也消除了敲低POMC对肿瘤生长抑制的作用(图2 E)。结果说明,抑制垂体中POMC的表达可通过增强抗肿瘤免疫来抑制肿瘤生长。
为了研究抑制POMC后如何增强抗肿瘤免疫,作者分析了LLC肿瘤中的肿瘤相关髓样细胞(TAMCs)的情况。结果发现,抑制POMC显著减少了肿瘤相关巨噬细胞(TAMs)、多核型骨髓源性抑制细胞(PMN-MDSCs)、单核MDSCs(M-MDSCs)和树突状细胞(DC)的聚集(图2 F)。同样,外源性补充α-MSH抵抗了POMC抑制所导致的荷瘤小鼠中TAMCs的扩增和骨髓生成受损(图2 F,G)。上述结果表明,垂体产生的α-MSH可促进肿瘤诱导的骨髓生成。作者还进一步研究了TAMCs是否有助于POMC抑制诱导的肿瘤生长抑制。结果发现,在LLC肿瘤中耗尽MDSCs可延缓肿瘤的生长,而与耗尽TAMs无关,说明MDSCs是LLC肿瘤的主要TAMCs(图2 H)。此外,耗尽MDSCs的情况下,下调POMC并不能联合增强肿瘤抑制和抗肿瘤免疫。在MC38肿瘤中,TAMs和MDSCs均能导致免疫抑制,当二者被耗尽时,也不能增强POMC下调所导致的MC38肿瘤生长抑制和抗肿瘤免疫(图2 I)。以上结果表明,垂体来源的α-MSH可能通过骨髓生成来抑制抗肿瘤免疫。
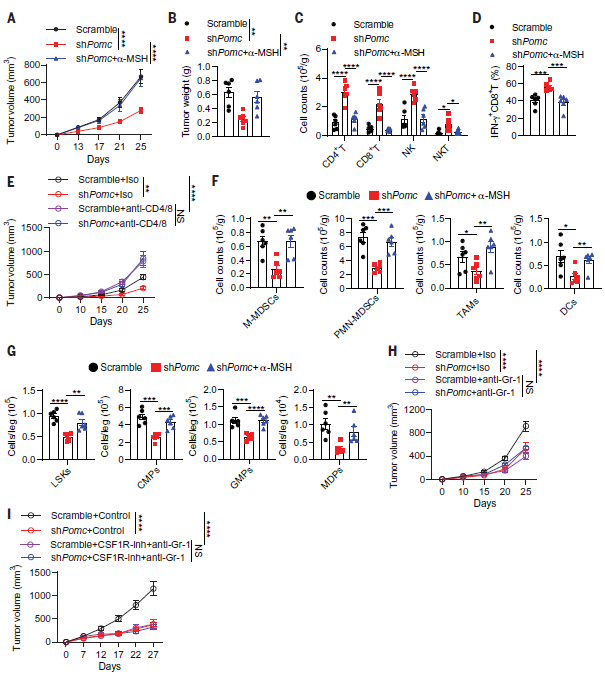
图2. α-MSH在肿瘤诱导的骨髓生成和免疫抑制中的作用
紧接着,作者探究了α-MSH促进骨髓生成的机制。通过检测介导α-MSH发挥功能的MC1R至MC5R,发现只有MC5R在Lin-BM骨髓细胞中高表达,尤其是小鼠骨髓造血干细胞(Lin− cKit+ Sca1+ (LSK)细胞)(图3 A,B)。因此,认为MC5R与α-MSH促骨髓生成密切相关。为进一步验证这一结果,建立了MC5R-/-小鼠模型。结果显示,MC5R-/-小鼠中,移植LLC诱导LSK细胞增殖和髓系祖细胞CMPS、GMPs的扩增被抑制,TAMCs的聚集减少(图3 C,D)。可见MC5R在肿瘤诱导的骨髓生成中是必需的。与对照组小鼠相比,MC5R-/-小鼠的LLC、MCA205、MC38或B16F10-GMCSF肿瘤的生长显著减少,并增强了抗肿瘤免疫(图3 E-I)。MC5Rfl/flVavcre小鼠的实验结果与MC5R-/-小鼠模型相似(图3 J)。此外,作者还发现当耗尽T细胞或骨髓间充质干细胞,可逆转MC5R-/-小鼠对肿瘤的抑制(图3 K,L)。综上所述,α-MSH通过MC5R促进肿瘤诱导的骨髓生成和免疫抑制。
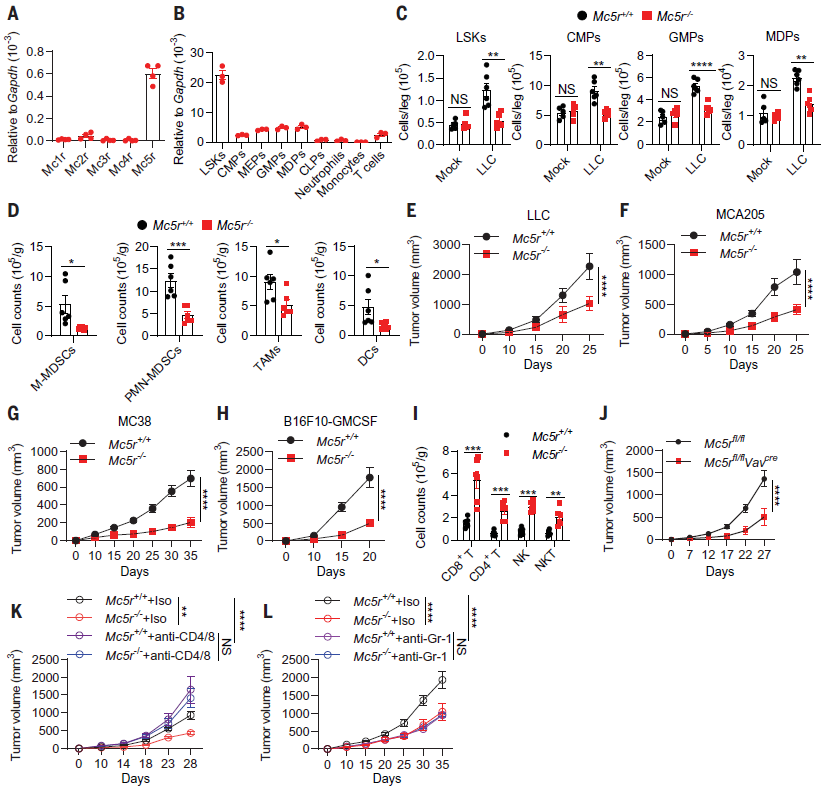
图3. MC5R在肿瘤诱导的骨髓生成和免疫抑制中的作用
以上研究结果提示MC5R或许是治疗癌症的潜在靶点,为了探讨这一可能性,作者用MC5R特异性拮抗剂处理荷瘤小鼠。结果显示,MC5R拮抗剂延缓了MCA205肿瘤、LLC或B16F10-GMCSF肿瘤的生长(图4 A-C),增强了抗肿瘤免疫,并抑制了LLC荷瘤小鼠的骨髓生成(图4 D-G)。因此,这些结果表明,拮抗MC5R可以增强抗肿瘤免疫功能,具有潜在的抗肿瘤作用,即使在抗PD-1耐药的肿瘤中也是如此。
髓系细胞在限制ICT的疗效中起主要作用。因此作者进一步研究了抑制MC5R依赖的骨髓生成是否提高了ICT的效率或克服了ICT的耐药性。结果发现,在MCA205、LLC或B16F10-GMCSF荷瘤小鼠中,联合使用抗PD-1抗体和MC5R特异性拮抗剂对肿瘤的抑制作用要比二者单独使用要强得多(图4 H-J)。另外,当耗尽MDSCs时,联合使用抗PD-1抗体和MC5R特异性拮抗剂未能抑制LLC肿瘤的生长(图4 J,K)。结果表明,拮抗MC5R为提高ICT的效率或克服ICT耐药性提供了潜在的可能性。
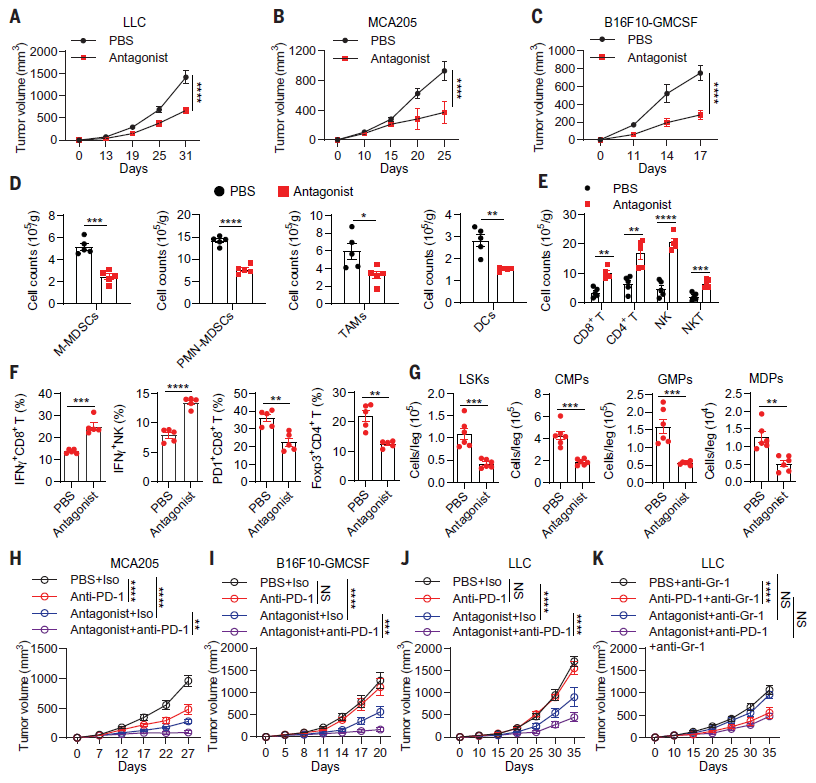 .
.
图4. MC5R拮抗剂的免疫治疗作用
最后,作者探讨了α-MSH-MC5R轴与癌症患者的临床相关性。结果显示,MC5R在人外周血单核细胞(PBMC)的造血干细胞中高表达(图5 A)。非小细胞肺癌(NSCLC)患者血清中α-MSH的水平显著高于健康对照组,并且与PBMC中PMN-MDSCs或M-MDSCs的百分比呈正相关(图5 B-D)。头颈癌(HNC)患者的检测结果与NSCLC患者相似,不同的是,HNC患者中α-MSH水平升高与M-MDSCs无关(图5 E-G)。以上结果表明,癌症患者血清中α-MSH水平增加,并于循环中的MDSCs有关。
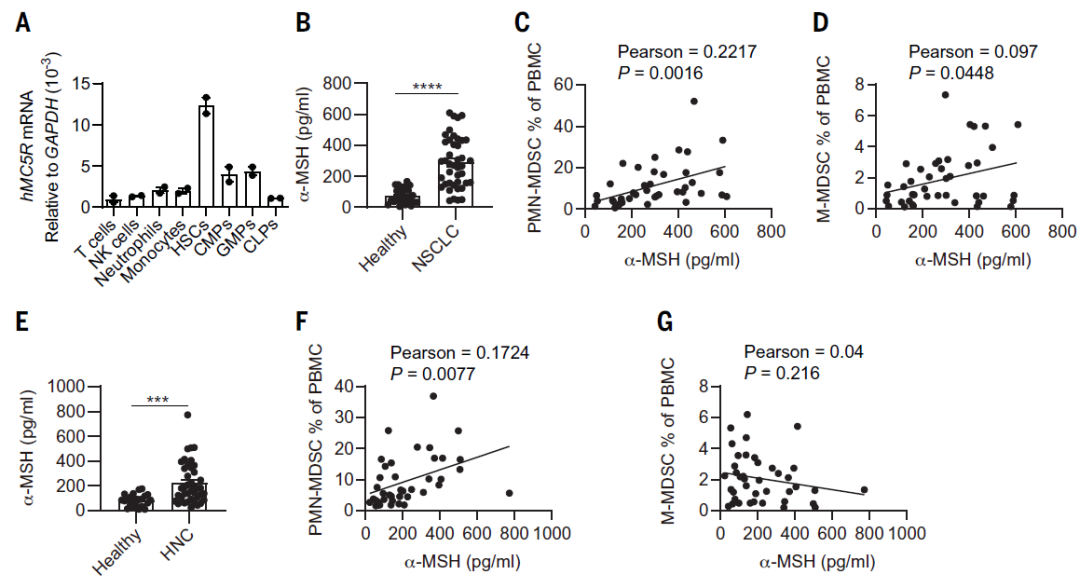
图5. 癌症患者血清α-MSH浓度与外周血MDSCs百分比的相关性
综上所述,荷瘤小鼠可促进下丘脑的激活和垂体源性α-MSH的产生,然后作用于骨髓中的LSK细胞,通过激活MC5R信号促进骨髓生成和TAMC扩增。而MC5R特异性拮抗剂可以逆转肿瘤诱导的免疫抑制,且联合抗PD-1治疗时,可提高ICT的疗效或者抵抗ICT的耐药性。本研究阐明了下丘脑-垂体-骨髓这一神经内分泌途径促进肿瘤诱导的骨髓生成和免疫抑制的机制,并发现MC5R是有效的癌症免疫治疗靶点,尤其是对ICT耐药的癌症。

查看更多

查看更多

查看更多

联系我们

返回顶部