查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
肝脏在全身急性感染期间调节免疫防御过程中起至关重要的作用,在生理条件下,由于其独特的解剖位置,肝脏比体内其他器官更容易接触到内毒素和微生物,因此,肝脏一般处于耐受性免疫状态,以避免过度的免疫激活和自身免疫反应。在出现内毒素血症时,肝脏从耐受状态转变为主动免疫状态,形成抵御微生物入侵的第一道防线,肝脏中的这种免疫状态转变触发了循环中微生物产物的有效清除,然而,强烈的炎症反应将导致肝损伤和免疫抑制,这可能预示着内毒素血症的不良预后,且肝细胞簇和细胞间通讯在内毒素血症进展中的作用也尚未得到很好的证明。
2022年3月8日,中南大学蔡菁菁与福建医科大学陈昭阳作为共同通讯作者在Journal of Hepatology(IF=30.083)发表了题为“Tranional switch of hepatocytes initiates macrophage recruitment and T cell suppression in endotoxemia”的研究论文,该研究确定了一种促炎性肝细胞(PIH)亚群,该亚群主要由门静脉周围的肝细胞发育而来,小部分由中央肝细胞发育而来,并在内毒素血症中发挥关键的免疫调节作用。配体-受体相互作用的多细胞簇模型显示,PIHs通过CCL2-CCR2相互作用在巨噬细胞的募集中起关键作用。招募巨噬细胞(RM)释放细胞因子以诱导抑制性配体在肝细胞上的表达。随后RM刺激的肝细胞通过内毒素血症中的PD-1/PD-L1相互作用导致CD4+和记忆T细胞的抑制。此外,血窦内皮细胞在门静脉周围区域表达较高水平的促凋亡和炎症基因。这种基因表达模式促进了门静脉周围窗孔数量和免疫细胞浸润的增加。总之,该研究阐明了内毒素血症在单细胞水平对肝细胞的细胞和分子效应的影响,并为开发急性感染的新治疗方法提供了思路。值得注意的是,在本研究中,作者使用了汉恒生物提供的AAV2/8-shCCL2成功抑制了肝脏中LPS诱导的CCL2的表达。
接下来让我们看看文章的研究结果:
首先,为了探究内毒素血症中肝脏的细胞构成和异质性,作者对“二次打击”内毒素血症小鼠模型的肝细胞和肝非实质细胞进行单细胞RNA-seq分析,并用LPS诱导小鼠炎症模型,在LPS处理后,取0h,3h,12h这三个时间点的肝脏做了单细胞测序、bulk RNAseq和流式分析,发现内毒素血症诱导细胞亚群发生显著的比例改变,在给予LPS后,髓系的中性粒细胞、巨噬细胞和Kupffer细胞(KCs)出现了明显增加,同时作者也用流式细胞术验证了这一比例变化。
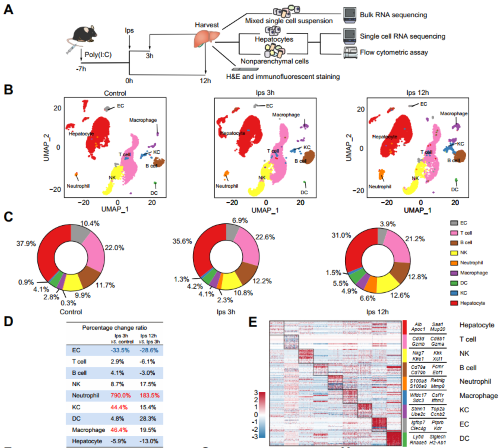
图1.单细胞RNA-seq确定内毒素血症期间肝细胞的组成和变化
作者进一步将肝巨噬细胞进行了亚群细分,得到3个亚群:招募巨噬细胞(RMs)、骨髓(BM)来源的Kupffer细胞(KCs)、卵黄囊(YS)来源的KCs。BM和YS来源的KCs在宿主对细菌的防御反应中起着重要作用,YS来源的KCs专门负责响应干扰素β(INF-β),而BM来源的KCs在细菌感染和肝损伤期间扩大,表现出比YS来源的KCs更强大的细菌病原体摄取和清除能力,且内毒素血症以时间依赖性方式诱导肝脏中RM的显著富集。免疫荧光显示,给予LPS后,富集的RM分布在肝脏的门静脉周围,构建CX3CR1gfp/gfp报告小鼠造模后验证了这一变化。
接着作者对T细胞进行了进一步的分析,T细胞进一步被分为6个群,作者展示了比例变化和它们的marker基因,在给予LPS 3小时后,CD3+T细胞、CD4+CD8+T细胞、CD8+T细胞在早期出现数量增加,12h又出现下降,NK细胞则持续增加,流式细胞术验证了比例变化结果。作者进一步进行T细胞的功能变化研究发现,CD4+T细胞和组织驻留记忆T细胞(TRM)在3h时显著上调,在12h出现下调,作者推断,CD4+T细胞和TRM细胞的抑制是由免疫抑制基因介导的,而且,给了LPS的小鼠和对照相比,CD4+T细胞明显高表达抑制性受体(如PD-1),同时出现功能受损,表现为效应分子IL2,IL4和TNFα表达下调。
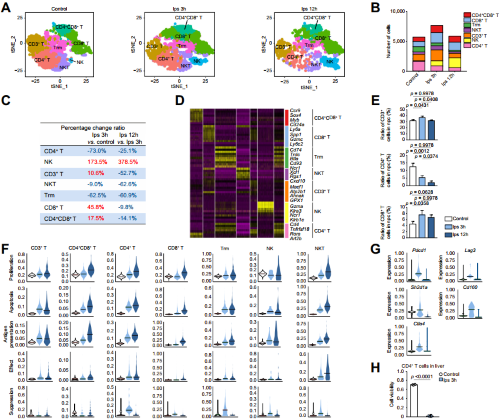
图2.内毒素血症改变T淋巴细胞转录谱并抑制T细胞功能
随后作者探讨了内毒素血症期间的肝细胞异质性和功能变化。作者首先将肝细胞分为了3类:门静脉周的肝细胞(PPHs)、窦状细胞(SHs)、中心周围肝细胞(PCHs),正常情况下,PPHs和PCHs占总肝细胞的75%,但给予LPS后,PPHs和PCHs的比例显著降低,但并未出现凋亡增加,因此作者猜测:PPHs和PCHs逐渐失去了特征基因,丢失了功能,也不再按带状分布。为了验证这一猜测,作者进行了分辨率更高的聚类分析,结果提示肝细胞分为2类:一类主要与代谢相关,一类具有很强的促炎活性,称为促炎性肝细胞(PIHs)。为进一步探究内毒素血症中肝细胞介导的细胞通讯,作者用CellChat做了互作分析,结果显示LPS处理后3h,肝细胞和巨噬细胞的互作评分最高,在PIHs和RMs的互作中,CCL趋化因子通路作用最强,而且CCL家族中,CCL2-CCR2的互作评分最高。差异分析的结果显示CCR2在PIHs中显著上调,而CCR2在RMs中显著上调。这些结果提示:在内毒素血症早期,肝细胞可以转化为PIHs,并通过CCL2-CCR2的相互作用趋化巨噬细胞。值得一提的是,LPS处理后3h肝细胞中Cd274的表达显著上调,其中PIHs表达最高,且与T细胞中Cd279的表达模式一致,这提示内毒素血症中T细胞抑制可能存在新机制。
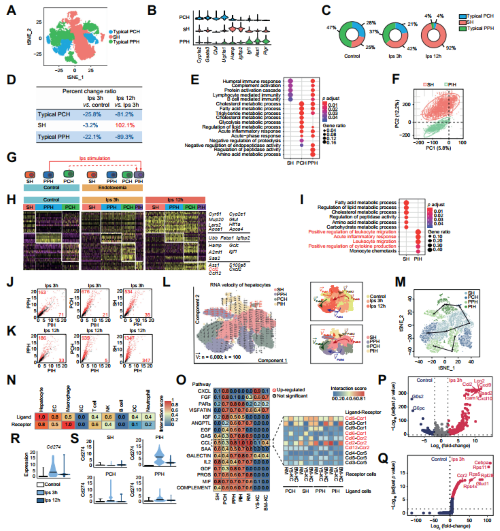
图3.肝细胞在内毒素血症中起着关键的免疫调节作用
为验证肝细胞通过CCL2-CCR2趋化巨噬细胞,作者进一步进行了体外和体内实验。qPCR结果显示:不管是肝脏组织还是原代肝细胞,给予LPS之后,CCL2都有一个时间依赖性的显著增加。然后,作者使用汉恒生物提供的AAV-8-shCCL2抑制了肝脏中LPS诱导的CCL2的表达,发现AAV-8-shCCL2处理后,骨髓巨噬细胞(BMDM)迁移增加,小鼠存活率上升,小鼠外周血促炎因子显著下降且肝细胞损伤减轻,流式、HE染色和Tunel染色同样证实了敲低CCL2减轻了内毒素诱导的干细胞凋亡。总之,体内和体外的证据表明,在内毒素血症期间,肝细胞通过CCL2介导的途径将巨噬细胞募集到肝脏。
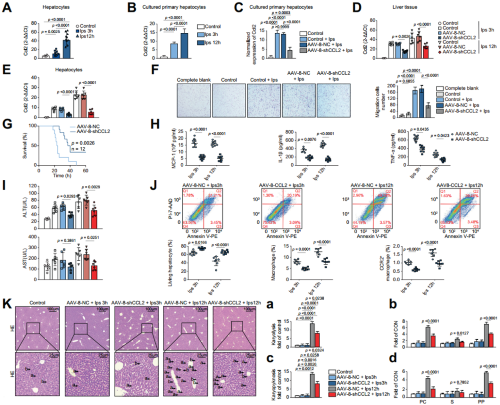
图4.验证肝细胞通过CCL2介导的途径将巨噬细胞募集到肝脏
前面结果提示内毒素血症中T细胞出现了明显的免疫抑制,为了验证肝细胞是否通过PD-1/PD-L1轴诱导T细胞抑制,作者在给予LPS处理的小鼠中使用AAV-8-shPD-L1抑制PD-L1的表达后,肝细胞中Cd274的表达显著受到抑制,并增加了肝细胞中CD4+T和CD8+T细胞的比例,小鼠的死亡率也下降。为了在体外验证RMs通过肝细胞重新编程介导T细胞抑制,作者使用了一种共培养系统,CCK8实验显示:在与LPS处理后的BMDMs的上清和肝细胞共培养时,CD4+T细胞出现明显的活性抑制,而这种抑制效应可以被IL27 p28的中和抗体所阻断。
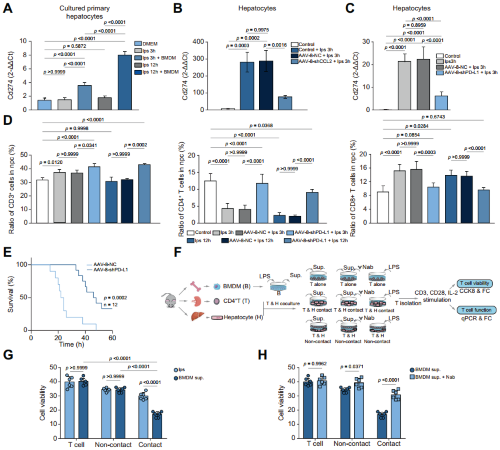
图5.肝细胞中PD-L1的上调诱导内毒素血症期间的T细胞抑制
最后,作者又研究了内毒素血症中肝内皮细胞损伤的分区模式,在对肝窦内皮细胞(LSECs)的研究中发现,内毒素血症中,LSECs减少。GO和GSVA分析探究了LSEC的功能,结果提示大血管周围的LSECs存在逐渐增强的炎症和凋亡反应并抑制了代谢率,此外,和中央静脉区相比,门静脉周围的LSECs展示出更强的炎症和凋亡反应。
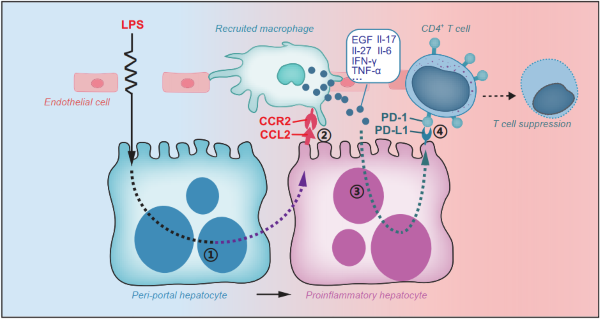
图6.文章模式图
在这项研究中,作者确定了肝脏细胞在3个不同阶段对“二次打击”内毒素血症模型的反应。单细胞转录组分析显示,内毒素血症引起的肝细胞表型转变可募集血液循环中的单核细胞以产生RM群体并抑制T淋巴细胞的作用。此研究从肝脏的角度推进了对内毒素血症病理生理学的理解,为开发有效的急性感染治疗方法提供了关键基础。

查看更多

查看更多

查看更多

联系我们

返回顶部