查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
2022年5月10日,浙江大学邵逸夫医院李恭会教授研究组在国际知名杂志Molecular Cancer(IF=41.444)在线发表题为《N6-methyladenosine-modified TRAF1 promotes sunitinib resistance by regulating apoptosis and angiogenesis in a METTL14-dependent manner in renal cell carcinoma》的重要研究成果。该成果发现了TRAF1在肾癌对舒尼替尼(Sunitinib)耐药性中所起的重要作用,并揭示了METTL14通过m6A修饰调控TRAF1稳定性从而促进耐药性发生的重要机制。作者提出了TRAF1作为治疗靶点的可能性,为未来肾癌研究和治疗提供了重要的基础。在该工作中,为了验证TRAF1在肾癌细胞对舒尼替尼耐药性中的作用,使用了汉恒提供的腺相关病毒(AAV)进行了TRAF1的过表达和敲低。
为了研究肾癌细胞对舒尼替尼产生耐药的机制,作者首先构建了体内和体外的舒尼替尼耐药模型。体内模型构建主要使用异种移植的方法,将舒尼替尼敏感的细胞株78S和OSS注射入小鼠,然后通过让小鼠长期口服舒尼替尼,从而培养出舒尼替尼耐药的异种移植模型。体外细胞系培养也使用类似方法,在细胞培养基中缓慢增加的舒尼替尼浓度,从而筛选出舒尼替尼耐药细胞,最终获得了两组舒尼替尼耐性细胞株78R和OSR。随后作者对所得到的耐药细胞的抗药性进行了确认。在舒尼替尼处理后,耐药细胞株相较于其母细胞表现明显耐药性,表现为舒尼替尼处理后存活细胞更多、增殖更快、凋亡更少,而且血管生成能力更强。体内模型也显示耐药肿瘤对舒尼替尼敏感度下降,肿瘤生长更快,且CD31,KI67,CD105等标记物的水平提高。基于此,作者建立了有效的药物耐药研究模型。
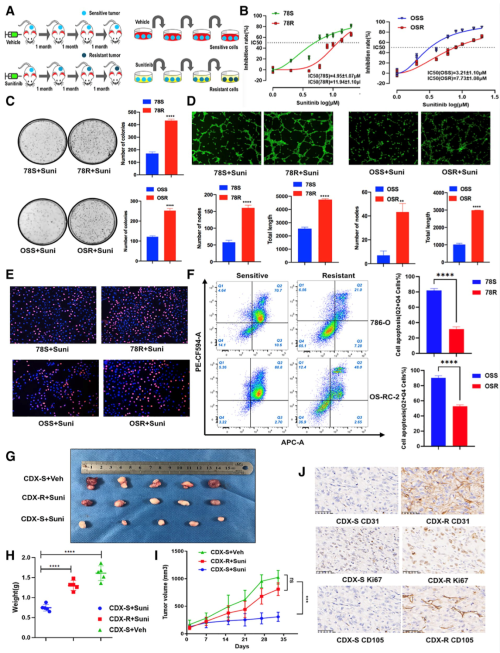
图1 舒尼替尼耐药模型的建立与验证
作者接下来进一步探索了肾癌细胞产生舒尼替尼耐药的机制。作者对舒尼替尼敏感和有耐药性的肿瘤以及细胞株分别做了RNA-seq,并进行了差异表达分析,作者发现TRAF1基因的表达在耐药的细胞和肿瘤中都明显提高,这在蛋白层面也得到了验证。病人肿瘤切片的免疫组化分析也表明TRAF1在耐药病人中存在显著提高。并且作者通过生存分析发现,TRAF1表达高的肾癌病人在接受舒尼替尼治疗后的存活率更低。通过这些证据,作者发现TRAF1的高表达可能和肾癌对舒尼替尼耐药性的形成有关。
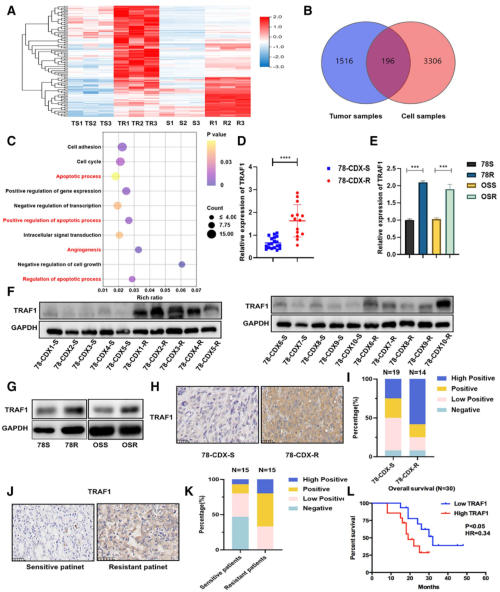
图2. 在耐舒尼替尼 RCC 中,TRAF1 水平升高
为了确定TRAF1是否促进了肾癌细胞对舒尼替尼耐药性的产生,作者通过对TRAF1进行过表达和敲低来观察耐药性的变化。作者在汉恒生物分别定制了TRAF1过表达的载体AAV9-TRAF1和敲低TRAF1的shRNA载体AAV9-shTRAF1,并实现了有效的过表达和敲低。随后作者发现,在舒尼替尼敏感细胞中过表达TRAF1明显提高了细胞耐药性;而在舒尼替尼耐药的细胞中敲低TRAF1,则导致细胞对舒尼替尼的敏感性增加。而且TRAF1过表达会明显降低舒尼替尼处理后的细胞凋亡比例,相反,敲低则明显增加了细胞凋亡。这些证据表明,TRAF1的高表达确实会促进肾癌细胞对舒尼替尼的耐药性。
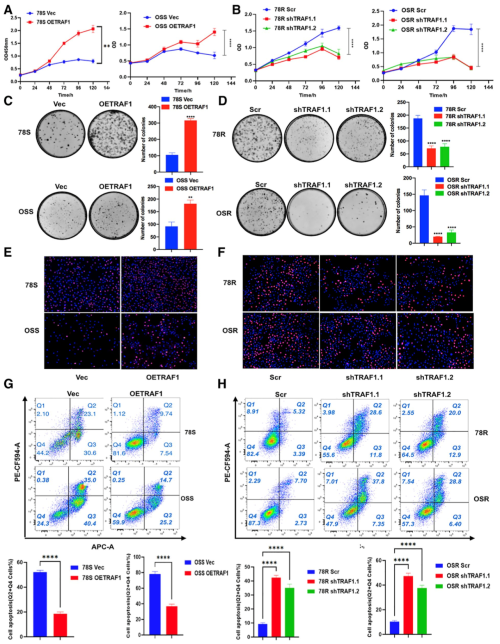
图3. TRAF1 在舒尼替尼耐药性中起关键作用
TRAF1的高表达除了提升肾癌细胞对舒尼替尼的耐药性,作者还发现其会导致肿瘤血管生成能力的增强。而其敲低则会导致血管生成能力的下降。通过对血管生成相关通路的基因的表达分析发现,TRAF1基因的表达和血管生成信号通路AKT/mTOR/HIF1a/VEGFA中的多个基因表达存在正相关。因此,作者认为TRAF1的表达促进了血管生成相关基因的上调,从而促进了血管生成。
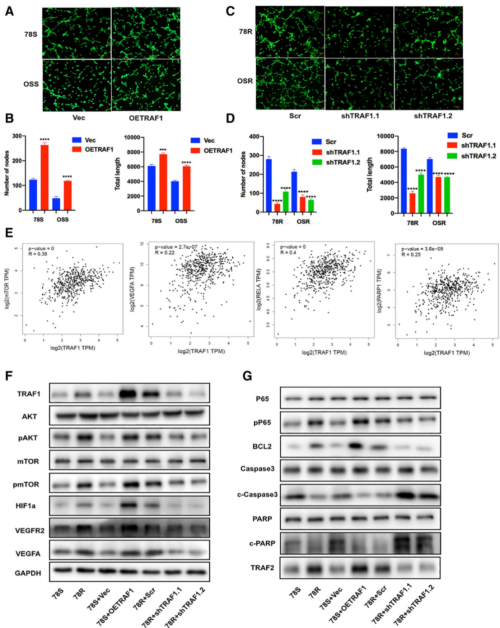
图4. TRAF1 在舒尼替尼耐药性中起关键作用
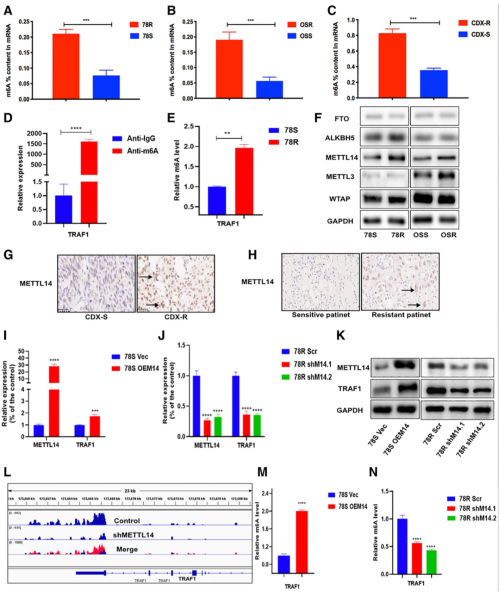
图5. TRAF1 被 m6A RNA 甲基化调节
为了揭示TRAF1表达上调的调控机制,作者对TRAF1的转录水平进行了分析,但并未发现差异。因此作者推测TRAF1基因的高表达可能和RNA的表达调控有关,而m6A被认为参与了RNA的表达调控,作者便检测了舒尼替尼敏感和耐药细胞中的m6A水平。作者发现耐药细胞总体的m6A水平降低,但是TRAF1 RNA的m6A水平明显提高。于是,作者检测了多个与m6A相关的基因的表达水平。作者发现METTL14的表达明显升高了,而且敲低METTL14后,TRAF1的m6A水平下降,过表达则能提高TRAF1的m6A水平。因此,作者认为TRAF1通过METTL14提高其m6A水平,从而提高了TRAF1的表达。
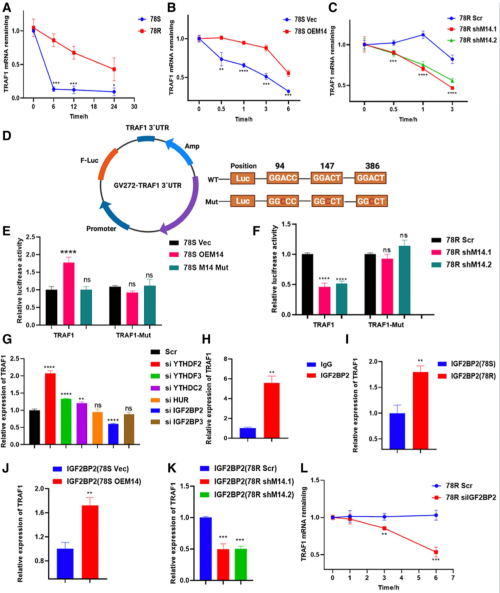
图6. METTL14 调节 TRAF1 mRNA 的稳定性
为了探究m6A如何影响TRAF1的表达,作者分析了TRAF1 mRNA的半衰期,发现在舒尼替尼耐药细胞中,其mRNA的半衰期更长,这意味着m6A促进了TRAF1的稳定性。而且通过荧光素酶分析发现这种稳定性和METTL14调控的m6A的水平有关。进一步筛选还发现,这一稳定性也与IGF2BP2有关。综上,作者发现METTL14通过m6A-IGF2BP2依赖的方式调控了TRAF1 mRNA的稳定性。
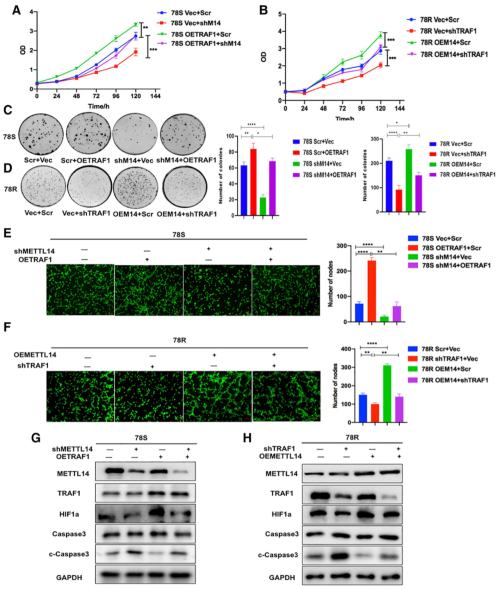
图7. TRAF1 以 METTL14 依赖的方式维持舒尼替尼耐药性
作者进一步探究了TRAF1和METTL14的上下游关系。通过在过表达TRAF1的同时敲低METTL14,作者发现肾癌细胞的耐药性会有所回落,这说明TRAF1的作用是依赖于METTL4的。而单独过表达METTL4并不足以诱导出细胞的耐药性,排除了METTL4在上游单独起作用的可能性。因此,作者认为TRAF1通过METTL14依赖的方式促进舒尼替尼耐药性的发生。
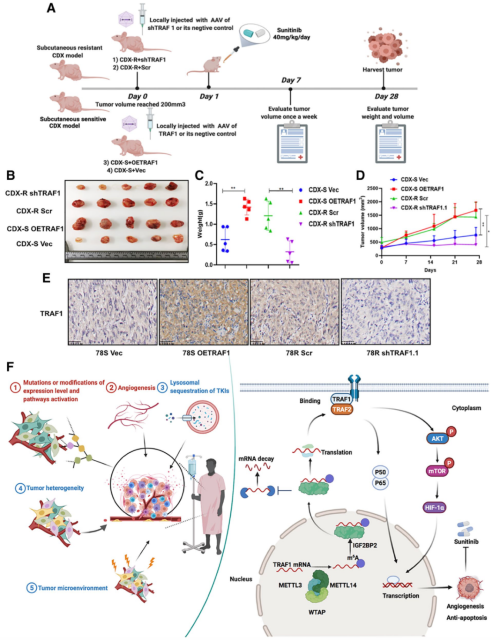
图8. 体内靶向 TRAF1 可减轻RCC对舒尼替尼的耐药性
最后,作者尝试在小鼠体内进行TRAF1的敲低,并联合舒尼替尼用药,这种方式相对于单独使用舒尼替尼,明显减小了肿瘤体积,而过表达TRAF1的同时使用舒尼替尼效果最差。这一实验表明,以TRAF1为联合用药靶点或有利于降低肾癌耐药发生,从而提升治疗效果。

查看更多

查看更多

查看更多

联系我们

返回顶部