查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
运动是公认的预防代谢性疾病的方法,如肥胖症,糖尿病和脂肪肝。然而,过度运动会导致不良的后果,包括身体机能受损,炎症和免疫功能障碍等。在高强度运动期间,骨骼肌中乳酸生成激增,从而诱导蛋白质发生乳酸化修饰,这是一种与脂肪肝、心肌梗死、肝纤维化相关的重要机制,然而它们在过度运动影响的肌肉-肝脏通信中的作用还亟待探索。

2025年,中南大学内分泌研究中心黄燕、彭慧、陆仁斌团队在 Cell 子刊 Cell Metabolism 上发表了题为:Muscle-derived small extracellular vesicles induce liver fibrosis during overtraining 的研究论文。该研究发现,过度运动训练小鼠能发生肝脏纤维化。其潜在机制是肌肉的乳酸堆积会诱导产生一种肌源小细胞外囊泡(SEVs)——乳酸体,其特异性携带FBXO2。肝脏摄取后,FBXO2会启动MCL1的降解,进而导致肝细胞凋亡,引起肝脏的损伤。此外,该研究还发现,红景天苷可减少肌肉乳酸小体的形成,从而减轻过度运动训练引起的肝脏纤维化,说明针对乳酸积累的干预可能是一种缓解过度训练影响的潜在治疗策略。
值得注意的是,在本研究中作者使用了汉恒生物提供的AAV-MHCK7和AAV-TBG腺相关病毒,成功在小鼠的肌肉和肝脏中特异过表达Cre、FBXO2和MCL1等基因。
下面,我们一起来了解具体的研究内容:

研究成果:
过量运动会诱导肝脏纤维化
为了探究过量运动和肝纤维化的关联,作者收集了National Health and Nutrition Examination Survey(NHANES) 2017-2020年身体活动和肝脏表型的1255个样本的数据。分析发现,过度运动的人出现肝功能障碍的风险更高。考虑到NAHNEs的样本数据不是中国人群,研究团队组建了两组志愿者,根据日常运动量将其分为过度锻炼和非过度锻炼组,对肝纤维化相关指标进行跟踪调查。与非过度训练组相比,过度训练组的血清肝纤维化标志物,包括PIIINP、透明质尿酸(HA)、IV型胶原(CIV)和FIB-4显著升高,并且过渡训练组人群肝硬化程度也显著升高。作者又根据不同运动强度将小鼠分为对照组、适度运动组和过度运动组进行观察,相对于过度运动组,对照组和适度运动组中的小鼠没有观察到肝纤维化的相关表型。此外,过度运动组的小鼠除了观察到肝纤维化外,还观察到心脏的轻度纤维化。TUNEL实验表明,过度运动增加了肝细胞的凋亡。QPCR结果显示与纤维化相关的基因(如Tgfb, Col1a1, αSma)、炎症相关的基因(如Cxcl2, Ccl2, Tnfa)在过度运动组的肝脏表达水平都要显著高于对照组和中度运动组。而终止过度运动4周后,小鼠的肝脏纤维化水平有所下降。以上结果表明,长期过度训练可诱导健康小鼠的肝脏发生纤维化和炎症。
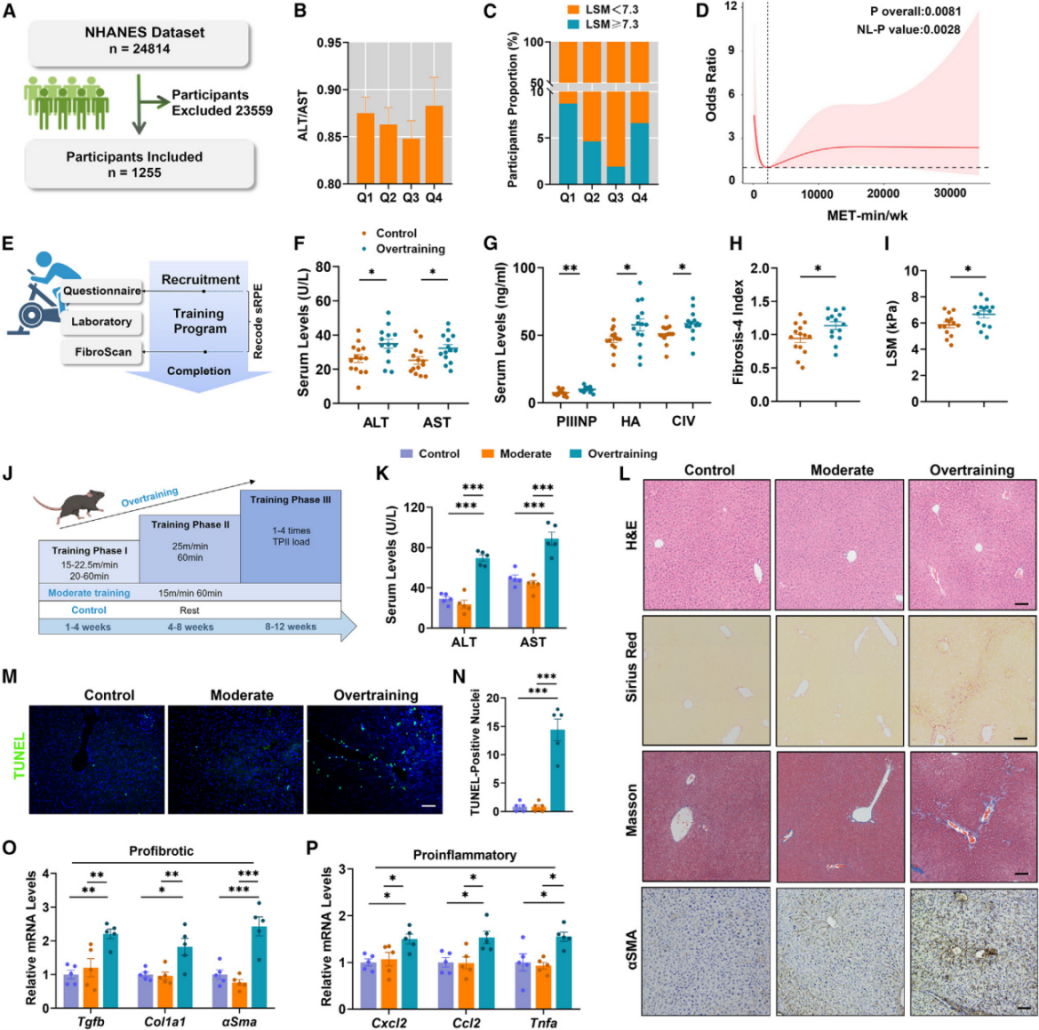
图1. 过度训练促进肝纤维化
乳酸在肌肉中的积累会导致肝脏纤维化
在以往的研究中,过度运动已被证明会引起生理失调,如内分泌失调、免疫功能失调和肌肉损伤。因此作者研究了过度运动是否会产生某些因子,进而导致了机体损伤和肝脏的纤维化。有报道称高强度运动释放的乳酸盐会加剧肝纤维化的进展,因此作者选择了乳酸这种代谢物进行进一步的研究。结果发现,与对照组相比,过度训练组小鼠血清、肌肉、肝脏和肾脏中的乳酸水平明显升高。但是通过腹腔注射高浓度的乳酸并没有诱导出肝脏的纤维化,说明通过循环系统直接上调的乳酸并不是过度运动导致肝脏纤维化的原因。作者通过给小鼠肌肉组织直接注射乳酸模拟运动产生乳酸,与低剂量注射乳酸组的小鼠对比,高剂量注射乳酸12周后,会伴有明显肝损伤、胶原纤维沉积和更大的炎症反应,说明肌肉组织的高水平乳酸堆积可能是导致肝纤维化的主要原因。LDHA是乳酸合成的关键酶,作者通过注射AAV-MHCK7-Cre 到Ldhafl/fl小鼠的肌肉组织中,特异性的敲除小鼠肌肉组织的LDHA基因。相比于野生型的小鼠,LDHA缺失能缓解过度运动导致的肝损伤、胶原积累、肝细胞凋亡、纤维化和炎症。以上结果表明过度运动会因肌肉乳酸堆积导致的肝脏损伤,而不循环系统的乳酸水平上调引起的。
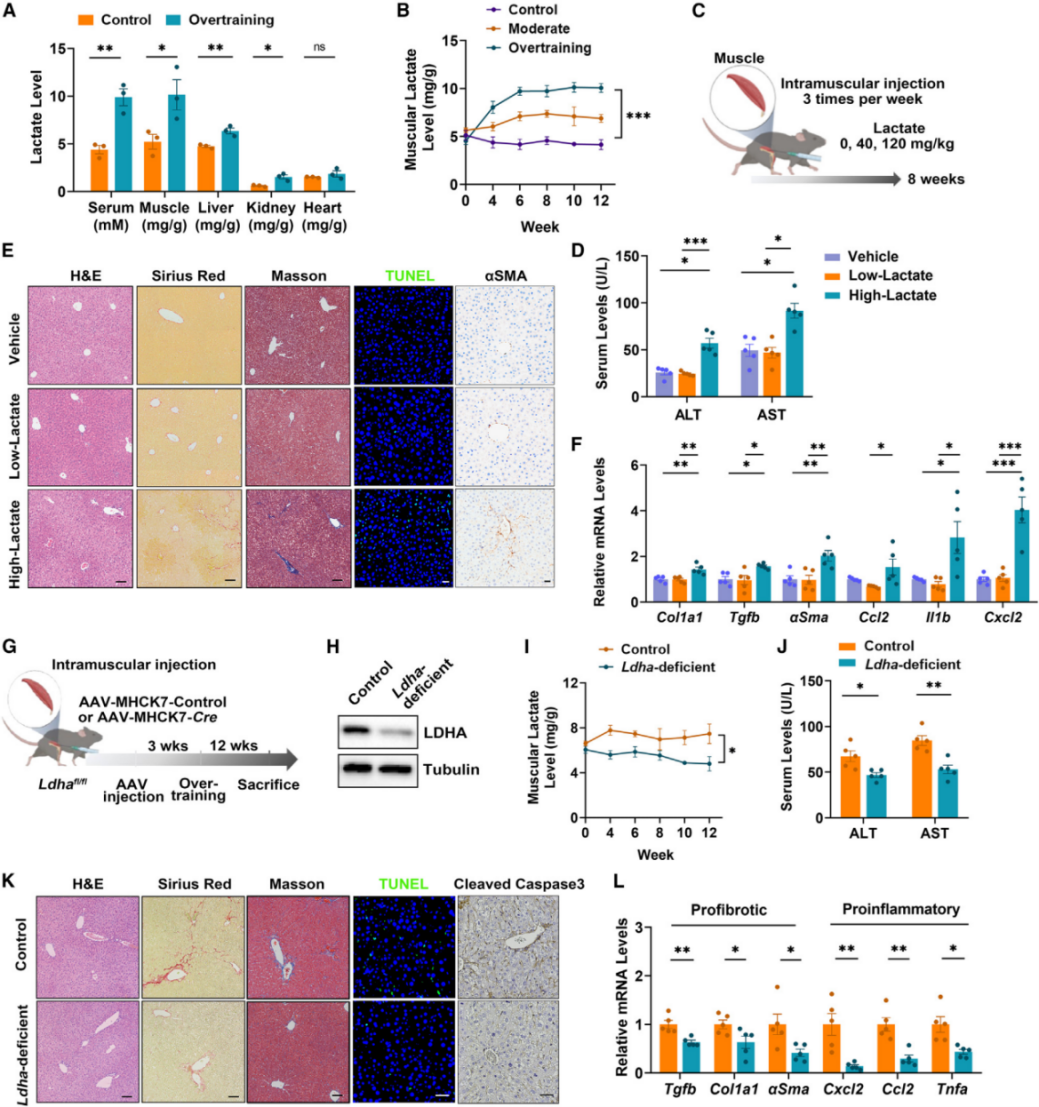
图2. 乳酸在肌肉中的积累会导致肝纤维化
骨骼肌乳酸堆积介导的细胞外囊泡释放导致肝纤维化
已有很多研究证实了骨骼肌作为内分泌器官,在生命活动中扮演了重要的角色,因此,作者猜想乳酸的堆积可能影响了肌肉细胞的内分泌功能。作者在培养肌肉细胞C2C12的培养基中添加乳酸,并收集用于培养肝细胞LX-2,发现这种培养基能诱导肝细胞的凋亡和纤维化相关基因的表达。说明C2C12在乳酸的刺激下可能分泌了一些物质导致肝细胞的凋亡。作者用超速离心分离小鼠骨骼肌的分泌物,获得了可溶性组分(SFs),大分泌囊泡 (LEVs)和小分泌囊泡 (SEVs),分别用这些组分去刺激肝细胞,只有SEVs能诱导细胞的凋亡。为了追踪肌肉分泌的小细胞外囊泡(SEVs),作者构建了绿色荧光标记肌肉来源SEVs的小鼠(Myf5-Cre:Cd63-GFPfl/fl),观察到过度运动后小鼠循环系统中肌肉源的SEVs显著升高。随后使用GW4869抑制SEVs的分泌,发现过量运动的小鼠在注射GW4869后肝脏损伤和纤维化都有所好转。为了进一步证实这种生命现象是乳酸介导的,研究团队收集了野生型和Ldha缺乏的过量运动小鼠的肌肉来源SEVs,并静脉注射到正常饲养的野生型小鼠体内。8周后,注射野生型过量运动小鼠的SEVs可导致肝脏的纤维化,而Ldha缺乏过量运动小鼠来源的SEVs没有诱导肝纤维化的能力。
以上结果表明,过度运动在肌肉中产生的SEVs可导致肝纤维化。
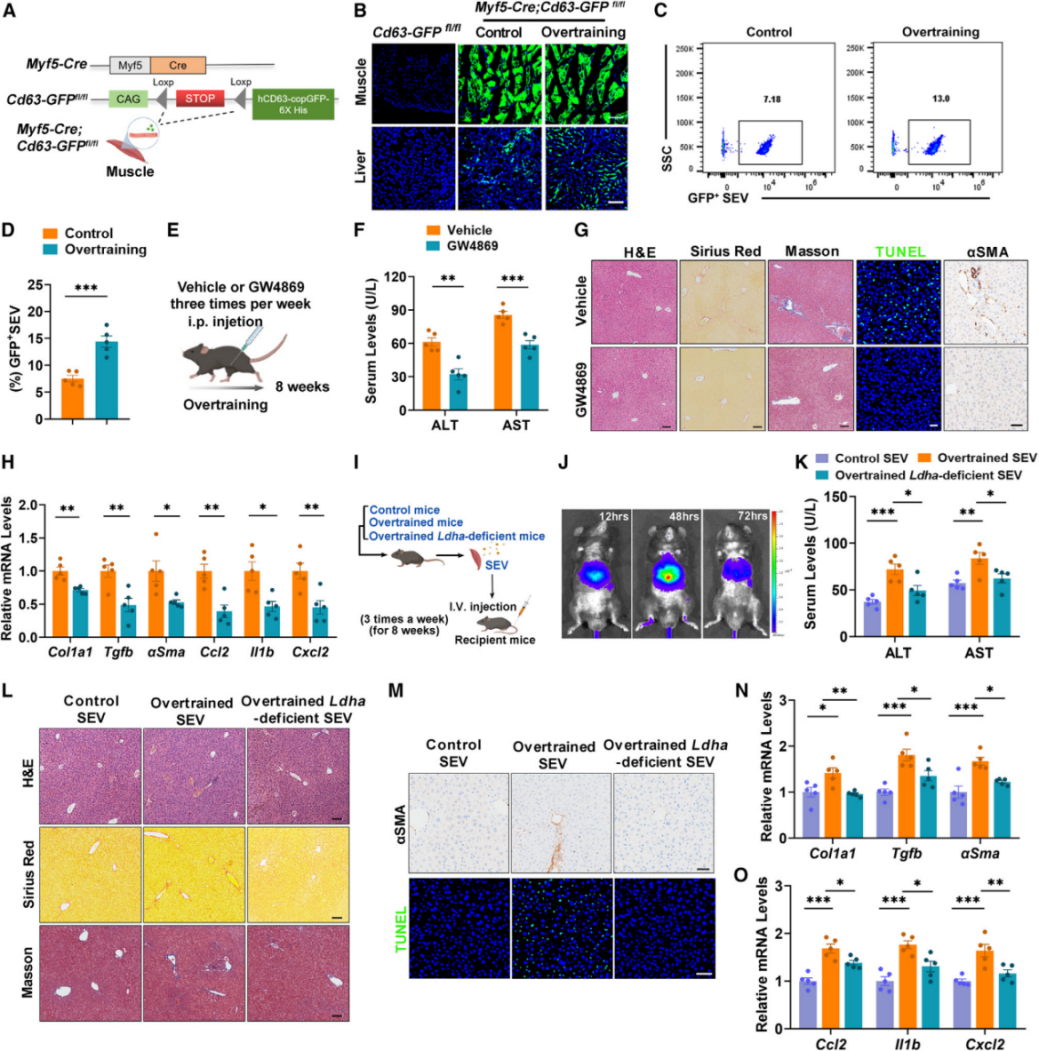
图3. 乳酸促进肌肉源性SEVs向肝脏转移并加剧肝纤维化
SORBS3乳酸化促进SEVs中FBXO2水平的升高
为了阐明上述研究潜在的分子机制,研究团队分离并纯化了乳酸刺激的C2C12细胞的SEVs和未处理C2C12细胞的SEVs,通过蛋白质组学分析发现AKR1B1, FBXO2,STC1和CFB这四个蛋白差异显著。而在动物实验中,过度训练的野生型小鼠骨骼肌来源的SEVs只有FBXO2表达上升。为进一步证实FBXO2是肝脏纤维化的主要因素,作者通过敲低C2C12细胞中FBXO2的表达来降低SEVs中FBXO2的水平,发现敲低后的SEVs诱导肝损伤的作用消失了。
接下来,作者进一步探索了FBXO2被选择性装载到SEVs中的机制。在乳酸刺激的C2C12细胞中,发现SORBS3能与FBXO2发生互作。以往的研究中SORBS3能与参与腔内囊泡形成的膜支架蛋白FLOT1相互作用,并且这种互作在乳酸的刺激下能够增强,说明SORBS3、FBXO2和FLOT1共同参与了腔内囊泡形成。蛋白的乳酸化修饰可以影响的囊泡的蛋白分拣过程,而过量乳酸刺激可提高C2C12细胞中SORBS3的乳酸化水平,因此作者猜想SORBS3可能因为乳酸化的修饰影响了FBXO2的分选过程。人SORBS3蛋白的K415是乳酸化的关键位点,并且该位点在脊椎动物中高度保守的(对应小鼠的SORBS3是K479),实验证实突变这个位点会减弱FBOX2和SORRBS3、FLOT1的互作。作者使用mCherry-Rab5Q79L质粒转染C2C12细胞来标记、可视化内含体(ILVs)。研究发现,乳酸能上调ILVs中FBXO2的水平,下调SORBS3的表达可抑制FBXO2向ILVs中的转运,过表达SORBS3能增强这一过程,而SORBS3K415R的过表达无此效果。以往的研究提示乳酸能引起细胞内液液相分离(LLPS),LLPS也是SEVs分拣包裹物的重要机制之一。作者发现在高乳酸条件下,SORBS3会在细胞内形成聚集体,过表达SORBS3K415R后便没有发生这种现象,作者推测,SORBS3的K479乳酸化会影响其LLPS。对SORBS3的蛋白结构分析发现存在内在无序区域(IDR),IDR-IDR相互作用能驱动的LLPS发生,表现出快速聚合的生物物理特性。光漂白后荧光恢复(FRAP)实验表现出漂白后SORBS3斑点的强度和圆形结构能迅速恢复。融合分析显示SORBS3液滴在活细胞中相互接触后凝聚成单个更大的液滴,表明SORBS3有类似液体的性质。使用己二醇作用C2C12细胞来破坏生物分子凝聚,能观察到FBXO2-FLOT1相互作用减弱,SEVs中的FBXO2水平下降。
综上所述,乳酸诱导SORBS3的乳酸化和SORBS3的LLPS,能调节SEVs的分选,促进形成FBXO2+ SEVs的形成。作者将这种乳酸诱导的、SORBS3参与形成的SEVs命名为乳酸体。
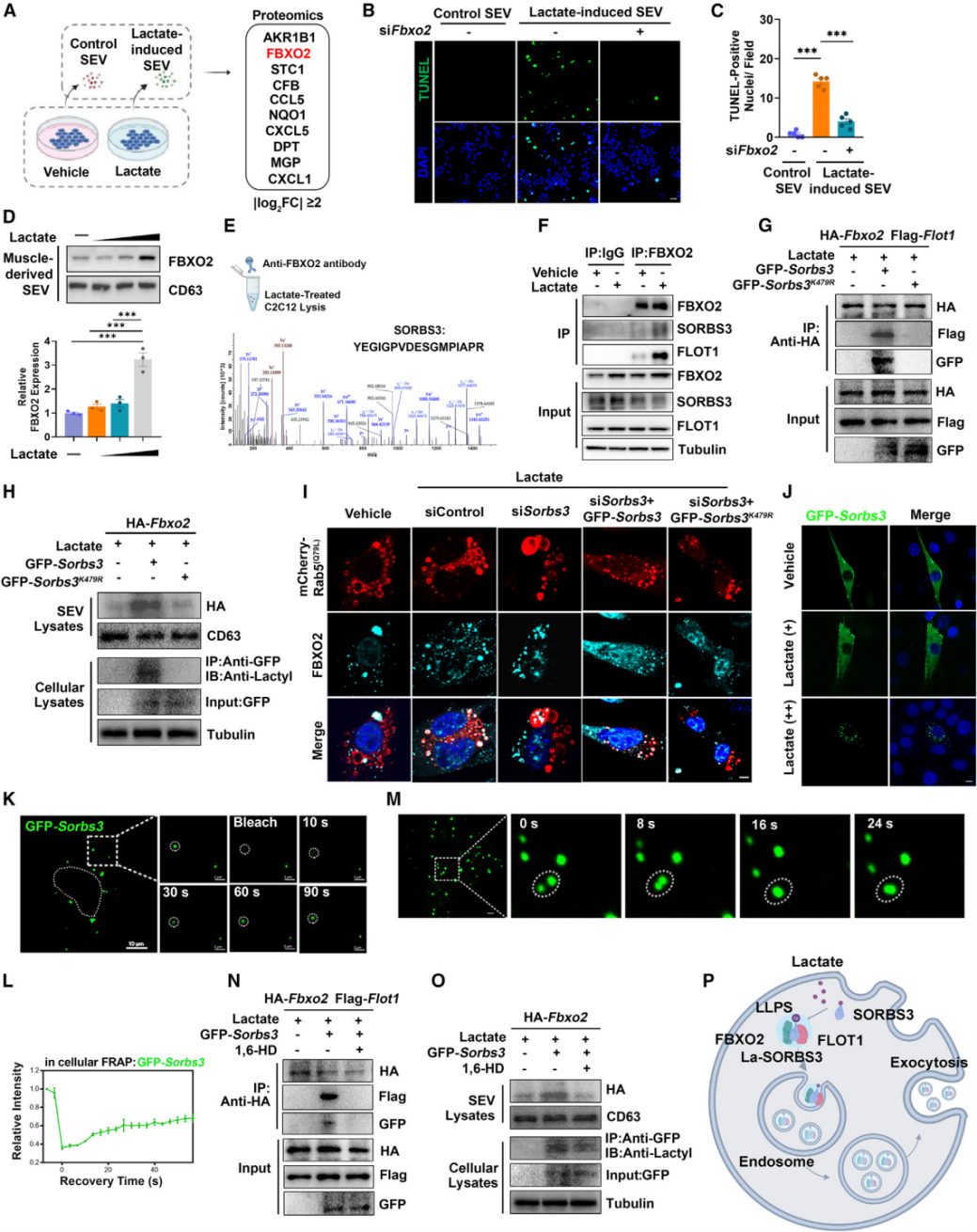
图4. SORBS3乳酸化促进SEVs中FBXO2水平的升高
破坏乳酸体形成能缓解过度运动引起的肝脏纤维化
为了明确SORBS3在乳酸体形成中的关键作用,作者构建了肌肉特异性SORBS3敲除小鼠(SORBS3-MKO)。和WT小鼠相比,SORBS3-MKO过度运动后肌肉组织的乳酸体水平显著下降,肌肉组织和血浆中收集到的SEVs中FBXO2水平均有所降低,肝损伤、胶原积累和纤维化相关基因的水平相对较低。
为了进一步证实FBXO2是被招募到乳酸体中的关键效应物,作者构建了肌肉特异性敲除FBXO2小鼠(FBXO2-MKO)。与对照组Fbxo2fl/fl小鼠相比,FBXO2-MKO能显著抵抗过度运动对肝脏的损害。分别将FBXO2-MKO或者Fbxo2fl/fl小鼠过度运动后肌肉来源的SEVs注射到正常饲养的野生小鼠,Fbxo2fl/fl来源的SEVs能显著促进WT小鼠的肝纤维化,而FBXO2-MKO来源的SEVs则没有上述效果。
总之,这些结果表明乳酸体的形成参与了肝纤维化的发展。
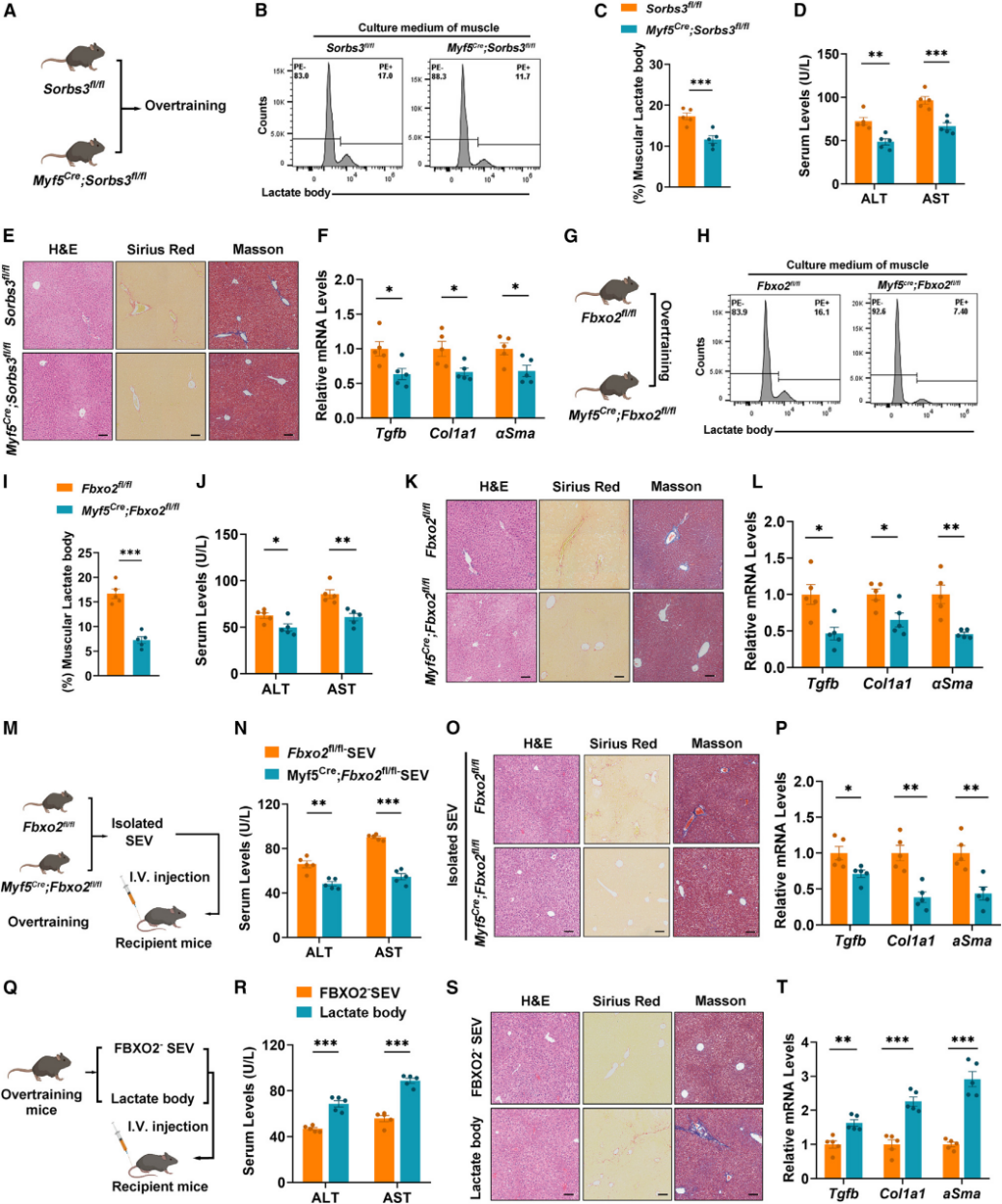
图5. 肌源性乳酸体诱导肝纤维化
乳酸小体通过增强其泛素化抑制MCL1在肝细胞中的表达
为了进一步研究乳酸体诱导肝纤维化的机制,作者在Hepa1-6细胞中过表达HA-FBXO2,coIP-MS鉴定检测到MCL1是其潜在下游作用蛋白,因为这个基因与细胞的生存相关,引起了作者的注意。随后,免疫共沉淀(coIP)证实了FBXO2与MCL1存在相互作用。因此作者猜测FBXO2应该是通过MCL1影响肝细胞的生命活动。
作者发现过度运动的FBOX2-MKO小鼠肝脏MCL1水平显著要高于Fbxo2fl/fl小鼠。在细胞上过表达FBOX2后MCL1蛋白水平下调,但是QCOR检测的mRNA水平是没有变化的,而野生型小鼠过量运动产生的乳酸体会以剂量依赖的方式诱导原代肝细胞中MCL1蛋白减少。鉴于FBXO2能作为泛素连接酶复合体中的受体来促进蛋白质降解,作者推测它可能通过泛素化降解MCL1来发挥诱导肝脏细胞凋亡的功能。使用蛋白酶体的抑制剂——MG132作用肝细胞后,乳酸体下调MCL1的功能消失。这些发现表明,乳酸体可以促进MCL1泛素化和蛋白酶体依赖的降解。随后作者使用AAV-TBG-MCL1在小鼠肝脏特异性过表达MCL1基因,发现过表达MCL1后,能抑制乳酸体对肝纤维化作用和肝损伤。MCL1作为Bcl-2家族的一员,已被报道通过多种经典的下游信号通路发挥抗凋亡作用。作者通过一系列实验证实了乳酸体能导致MCL1降解,这种生命现象与BAX/BAK激活增加有关,并伴随着肝细胞中caspase-9和caspase-3的激活。而过表达MCL1后能抑制乳酸体诱导肝细胞的凋亡作用。BAX/BAK信号通路参与线粒体DNA (mtDNA)释放,进而导致肝星状细胞的激活和肝纤维化。细胞实验的结果显示,乳酸体能诱导肝细胞培养基中mtDNA的水平,过表达MCL1后能阻断这种现象。LX-2细胞中分别加入含有乳酸体刺激后的肝细胞培养基、FBXO2-SEVs或VBIT-4(mtDNA分泌抑制剂)作用肝细胞后的培养基,不出意外,乳酸体刺激后的肝细胞培养基能诱导LX-2的激活,而VBIT-4作用肝细胞后的培养基没有激活作用。
综上所述,作者发现了乳酸体能通过FBXO2-MCL1-BAX/BAK通路诱导的mtDNA释放中,随后激活肝星状细胞并促进肝纤维化。

图6. 乳酸小体通过MCL1-BAX/ BA途径诱导肝纤维化
红景天苷抑制肌乳酸体形成,减轻过度训练引起的肝纤维化
过度运动引起的肌内乳酸积累触发乳酸体的释放,从而导致肝损伤,降低肌乳酸是否可以作为新的治疗方法,实现对过度训练引起的肝纤维化的预防呢?早期实验发现红景天苷能抑制肝细胞的LDH的活性,因此作者探究了这个药物是否也能抑制肌肉乳酸水平上升。研究团队给过度运动的小鼠连续灌胃红景天苷12周,每周灌胃3次。发现红景天苷确实能降低肌肉乳酸水平,并且血清和肌肉组织中的乳酸体的水平也有所下降。将小鼠血浆中分离的SEVs加入培养基中培养肝细胞,相比于对照组,给药后的SEVs对肝细胞凋亡的促进作用显著降低。对过度运动的小鼠给予红景天苷处理可显著减轻肝纤维化、肝损伤、胶原沉积以及促纤维化和促炎基因的表达,这一结果与细胞实验一致。总的来说,这些数据证实了红景天苷对过度训练引起的肝纤维化的潜在预防作用。
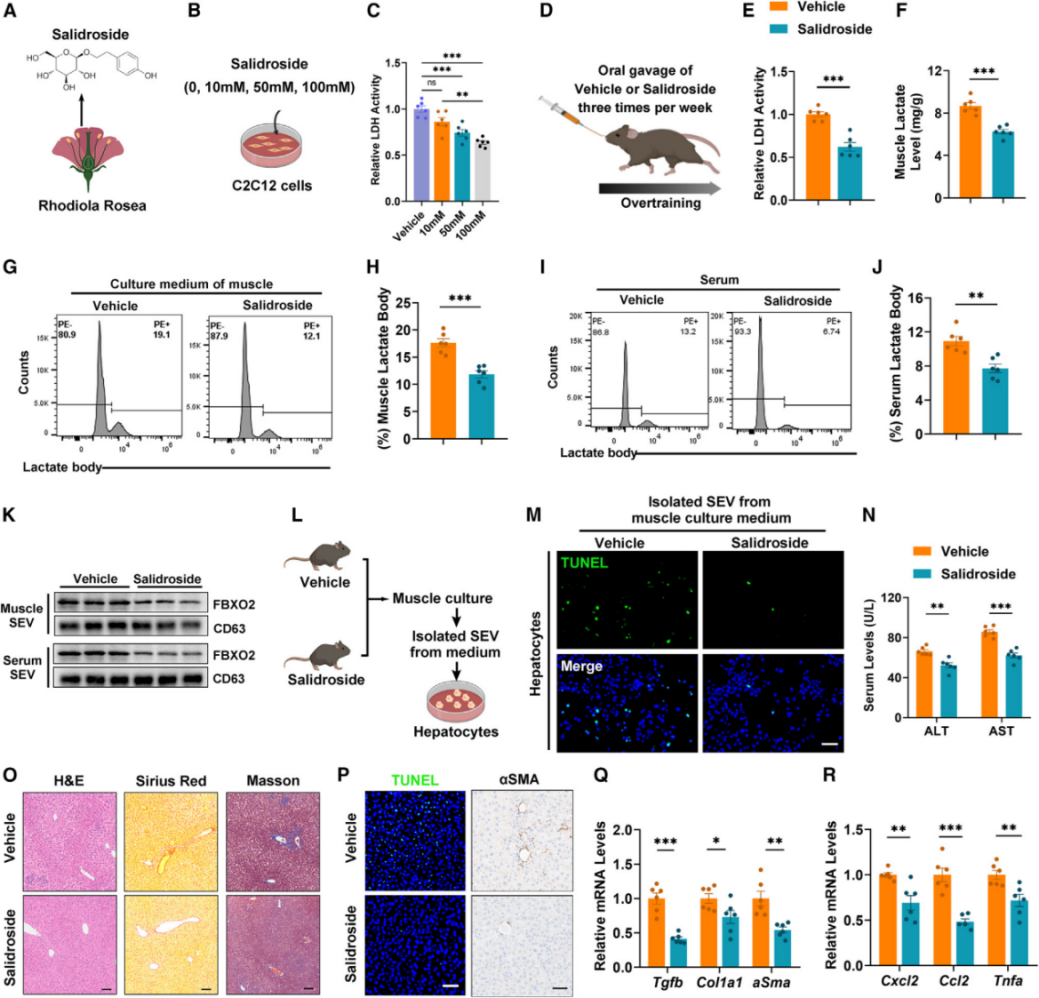
图7. 红景天苷抑制肌乳酸体形成,减轻过度运动引起的肝纤维化
总结
本研究揭示了过度运动训练在骨骼肌中积累的乳酸会导致SORBS3乳酰化修饰,引发其液-液相分离,增强其与FLOT1的相互作用,促进的FBXO2乳酸体分拣,进而通过MCL1-BAX/BAK信号通路诱导肝细胞凋亡和肝细胞纤维化的机制,提出针对乳酸积累的干预可能是一种缓解过度训练影响的潜在治疗策略,并进一步证实了红景天苷对过度运动造成的肝纤维化的缓解作用,为肝脏健康提供一种新的有效治疗策略。

查看更多

查看更多

查看更多

联系我们

返回顶部