查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
癌症治疗失败主要源于两大障碍:肿瘤的耐药性与转移。一方面,癌细胞通过多种耐药机制导致药物治疗效果显著降低;另一方面,免疫细胞功能异常,特别是T细胞在肿瘤微环境中发生耗竭,表现为功能受损和增殖能力下降,从而无法有效清除肿瘤细胞。此外,肿瘤组织中细胞毒性免疫细胞浸润数量的减少,也削弱了免疫系统对肿瘤的攻击能力。为同时克服药物治疗无效和免疫反应不足这两大难题,研究人员正在致力于开发靶向PD-L1和VEGFR2的双特异性纳米抗体。

汉恒生物为本研究提供了LipoFiter™ 3转染试剂,保障了实验的顺利推进。2025年4月19日,中国科学院福建物质结构研究所陈卓研究员与张蕾研究员在Molecular Cancer(IF=27.7)上发表题为“Transient intracellular expression of PD-L1 and VEGFR2 bispecific nanobody in cancer cells inspires long-term T cell activation and infiltration to combat tumor and inhibit cancer metastasis”的研究论文。该研究成功开发出一种同时靶向PD-L1和VEGFR2的双特异性纳米抗体FAP1V2,该分子不仅能有效抑制肿瘤生长与转移,还可增强T细胞介导的免疫应答,为肿瘤免疫治疗提供了新的潜在策略。
下面,我们一起来看看具体的研究内容。
研究成果
1.FAP1V2纳米抗体结合PD-L1与VEGFR2的结构基础源于其VH区设计FAP1V2
序列依次包含IL-2信号肽、抗PD-L1 VH区(AP1)、(GGGGS)3连接子、EGFP片段、(GGGGS)3连接子、抗VEGFR2 VH区(AV2)以及C端的GPI锚定序列(图1A)。GPI锚定肽能够将FAP1V2稳定表达于细胞膜表面,从而促进其与PD-L1和VEGFR2的膜上结合。此外,作者还构建了对照质粒pEGFP-C1-AP1(FAP1,仅含AP1序列)和pEGFP-C1-AV2(FAV2,仅含AV2序列),以便进行比较。为进一步评估FAP1V2与两种靶标蛋白的结合潜力,研究团队进行了计算机模拟与分子对接分析。结果显示,FAP1V2分别与PD-L1和VEGFR2之间可形成特异的氢键和静电相互作用,从结构层面支持了其双特异性结合能力。
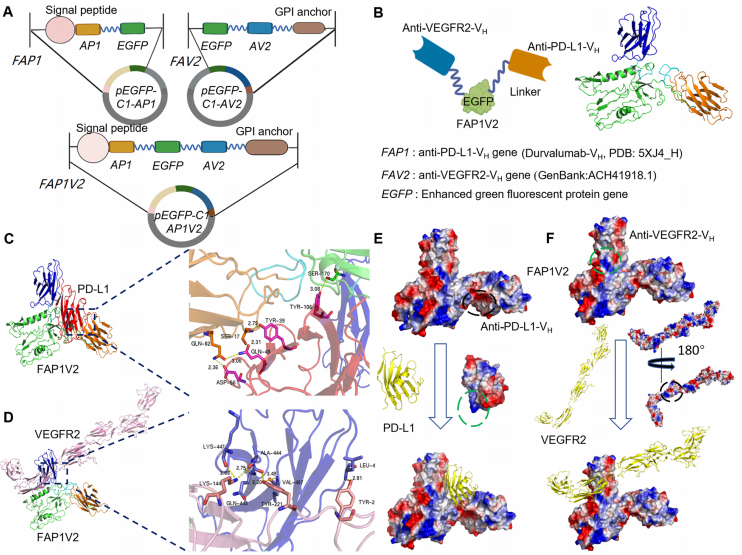
图1 复合物FAP1V2/PD-L1及FAP1V2/VEGFR2的胞内抗体设计及分子对接
>2.FAP1V2 在细胞中的表达与靶标特异性
为评估FAP1V2的功能,本研究选用了人宫颈癌细胞HeLa和小鼠Lewis肺癌细胞LLC两种模型细胞系:HeLa常用于体外实验,LLC则适用于荷瘤小鼠中的免疫相关研究。将携带FAP1V2基因的质粒转染至HeLa细胞后,通过PCR等技术验证了该质粒的成功表达。Co-IP实验进一步证实,FAP1V2能够特异性结合PD-L1和VEGFR2。流式细胞术与共聚焦激光扫描显微镜(CLSM)分析结果显示,FAP1V2可显著抑制细胞表面PD-L1或VEGFR2与商品化RBITC标记对应抗体之间的结合,从而有效阻断PD-L1/PD-1信号通路。
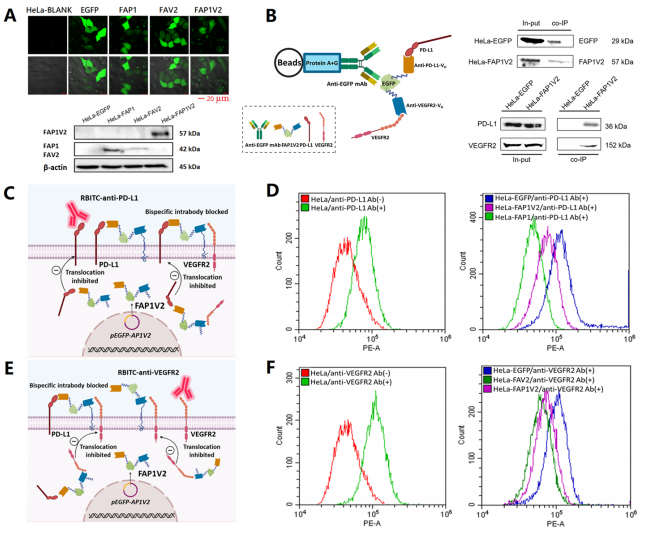
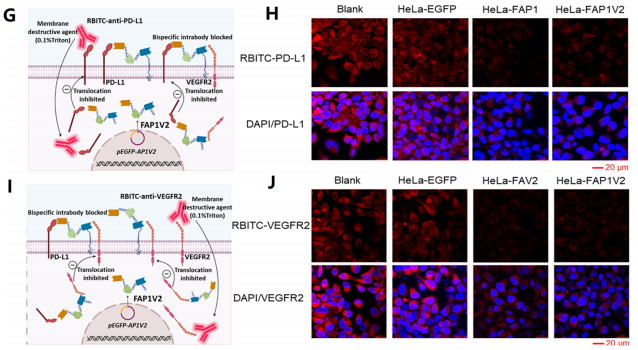
图2 FAP1V2特异性结合PD-L1和VEGFR2可有效抑制肿瘤进展
3.FAP1V2抑制PD-L1/PD-1检查点并增强体内T细胞介导的抗肿瘤免疫
基于小鼠模型的肿瘤抑制实验显示,表达FAP1V2的LLC细胞能够显著抑制肿瘤生长。相比之下,FAP1组抑制效果较弱,而FAV2组呈现中等程度的效果。
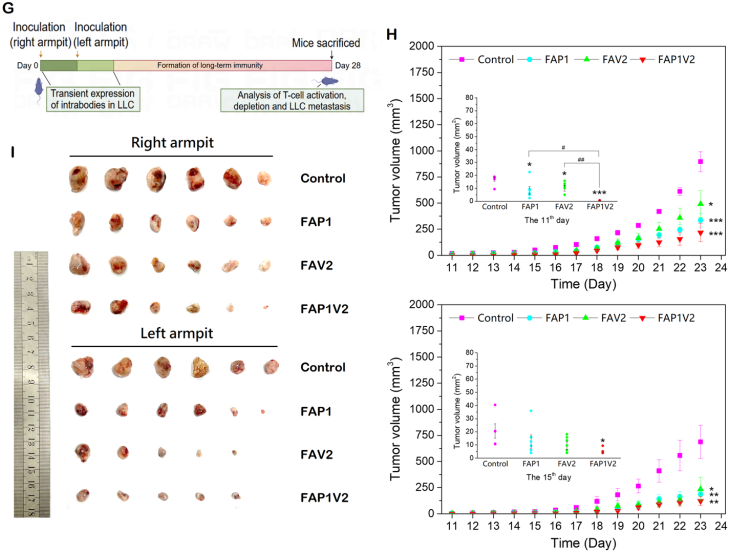
图3 FAP1V2介导PD-1检查点阻断免疫抑制在小鼠模型中的疗效
通过免疫荧光分析肿瘤组织中TCRβhi T细胞和PD-1hi免疫细胞的浸润情况,发现FAP1、FAV2和FAP1V2处理组中,TCRβhi T细胞浸润均有所增加,肿瘤细胞清除增强,PD-1hi免疫细胞数量下降,其中FAP1V2组效果最为显著。此外,由于CD25(IL-2Rα)在活化T细胞中高表达,作者进一步分析了小鼠脾脏中CD25hi T细胞的比例。流式细胞术结果显示,在所有胞内抗体表达组中,CD25hi免疫细胞数量均有所上升,尤其在FAP1V2和FAP1组中增长最为明显,表明其有效增强了免疫应答。
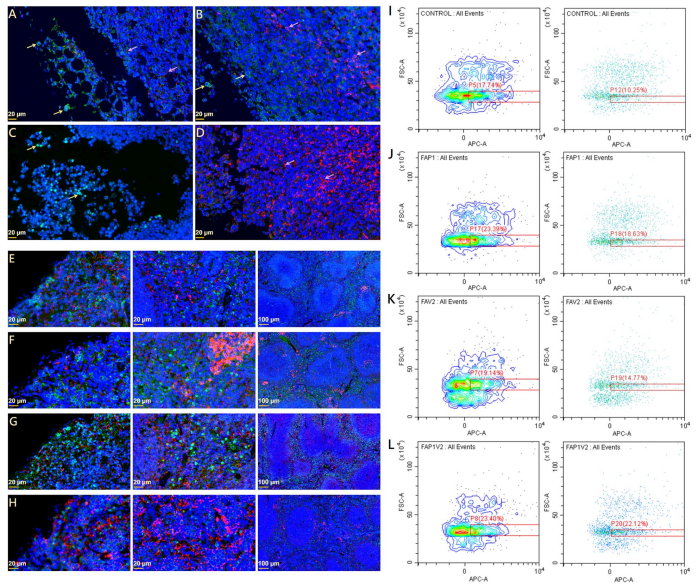
图4 体内诱导的针对LLC肿瘤的免疫系统激活
4.FAP1V2和FAV2抑制癌细胞迁移
细胞活力实验表明,FAP1、FAV2和FAP1V2对肿瘤细胞活力均无显著影响。然而,划痕实验结果显示,FAP1V2和FAV2可明显抑制HeLa与LLC细胞的迁移能力。进一步的体内实验也证实,FAP1V2能够有效减少LLC细胞在肝脏和肺组织中的转移。这些结果表明,FAP1V2主要通过阻断VEGFR2信号从而抑制癌细胞的迁移和转移。
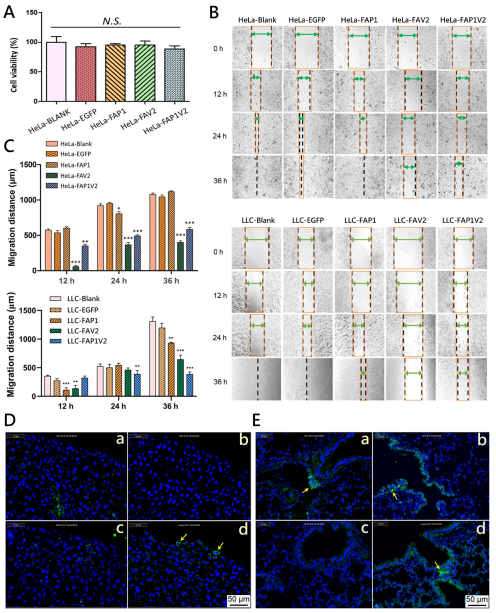
图5 FAP1V2对癌细胞迁移能力的影响
5.FAP1V2介导的HeLa细胞差异基因表达
GO分析显示,FAP1V2处理的HeLa细胞中,与细胞迁移、粘附、组织发育、增殖、分化和免疫系统过程相关的基因表达发生显著改变。关键差异基因富集于Wnt/β-catenin、ERK1/2、TNFβ、PI3K/AKT和mTOR等信号通路。此外,一些促进癌细胞迁移的基因(如MET、PIK3CA)转录水平下调,而抑制迁移的基因(如PCDHs、UCN)则表达上调。
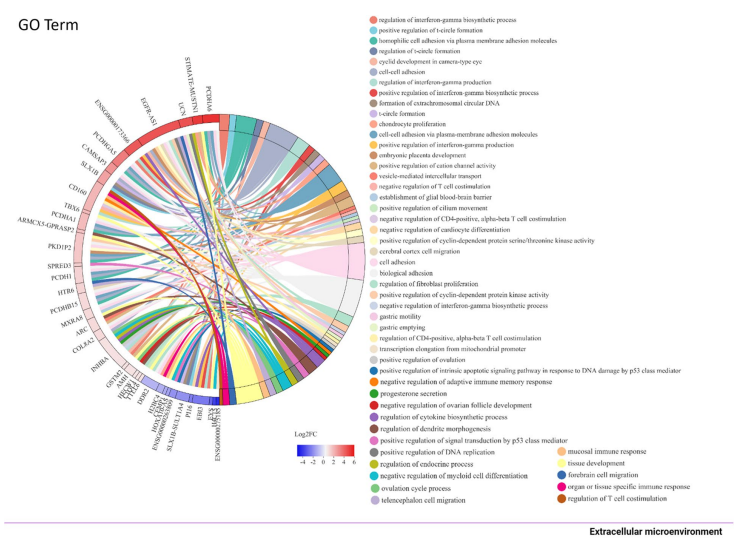
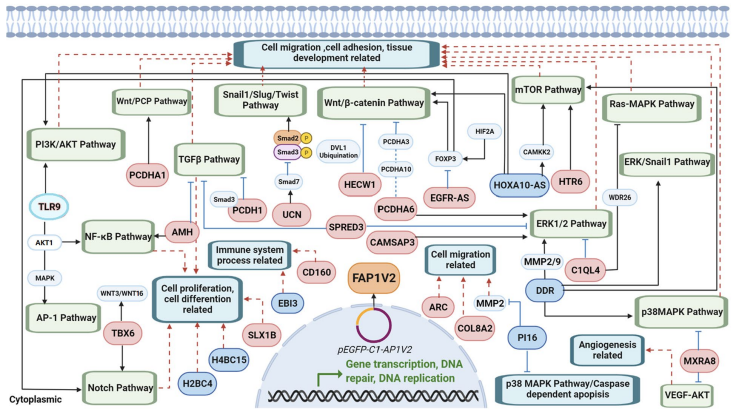
图6 HeLa-FAP1V2细胞转录组分析
综上所述,本研究成功开发了一种新型双特异性VH结构域胞内抗体FAP1V2,能够同时靶向PD-L1和VEGFR2。该分子通过阻断PD-1/PD-L1免疫检查点并抑制肿瘤转移相关信号通路,显著增强TCRβhi T细胞介导的抗肿瘤免疫反应,并有效抑制肿瘤转移。转录组分析进一步揭示,FAP1V2可调控Wnt/β-catenin、TGF-β1和PI3K/AKT等重要信号通路,上调抑癌基因(如PCDHs、UCN),同时下调促转移因子(如MET、PI3K 110α),从而发挥双重抗肿瘤效应。基于FAP1V2所构建的AP1V2-NP递送系统进一步提升了治疗效果,为肿瘤免疫治疗策略及胞内抗体的应用提供了新思路。

查看更多

查看更多

查看更多

联系我们

返回顶部