查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
在上一期的干货中,小恒主要为大家介绍了细胞焦亡的相关理论基础和核心执行者GSDM家族,除了GSDM家族外,另一大名鼎鼎的家族——炎症小体家族的成员们在细胞焦亡中又扮演了什么角色呢?本期文章,我们将为大家介绍这一庞大家族在细胞焦亡中的功能与机制。

炎症小体的组成
炎症小体是一类蛋白复合物,这一概念由Tschopp研究组在2002年首次提出[1]。在经典的细胞焦亡途径中,炎症小体响应病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)而组装,激活炎症反应;在非经典焦亡途径中,NLRP3炎性小体可通过人源caspase-4/5或鼠源caspase-11诱导进行组装。在细胞受到刺激或感染时,特定炎症小体招募并激活炎性caspase,加工细胞因子白介素-1β(IL-1β)和白介素-18(IL-18)并使之成熟和分泌,从而增强免疫应答,并水解Gasdermin(GSDM)导致细胞焦亡[2]。
炎症小体一般包含三部分——胞质模式识别受体(PRR)、凋亡相关斑点样蛋白(ASC)以及下游的caspase家族(该家族的故事详见汉恒生物干货系列推文)。
炎症小体因为PRR的不同可被分为多种类型,参与炎症小体激活途径的PRR一般为NOD样受体家族(即NLR)或AIM2样受体(ALR)家族蛋白。最广为人知的NLR家族是一类具有核苷酸结合域(NBD)的蛋白家族,为胞浆内的模式识别受体。NLR家族的主要组成结构包括:C端的富含亮氨酸的重复序列(LRR),LRR具有识别受体和自我调节作用;中间区域的核苷酸结合寡聚化区域(NACHT),NACHT区域是唯一的NLR家族同源结构,包括核苷酸结合域(NBD)、2个螺旋结构域(分别为HD1、HD2)和翼状螺旋结构域(WHD),其具有ATP酶活性,可通过ATP水解调节NLRP蛋白活性,激活下游信号;N端的caspase激活和半胱天冬酶激活和募集结构域(CARD),某些亚型还具有热蛋白结构域(PYD),CARD和PYD区域介导同型蛋白-蛋白相互作用并传递给下游信号[3]。具有N端PYD结构的NLR称为NLRP,而具有N端CARD的NLR称为NLRC。
ALR属于P200家族蛋白(也称为PYHIN或HIN-200蛋白)成员,它们具有共同的结构特征包括N端PYD结构域和C端的寡核苷酸结合HIN-200结构域。PYD结构域可与其他含PYD的家族成员或适配蛋白ASC相互作用;HIN-200结构域负责与DNA结合,使这些蛋白质能够感知并响应外来或受损核酸的存在[4]。
ASC也称为PYCARD或TMS1,在未受刺激的细胞中,ASC作为可溶蛋白存在于细胞质和细胞核中,而细胞接受刺激感染或损伤信号后,ASC在胞质中聚集成斑点状,故称为凋亡相关斑点样蛋白[5]。ASC包含和N端PYD结构域和C端CARD结构域,通过PYD与PRR相互作用,通过CARD与caspase相互作用。在炎症小体激活过程中,ASC聚集成大分子的二聚体ASC斑点是caspase活化、释放IL-1β等细胞因子的级联放大平台。
NLRP1、NLRP3、NLRC4和AIM2炎症小体最常被报道。而其他的验证小体,如NLRP6、NLRP8和NLRP13、NLRP9等的生物学作用尚不明确。接下来,我们详细看看不同炎症小体的特征和功能吧。
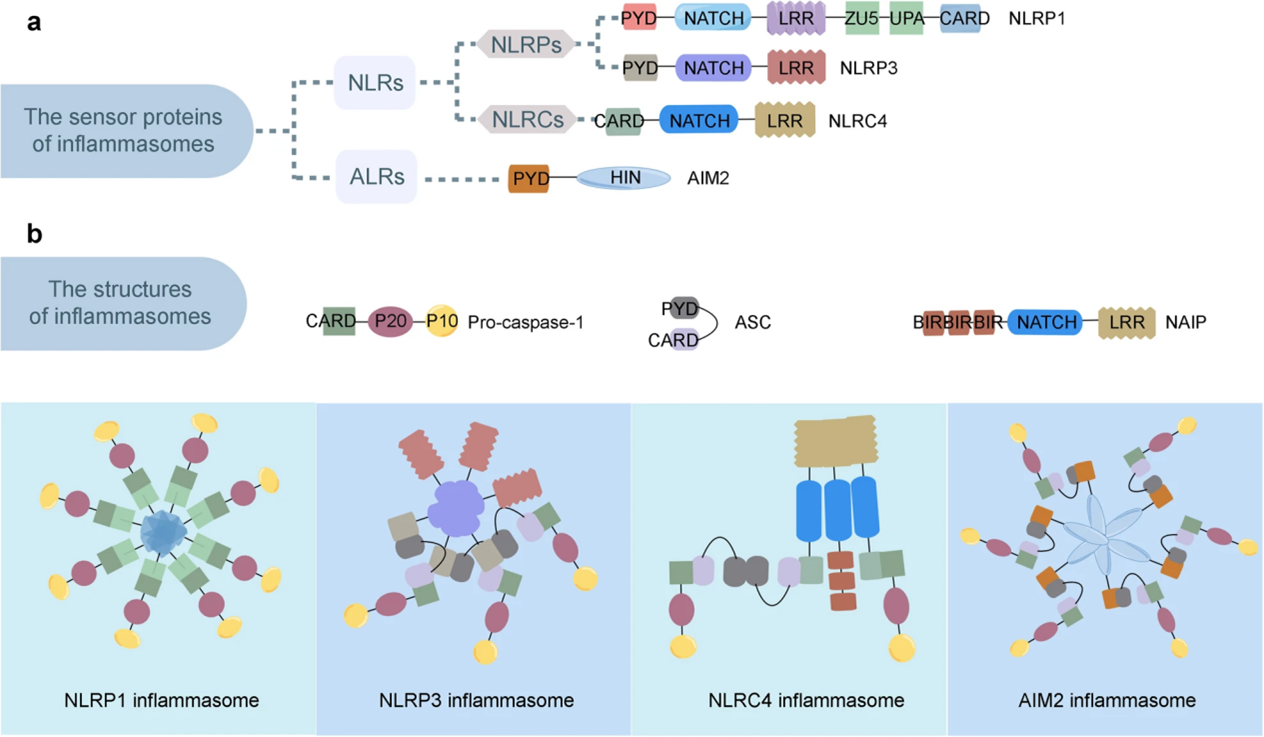
图1. 炎性小体PRR和炎性小体的代表性结构示意图[6]
常见炎症小体
1.NLRP1炎症小体
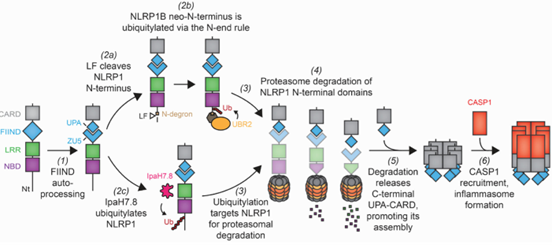
NLRP1炎症小体由NLRP1、ASC和caspase-1构成。NLRP1属于NLR超家族,是该家族中第一个被发现可与ASC和caspase1形成复合体的蛋白,但由于其在人类和啮齿动物之间的保守性差、激动剂研究进展缓慢、在骨髓细胞中的表达和激活有限等,直到近年才受到广泛关注。人NLRP1的结构包括N端PYD、NACHT、LRR和C端CARD结构域。此外,在LRR和CARD结构域之间还包含一个其他NLR不具备的FIIND结构域,FIIND则由ZU5(存在于ZO-1和UNC5结构域中)和UPA(在UNC5、PIDD和Ankyrin结构域中保守)组成。人类NLRP1由人类的单个基因编码,而小鼠NLRP1则有4个Nlrp1同源/旁系同源基因,具有六个单体型(称为NLRP1a、b、c、d、e、f),这些变体在不同品系小鼠中存在显著多态性。虽然小鼠NLRP1和人种属具有共同的主体结构特征,但缺乏N端PYD使得其通过自身CARD结构域直接募集caspase-1,这些种属差异限制了利用常规小鼠疾病模型探究NLRP1在人类疾病中保守功能的进展[7]。
FIIND结构域与NLRP1的激活密切相关。FIIND结构域可发生自水解,产生NLRP1NT(NBD-LRR-ZU5片段)和NLRP1CT(UPA-CARD片段)两条多肽链,其中,NLRP1CT具有形成炎症小体的活性,且能与NLRP1NT及未被切割的全长NLRP1结合形成自抑制体,抑制自身的活性。NLRP1炎症小体可通过NLRP1NT功能性降解、释放NLRP1CT这一过程激活。激活后的NLRP1的C端CARD结构域可募集衔接蛋白ASC和caspase-1形成炎性小体复合物,进而启动焦亡和促炎细胞因子的释放[8,9]。
常见的NLRP1激活剂包括病毒蛋白酶、双链RNA(dsRNA)、胞壁酰二肽、紫外线B等等。目前普遍认为DPP8/DDP9可通过与NLRP1NT的相互作用抑制NLRP1活性,Talabostat(小鼠和人NLRP1的双重激动剂)通过抑制这种相互作用,诱导NLRP1NT功能性降解,最终导致活性炎症小体复合物的形成[10,11]。此外,也有研究发现NLRP1炎症小体也被某些其他机制激活,例如:卡波西肉瘤相关疱疹病毒可通过其ORF45蛋白直接激活胞内的NLRP1炎症小体,该过程不依赖于病毒DNA和细胞DNA受体IFI16的识别[12];福氏志贺氏菌通过其分泌的E3泛素连接酶效应子IpaH7.8激活NLRP1b,这可能与IpaH7.8可直接、特异性地泛素化NLRP1b有关[13]。
2.NLRP3炎症小体
NLRP3炎症小体是研究较深入的一类蛋白复合体,也是迄今为止发现配体数最多、最复杂的一种炎症小体,由三个主要蛋白质成分组成:NLRP3、ASC和caspase-1。NLRP3是一种三联蛋白,主要包括三个结构域:N端的PYD结构域负责介导下游信号的传输;中央NACHT结构域具有ATP酶活性,驱动受体激活过程中的寡聚化;C端的LRR结构域能识别相应病原体或危险信号进而启动NLRP3炎症复合体的组装,在配体识别中起重要作用[15]。
通常情况下,NLRP3作为传感器响应各类刺激,通过同型NACHT结构域相互作用实现自寡聚化,寡聚化的NLRP3通过PYD-PYD结构域相互作用募集ASC,并诱导ASC聚集形成“ASC斑点”。组装的ASC通过CARD-CARD相互作用募集pro-caspase-1,形成NLRP3-ASC-caspase-1蛋白复合物,导致pro-caspase-1自裂解激活及IL-1β前体蛋白水解加工和成熟。活化的caspase-1还裂解gasdermin D(GSDMD)并释放其N端结构域,该结构域转移至细胞膜并形成孔道,介导包括炎性细胞因子IL-1β和IL-18等细胞内容物的释放,并诱发细胞焦亡[16]。
NLRP3炎症小体的激活包括经典、非经典路径和替代路径。经典的激活路径可以分为两个阶段:启动阶段(信号1)和激活阶段(信号2)。启动阶段由模式识别受体介导信号激活,相应PRR识别PAMP或DAMP(如LPS和TNF-α)后,可进而通过NF-kB信号上调NLRP3、IL-1b等炎症小体组分的转录表达[17,18]。激活阶段NLRP3炎症小体由多种结构、功能不同的激动剂诱发,从无活性的同源多聚体转变为活性多聚炎性体,但目前并没有研究证据表明NLRP3直接结合这些激动剂。激动剂包括晶体或颗粒物质(β-淀粉样蛋白、硅石、尿酸盐晶体等)、生物信号(线粒体活性氧、细胞外ATP等)、病原体(病毒、胞内菌以及微生物成分等)等,这些激动剂可能通过一些信号,如离子通量(K+外排、Cl−外排、Na+内流和Ca2+动员等)、线粒体功能障碍、NLRP3刺激诱导的活性氧(ROS)和线粒体DNA(mtDNA)的释放、溶酶体破坏和反式高尔基体分解等途径激活NLRP3炎症小体[19]。
根据现有的人和小鼠研究进展,非经典激活则依赖人源caspase-4/-5或鼠源caspase-11激活。在小鼠细胞中,Toll样受体(TLR)和细胞因子受体的配体诱导转录因子NF-κB的激活和I型干扰素的产生,从而通过JAK/STAT通路或补体C3-C3aR轴上调caspase-11的表达,活化的caspase-11裂解GSDMD以驱动焦亡和NLRP3炎性依赖性caspase-1裂解。而caspase-4在人类细胞中高水平表达,因此不需要启动步骤。研究表明,革兰氏阴性菌释放的LPS可与小鼠caspase-11或人caspase-4/-5的CARD结构域结合,诱导caspase寡聚化和自体蛋白水解。此外,氧化磷脂1-棕榈酰-2-花生四烯酰-sn-甘油-3-磷酸胆碱(oxPAPC)已被证明直接与小鼠caspase-11和人caspase-4结合,并激活树突状细胞(DC)中的非经典NLRP3炎性小体[20]。
NLRP3炎症小体激活的替代途径中,单独的TLR配体可通过TLR4-TRIF-RIPK1-FADD-caspase-8信号轴激活NLRP3炎症小体,这一途径在激活剂(如LPS)刺激后的人和猪单核细胞中的NLRP3炎性小体中得到了证实,但这种炎性小体缺乏经典和非经典NLRP3炎性小体激活的特征,包括ASC斑点形成、焦亡诱导或K+外排[21]。
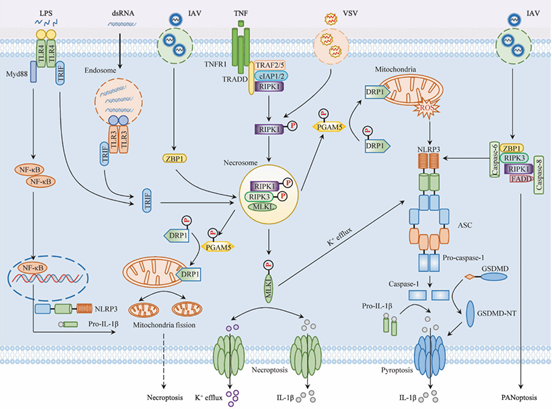
图3. 经典、非经典和替代NLRP3炎性小体激活的机制[19]
3.NLRC4炎症小体
NLRC4炎症小体由NLRC4、ASC和pro-caspase-1组成。NLRC4又称IPAF,由3个结构域组成,N端为CARD效应结构域,负责下游信号转导;中段为NACHT结构域;C端为LRR,负责识别和结合PAMP等配体。
无活化信号时,NLRC4通过LRR结构域与NACHT结构域互作,抑制自身多聚体化而形成非活化状态,在NACHT结构域内由HD1、WHD、HD2形成一个特殊的ADP结合口袋,稳定NLRC4的非活性构象。当活化信号出现时,传感器蛋白凋亡抑制蛋白(NAIP)被激活,与NLRC4共组装形成NAIP-NLRC4炎性小体[22]。NAIP结合配体诱导NACHT结构域构象变化,HD1和HD2之间发生旋转,使LRR结构域构象变化,解除NACHT结构域的抑制,触发NLRC4寡聚化并暴露CARD效应结构域,最终导致NLRC4炎性小体被激活[23]。NLRC4可通过CARD-CARD相互作用直接募集和活化pro-caspase-1,激活的caspase-1触发GSDMD介导的细胞焦亡。一些研究表明,激活的NLRC4还可通过ASC促进这一过程,虽然ASC并非NLRC4炎性小体形成的严格要求,但ASC的缺失会降低caspase-1切割效率、减少IL-1β释放,这表明ASC增强了相关反应[24]。此外,NLRC4还可激活caspase-8,后者进一步激活caspase-3/-7以触发细胞凋亡。
小鼠基因组总共编码7种NAIP,而人类基因组仅编码1种NAIP(hNAIP)。小鼠mNAIP5、mNAIP6和人hNAIP可结合胞质溶胶中的细菌鞭毛蛋白,并与NLRC4相互作用,形成炎性小体。革兰氏阴性菌(如沙门氏菌、嗜肺军团菌和铜绿假单胞菌等)的鞭毛蛋白可通过Ⅲ、IV型分泌系统感染细胞,对NLRC4炎性小体的活化起重要作用。除鞭毛蛋白外,NAIP还识别细菌III型分泌系统(T3SS)的某些成分[25]。此外,hNAIP还可识别T3SS杆蛋白和针蛋白。同时,NLRC4炎性小体也能够被无鞭毛的细菌激活,如福式志贺菌,但具体机理尚不明确。
4.AIM2炎症小体
AIM2炎症小体由AIM2、ASC和pro-caspase-1组成,其核心AIM2是一种细胞质传感器,可识别外源或宿主来源的DNA分子,最早在人黑色素瘤细胞株中被发现,由于它在黑色素瘤细胞株中表达缺失且能逆转该肿瘤的表型而被命名为“黑色素瘤缺乏因子2”。AIM2包含两个典型结构域,一个为N端PYD结构域,其包含一个六螺旋束,与其他PYD结构域具有高亲和力;另一个为C端由一对串联的低聚糖/寡核苷酸折叠区组成的HIN结构域,可结合dsDNA或其他蛋白质,而一些ALR如IFI16在C末端含有两个HIN结构域[26]。
AIM2经细胞质内的细菌、病毒、真菌和寄生虫等病原体,或细胞质中异常存在的dsDNA激活后,适配器蛋白ASC募集procaspase-1,诱导炎症复合体的形成,从而激活caspase-1,并加工和释放GSDMD和促炎细胞因子IL-1β、IL-18等。AIM2通过PYD-PYD同型相互作用,再与ASC相互作用,导致螺旋丝状结构的组装,从而使AIM2炎症小体发生寡聚化,而HIN结构域以序列独立的方式与dsDNA结合。在缺乏配体的情况下,AIM2中PYD和HIN结构域之间的分子内相互作用使传感器保持为自抑制状态,抑制PYD介导的寡聚并抑制HIN-DNA结合;只有在dsDNA结合到HIN结构域,构象改变后才使得PYD结构域从HIN结构域上解离,使下游信号传递到适配器ASC[27]。
研究表明,弗朗西斯菌、牛痘病毒和小鼠巨细胞病毒、烟曲霉都是AIM2炎性小体的配体,李斯特氏菌也能使之部分激活;当某些物质(如胆固醇的过度积累)导致细胞核膜或线粒体膜完整性受损,DNA泄露至胞质也可引起AIM2炎性小体激活[28]。dsDNA有效激活AIM2炎性小体的能力取决于其长度,有研究表明70bp的dsDNA是最小激活长度,200 bp的dsDNA可实现最佳的AIM2激活,300 bp的dsDNA诱导AIM2聚合速度显著快于72 bp[29]。
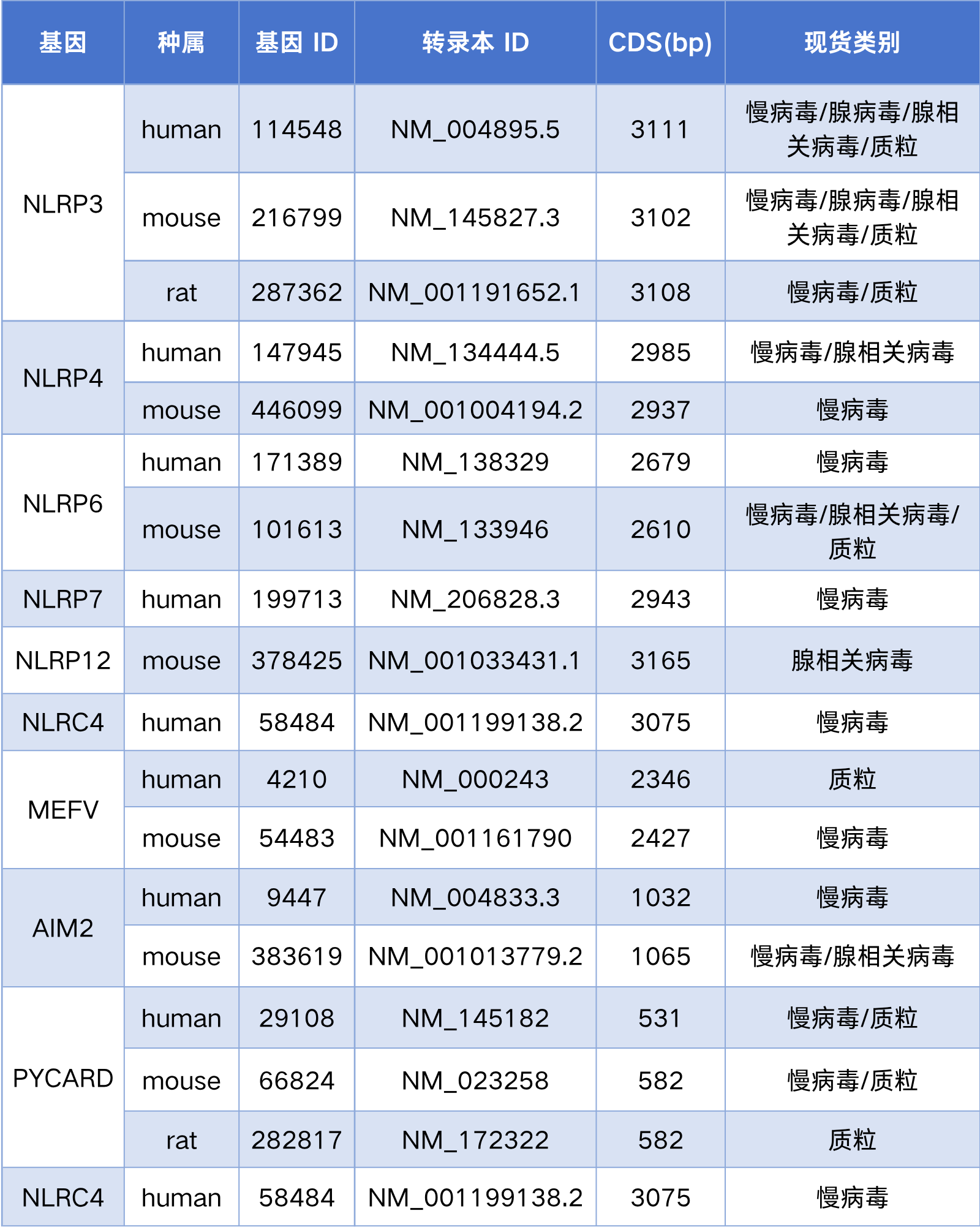
汉恒生物专营病毒包装十余载,建立了庞大的基因研究现货工具库,可为广大研究人员提供多种炎性小体相关基因的病毒现货。若有其他病毒包装需求或疑问,也欢迎随时咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。
汉恒生物炎症小体相关的载体现货
参考文献
[1] Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell. 2002 Aug;10(2):417-26.
[2] Broz P, Dixit VM. Inflammasomes: mechanism of assembly, regulation and signalling. Nat Rev Immunol. 2016 Jul;16(7):407-20.
[3] Meunier E, Broz P. Evolutionary Convergence and Divergence in NLR Function and Structure. Trends Immunol. 2017 Oct;38(10):744-757.
[4] Zeng S, Zhou Z, Li Y, Wu D, Xiao Q, Peng H. The dual roles of human PYHIN family proteins in cancer: mechanisms and therapeutic implications. Front Immunol. 2025 May 2;16:1576674.
[5] de Alba E. Structure, interactions and self-assembly of ASC-dependent inflammasomes. Arch Biochem Biophys. 2019 Jul 30;670:15-31
[6] Yao J, Sterling K, Wang Z, Zhang Y, Song W. The role of inflammasomes in human diseases and their potential as therapeutic targets. Signal Transduct Target Ther. 2024 Jan 5;9(1):10
[7] hou WC, Jha S, Linhoff MW, Ting JP. The NLR gene family: from discovery to present day. Nat Rev Immunol. 2023 Oct;23(10):635-654
[8] Gong Q, Robinson K, Xu C, Huynh PT, Chong KHC, Tan EYJ, Zhang J, Boo ZZ, Teo DET, Lay K, Zhang Y, Lim JSY, Goh WI, Wright G, Zhong FL, Reversade B, Wu B. Structural basis for distinct inflammasome complex assembly by human NLRP1 and CARD8. Nat Commun. 2021 Jan 8;12(1):188.
[9] D'Osualdo A, Weichenberger CX, Wagner RN, Godzik A, Wooley J, Reed JC. CARD8 and NLRP1 undergo autoproteolytic processing through a ZU5-like domain. PLoS One. 2011;6(11):e27396.
[10] Gai K, Okondo MC, Rao SD, Chui AJ, Ball DP, Johnson DC, Bachovchin DA. DPP8/9 inhibitors are universal activators of functional NLRP1 alleles. Cell Death Dis. 2019 Aug 5;10(8):587.
[11] Okondo MC, Rao SD, Taabazuing CY, Chui AJ, Poplawski SE, Johnson DC, Bachovchin DA. Inhibition of Dpp8/9 Activates the Nlrp1b Inflammasome. Cell Chem Biol. 2018 Mar 15;25(3):262-267.e5.
[12] Yang X, Zhou J, Liu C, Qu Y, Wang W, Xiao MZX, Zhu F, Liu Z, Liang Q. KSHV-encoded ORF45 activates human NLRP1 inflammasome. Nat Immunol. 2022 Jun;23(6):916-926.
[13] Sandstrom A, Mitchell PS, Goers L, Mu EW, Lesser CF, Vance RE. Functional degradation: A mechanism of NLRP1 inflammasome activation by diverse pathogen enzymes. Science. 2019 Apr 5;364(6435):eaau1330.
[14] Mitchell PS, Sandstrom A, Vance RE. The NLRP1 inflammasome: new mechanistic insights and unresolved mysteries. Curr Opin Immunol. 2019 Oct;60:37-45.
[15] Bae JY, Park HH. Crystal structure of NALP3 protein pyrin domain (PYD) and its implications in inflammasome assembly. J Biol Chem. 2011 Nov 11;286(45):39528-36.
[16] Lu A, Magupalli VG, Ruan J, Yin Q, Atianand MK, Vos MR, Schröder GF, Fitzgerald KA, Wu H, Egelman EH. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 2014 Mar 13;156(6):1193-1206.
[17] Su H, Bidère N, Zheng L, Cubre A, Sakai K, Dale J, Salmena L, Hakem R, Straus S, Lenardo M. Requirement for caspase-8 in NF-kappaB activation by antigen receptor. Science. 2005 Mar 4;307(5714):1465-8.
[18] Xie CB, Qin L, Li G, Fang C, Kirkiles-Smith NC, Tellides G, Pober JS, Jane-Wit D. Complement Membrane Attack Complexes Assemble NLRP3 Inflammasomes Triggering IL-1 Activation of IFN-γ-Primed Human Endothelium. Circ Res. 2019 Jun 7;124(12):1747-1759.
[19] Huang Y, Xu W, Zhou R. NLRP3 inflammasome activation and cell death. Cell Mol Immunol. 2021 Sep;18(9):2114-2127.
[20] Chu LH, Indramohan M, Ratsimandresy RA, Gangopadhyay A, Morris EP, Monack DM, Dorfleutner A, Stehlik C. The oxidized phospholipid oxPAPC protects from septic shock by targeting the non-canonical inflammasome in macrophages. Nat Commun. 2018 Mar 8;9(1):996.
[21] Gaidt MM, Ebert TS, Chauhan D, Schmidt T, Schmid-Burgk JL, Rapino F, Robertson AA, Cooper MA, Graf T, Hornung V. Human Monocytes Engage an Alternative Inflammasome Pathway. Immunity. 2016 Apr 19;44(4):833-46.
[22] Gong YN, Shao F. Sensing bacterial infections by NAIP receptors in NLRC4 inflammasome activation. Protein Cell. 2012 Feb;3(2):98-105.
[23] Hu Z, Yan C, Liu P, Huang Z, Ma R, Zhang C, Wang R, Zhang Y, Martinon F, Miao D, Deng H, Wang J, Chang J, Chai J. Crystal structure of NLRC4 reveals its autoinhibition mechanism. Science. 2013 Jul 12;341(6142):172-5.
[24] Broz P, von Moltke J, Jones JW, Vance RE, Monack DM. Differential requirement for Caspase-1 autoproteolysis in pathogen-induced cell death and cytokine processing. Cell Host Microbe. 2010 Dec 16;8(6):471-83.
[25] Zhao Y, Yang J, Shi J, Gong YN, Lu Q, Xu H, Liu L, Shao F. The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus. Nature. 2011 Sep 14;477(7366):596-600.
[26] Wang B, Bhattacharya M, Roy S, Tian Y, Yin Q. Immunobiology and structural biology of AIM2 inflammasome. Mol Aspects Med. 2020 Dec;76:100869.
[27] Jin T, Perry A, Jiang J, Smith P, Curry JA, Unterholzner L, Jiang Z, Horvath G, Rathinam VA, Johnstone RW, Hornung V, Latz E, Bowie AG, Fitzgerald KA, Xiao TS. Structures of the HIN domain:DNA complexes reveal ligand binding and activation mechanisms of the AIM2 inflammasome and IFI16 receptor. Immunity. 2012 Apr 20;36(4):561-71.
[28] Dang EV, McDonald JG, Russell DW, Cyster JG. Oxysterol Restraint of Cholesterol Synthesis Prevents AIM2 Inflammasome Activation. Cell. 2017 Nov 16;171(5):1057-1071.e11.
[29] Matyszewski M, Morrone SR, Sohn J. Digital signaling network drives the assembly of the AIM2-ASC inflammasome. Proc Natl Acad Sci U S A. 2018 Feb 27;115(9):E1963-E1972.

查看更多

查看更多

查看更多

联系我们

返回顶部