查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
什么是流式细胞术?
流式细胞术(Flow CytoMetry,FCM)是对悬液中的单细胞或其他生物粒子进行荧光法标记,通过检测标记的荧光信号,以实现高速、逐一的细胞定量分析和分选的技术。FCM常用于分析细胞表面和细胞内分子的表达、鉴定并确定异质细胞群中的不同细胞类型、评估分离亚群的纯度以及分析细胞大小和容积。

哪些流式实验需要抗体?
在FCM中,流式抗体凭借其对靶抗原的高亲和力以及多样化荧光标签满足多参数检测需求的特性,在各类细胞分析实验中成为了不可或缺的核心工具:
1.荧光激活细胞分选(FACS):利用来自细胞内的荧光蛋白,或者细胞marker的荧光抗体,通过荧光将目标细胞从混合细胞中分离出来,实现对目标细胞有选择的纯化。
2.免疫表型分析:血液中淋巴细胞免疫表型(亚群)分析是FCM最主要的临床应用之一,该技术高度依赖于针对细胞表面蛋白的特异性抗体探针。通过使用这些标记抗体,对异质细胞群进行定量和定性分析,研究免疫细胞的分布、表达和功能。
3.细胞内细胞因子分析:许多蛋白(尤其是细胞因子)的表达调控都与细胞激活有关。自然状态下,T淋巴细胞产生的细胞因子微量且易释放,导致胞内信号弱难检测。通过体外激活刺激细胞因子的表达,同时药物阻断胞内细胞因子的转运,使其在胞内聚集,再利用特异性抗细胞因子抗体,结合针对特定细胞亚群的表面标志物抗体进行多色标记,通过流式即可检测单个细胞内细胞因子的分泌并区分表达特定细胞因子的细胞亚群。
由此可见,从基础的表型鉴定到复杂的功能研究,高质量的流式抗体是实现精准、可靠流式检测的根本保障。
二、抗体的选择
流式抗体的选择是流式技术能否成功应用的关键因素之一,下面介绍如何选择合适的流式抗体。
1、流式抗体本质上还是抗体,需要满足抗体的基本条件(上期干货链接),包括蛋白特异性、种属来源以及应用范围等。
2、确定流式细胞仪的配置
选择抗体的荧光标记时要先了解流式细胞仪的配置参数,确定以下几个信息:
(1) 激光器:仪器具备哪些波长的激光器。选择荧光素激发光谱(Excitation, Ex)与激光器波长相匹配的抗体。
(2) 滤光片:根据荧光素的发射光谱(Emission, Em)选择对应的滤光片通道,仪器的通道数决定一次最多测多少个指标。
3、荧光标记方法
在流式细胞术实验中用于获取读数的荧光团会与抗体偶联。荧光团与一抗进行偶联获得的就是直标抗体,使用未偶联的一抗和荧光团偶联的二抗为间接标记。在流式实验过程中,应尽量减少实验工序和过程,以保证实验的真实和准确性。因此,在条件允许的范围内,建议尽量用直接标记的抗体进行实验。但待测抗原表达丰度低的时候可以考虑选择间接标记抗体放大信号。
4、多色流式检测实验的配色原则
流式细胞实验一般是多指标检测,仪器检测荧光素的时候,可能会被其他荧光素发出的光干扰。为了将干扰降到最低,在选择荧光素时要遵循以下几点原则:
(1) 每个检测通道只能选择1种荧光素,各通道之间的荧光素可以随意搭配。
(2) 尽量减少光谱重叠,否则会导致补偿难调。最常用的4色荧光搭配是:FITC、PE、Percp-cy5.5、APC;五色及以上配色建议查阅文献,或者咨询抗体厂商。
(3) 强弱搭配:即弱表达抗原搭配强荧光染料,强表达抗原搭配弱荧光染料(常用荧光强弱排序:PE>APC>PE-cy5>Percp-cy5.5>FITC)。
(4) 荧光干扰:弱表达抗原放在无干扰通道,强表达抗原放在不干扰其它通道的通道。
(5) 抗原间的相互关系分为三种,分别是互斥关系、共表达关系、子代与亲代的关系。互斥关系是指两种抗原不会同时表达在一种细胞上,互相排斥的抗原允许荧光溢漏,可以使用高干扰的荧光组合。
(6) 共表达关系是指两种抗原同时表达在一种细胞上。共表达抗原要避免荧光溢漏,需要搭配没有相互干扰的荧光染料。
(7) 子代与亲代是指抗原之间是上下级关系,即下级抗原是在上级抗原的基础上进行分析的。配色时,允许子代对亲代有荧光溢漏,但要避免亲代对子代的溢漏。
三、流式细胞术实验流程
1.样本制备
不论组织样本还是细胞样本,一定要重悬制备单细胞悬液,防止细胞抱团。
2.细胞计数
用血球计数板或其他仪器对悬液进行计数后,调整细胞浓度约为1*E7/mL,并使用滤网过滤细胞。(细胞浓度过高或不过滤可能会堵塞流式细胞仪系统并影响分辨率。)
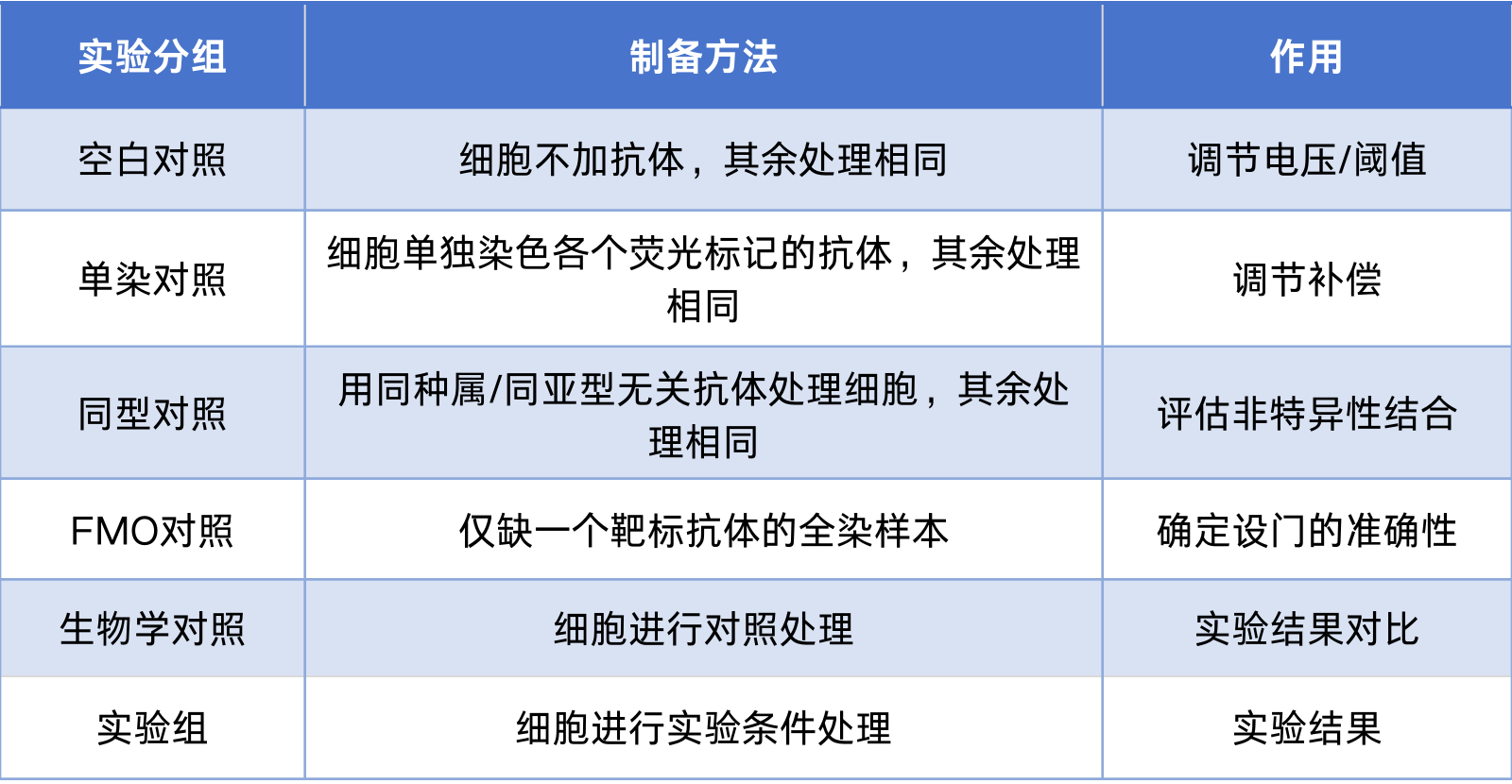
3.设置实验分组
流式实验分组包括空白对照、单染对照、同型对照、FMO对照、生物学对照和实验组。
4.封闭Fc受体(不含Fc受体的细胞样本可跳过此步骤)
封闭FcR能减少染色过程中的非特异性染色。对于小鼠样本,纯化的CD16/CD32单抗能和FcγRⅢ/Ⅱ结合,封闭非特异性染色。对于大鼠样本,可使用过量的与荧光抗体相同来源和亚型的纯化Ig或者相同来源血清进行阻断,或者用商业化的Fc受体阻断剂。对于人样本,纯化的CD16单抗可作为封闭Fc受体的阻断剂。
注:表达Fc受体的细胞包括:B淋巴细胞、树突状细胞、单核细胞、巨噬细胞、NK细胞、中性粒细胞、嗜酸性粒细胞、人血小板、肥大细胞和嗜碱性粒细胞等,其中以单核细胞和巨噬细胞尤为显著。
5.细胞表面染色
(1)按照说明书的推荐用量加入荧光标记的抗体,混匀,4℃避光孵育至少30 min。
(2)加入细胞染色buffer(或含1%BSA的PBS)重悬洗涤细胞,300 g离心5 min,弃上清,重复一次。
(3)上机检测:加入200 μL的细胞染色buffer(或含1%BSA的PBS)重悬细胞,用流式细胞仪进行检测和分析。
6.细胞内细胞因子/细胞核内因子染色
(1)使用对应的固定破膜试剂盒
(2)抗体孵育
a. 用100 μL的1×细胞破膜Buffer重悬细胞,加入相应的抗体,混匀,4℃避光孵育至少30 min。
b. 1×细胞破膜buffer重悬洗涤细胞,300 g离心5 min,弃上清,重复一次。
(3) 上机检测:加入200 μL的细胞染色buffer(或含1%BSA的PBS)重悬细胞,用流式细胞仪进行检测和分析。
注:同一个细胞同时做细胞表面和细胞内的蛋白,建议先做细胞表面染色,再固定、破膜。
四、抗体的使用与保存
1.荧光团在强光照射下容易发生猝灭。因此偶联荧光团的流式抗体应该在4℃、避光条件下保存和使用,不要冷冻。
2.抗体滴定:使用流式抗体时,抗体浓度是最关键的参数。为了达到更好的实验效果,节约宝贵的样本,建议进行抗体滴定,实现最优的信噪比;在多色流式检测实验中,抗体滴定还能为后续的抗体配色方案优化提供重要依据。
五、常见问题及解决方案
1.无染色/弱染色
(1) 抗体贮存和操作不当:抗体应避光保存在2-8℃中,避免反复冻融。
(2) 荧光染料淬灭:荧光抗体和荧光抗体染色后的样本都应该避光保存。
(3) 染色时间和温度不正确:适当调整染色时间和温度。
(4) 分泌性胞内蛋白:流式细胞检测细胞因子、趋化因子和生长因子等分泌性蛋白必须使用阻断剂使其保留在细胞内。
(5) 蛋白的表达水平过低:对于表达水平过低的抗原,染色时使用最亮的荧光染料,或者两步法染色对信号进行放大。
(6) 抗体浓度过低:滴定抗体以确定最佳浓度。
(7) 细胞数量过多:调整细胞密度,确保细胞数量适中,通常应低于1×10^7/mL。
(8) 补偿调节过度:尽量选择发射光谱不重叠的染料;检查补偿设置,确保每种荧光染料的信号正确补偿。
2. 高背景/非特异性染色
(1)自发荧光较高:使用相同刺激条件,但不用任何试剂染色的样本作为细胞自发荧光的对照。
(2)抗体与死细胞结合:染色中使用死活染料对死细胞进行染色并加以区分,避免假阳性。
(3)抗体浓度过高:滴定抗体的用量。
(4)封闭不充分:适当增加封闭剂的浓度或孵育时间。
(5)染色时间太长:根据实验细胞表达,优化抗体浓度和孵育时间。
(6)洗涤不充分:增加染色后的洗涤次数。
(7)补偿调节不足:利用单阳对照和FMO对照为每次实验设定补偿。
3.染色异常情况
(1)分析中包含细胞黏连体或死细胞:单细胞群设门,并使用死活染料,排除黏连体和死细胞。
(2)固定/破膜液影响细胞特性:调整阈值,确保细胞处理阈值范围内。
(3)刺激条件改变细胞特性:使用标志物反圈门识别细胞。

查看更多

查看更多

查看更多

联系我们

返回顶部