查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
甲状腺功能亢进症(Hyperthyroidism),俗称甲亢,是一种因甲状腺激素过度分泌导致的代谢亢进综合征。引起甲亢的病因很多,发病机制也较为复杂,主要包括弥漫性毒性甲状腺肿病(Graves' Disease, GD)、甲状腺结节、甲状腺肿瘤等疾病因素,以及过量摄入含量碘食物或药物等。其中,Graves病是一种自身免疫性甲状腺疾病,为最常见的甲亢病因,约占所有甲亢病例的80%。就发病人群而言,甲亢在女性中的发病率显著高于男性,青年女性易患Graves病,而老年人易患多结节性毒性甲状腺肿。

1.GD的发病机制
GD的确切病因尚未完全阐明,目前普遍认为其核心机制在于甲状腺的自身免疫紊乱,患者血清中存在可与甲状腺组织发生反应的自身抗体,这些抗体对甲状腺功能具有抑制或刺激作用。
在生理状态下,下丘脑分泌促甲状腺激素释放激素(TRH),刺激垂体分泌促甲状腺激素(TSH),TSH与甲状腺滤泡细胞膜表面的TSH受体(TSHR)结合,进而激活下游信号通路,调节甲状腺激素的合成。
而在GD病理状态下,TSHR因结构发生变异被免疫系统识别为自身抗原,激活B淋巴细胞产生致病性抗体——甲状腺刺激抗体(TSAb)。TSAb能够模拟TSH的功能,与TSHR特异性结合后却不被内化降解,从而持续激活受体,最终导致甲状腺激素过度合成与分泌,引发临床甲亢症状。
此外,TSAb还可随血液循环到达眼眶组织,引起眼外肌肿胀、脂肪组织增生及眼眶内压力升高,最终引发格氏眼病(Graves' ophthalmopathy, GO)。
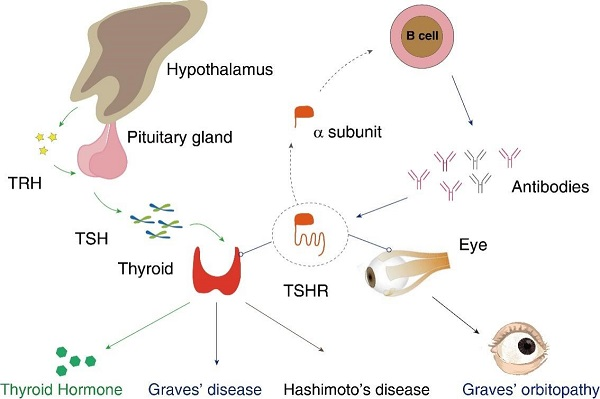
图1. TSHR在体内介导的生理及病理过程[1]
2.促甲状腺激素受体(TSHR)
TSHR是一种位于甲状腺滤泡细胞表面的G蛋白偶联受体,其主要功能是通过结合促甲状腺激素(TSH)激活Gs信号通路,调控甲状腺素(T4)和三碘甲状腺原氨酸(T3)的合成与分泌。

图2. TSHR蛋白结构示意图[2]
3.GD动物造模
目前针对GD的治疗方案仍不完善,缺乏从病因层面实现根治GD的手段,因此建立符合GD发病特征的动物模型,对深入探究其疾病机制及开发新的治疗方法都具有重要意义。研究人员已尝试多种方法构建GD动物模型,包括邝安堃法、小肠耶尔森菌、体内注射 hTSHR cDNA、表达TSHR的重组腺病毒以及应用TSAb转基因动物模型等。其中,采用Ad-TSHR-289重组腺病毒构建的甲亢模型,因其理想的效果,已成为GD研究中被广泛采用的动物造模方法。
该模型最早由美国加州大学研究者[3]建立,他们分别构建了编码TSHR游离A亚基(TSHR-289)、TSHR全长和TSHR-D1NET(仅最小程度的亚基切割)的腺病毒,并比较了其诱导GD的效果。造模过程中,将腺病毒以肌肉注射的方式免疫小鼠,将腺病毒肌肉注射至6-7周龄雌性BALB/c小鼠,病毒用量为10^11 particles,每次注射体积为50ul,共注射三次,每次间隔三周。在第二次注射后1周采集血液样本,并于第三次注射后8周(第一次实验)或4周(第二次实验)对动物实施安乐死,收集血液和甲状腺。
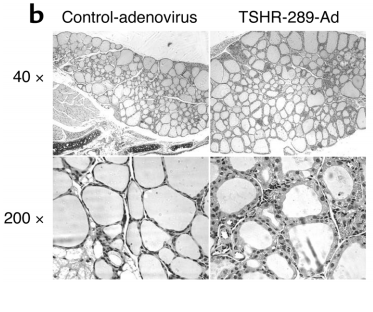
图3. TSHR腺病毒注射小鼠的甲状腺肿和组织学比较[3]
4.客户文献
在《Cytokine》期刊上发表的文章“Circular RNA circPHF16 enhances IL-17A expression and secretion by sequestering miR-378a-3p to activate the IL6ST axis in Graves' disease”中,作者成功构建了GD小鼠模型。
模型构建方法如下:作者采用了汉恒生物提供的重组腺病毒Ad-TSHR-289作为免疫原,通过肌肉注射途径,以每隔3周的频率,共计注射3次腺病毒。单次注射剂量为50 μL,病毒滴度为1 × 10^10 PFU/mL。
样本采集与评估:在末次免疫一周后,对小鼠进行血清和甲状腺组织采集,以便进行全面的血清学指标检测和组织病理学分析。
模型验证结果:组织病理学检查结果显示,GD模型组:甲状腺滤泡出现显著增生,滤泡上皮细胞增殖明显,同时伴有滤泡腔内容物减少以及间质轻度淋巴细胞浸润。正常对照组:未观察到上述任何病理改变。
这些典型的GD病理特征表明,该研究成功建立了GD小鼠模型。
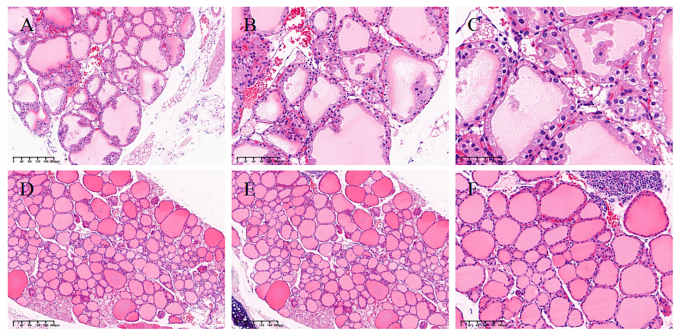
图4. GD小鼠模型的表征[4]
5.汉恒生物Ad-TSHR现货
汉恒生物提供人源TSHR基因腺病毒现货,产品经严格质控,高滴度保障,能高效模拟甲状腺自身免疫应答,助您快速、可靠地建立甲亢动物模型,极大缩短实验周期,为GD病等自身免疫机制研究与药物筛选提供强大工具。欢迎各位老师同学来电咨询,热线:400-092-0065。
参考文献:
1.Duan, J., Xu, P., Luan, X., Ji, Y., He, X., Song, N., Yuan, Q., Jin, Y., Cheng, X., Jiang, H., Zheng, J., Zhang, S., Jiang, Y., & Xu, H. E. (2022). Hormone- and antibody-mediated activation of the thyrotropin receptor. Nature, 609(7928), 854–859.
2.Rapoport, B., & McLachlan, S. M. (2016). TSH Receptor Cleavage Into Subunits and Shedding of the A-Subunit; A Molecular and Clinical Perspective. Endocrine reviews, 37(2), 114–134.
3.Chen, C. R., Pichurin, P., Nagayama, Y., Latrofa, F., Rapoport, B., & McLachlan, S. M. (2003). The thyrotropin receptor autoantigen in Graves disease is the culprit as well as the victim. The Journal of clinical investigation, 111(12), 1897–1904.
4.Jiang, Z., Huang, L., Cai, H., Bo, L., Chen, L., Yang, X., & Huang, H. (2024). Circular RNA circPHF16 enhances IL-17A expression and secretion by sequestering miR-378a-3p to activate the IL6ST axis in Graves' disease. Cytokine, 181, 156681.

查看更多

查看更多

查看更多

联系我们

返回顶部