查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上期为大家介绍了甲亢以及甲亢的造模方法,本期我们将系统介绍T细胞的特异性基因调控策略,主要从T细胞的简介、T细胞的分类、体外T细胞的感染、体内特异性靶向T细胞感染的载体、体内特异性靶向T细胞感染的注射方式和剂量等五个方面展开分享。

一、T细胞的简介
T细胞,全称T淋巴细胞,是一种特殊类型的白细胞,在外周血中约占淋巴细胞总数的65% ~ 75%,由来源于骨髓的造血干细胞在胸腺中分化并发育成熟后,通过淋巴和血液循环而分布到全身的器官和组织中发挥免疫功能,T细胞是适应性免疫系统中的关键组成部分。T细胞具有独特的表面受体,被称为T细胞受体(T cell receptor,TCR),常以异二聚体的形式存在(90%以上的TCR由α链和β链组成,约5%的TCR由γ链和δ链组成),它能够特异性识别抗原并介导免疫反应,在调节 T 细胞迁移、分化和成熟方面起着决定性作用,由于 TCR 的胞外段非常短,无法自行完成信号传导,因此 TCR 需要一个辅助分子,而 CD3(Cluster of Differentiation 3)即承担了这一角色,CD3是T细胞膜上重要的生物标志物,由四个蛋白链亚基(CD3γ、CD3δ、CD3ε和CD3δ)组成,CD3通过非共价键与 TCR 结合形成 TCR-CD3 复合物,TCR-CD3 复合物是 T 细胞特异性识别抗原并传导信号的分子基础[1]。
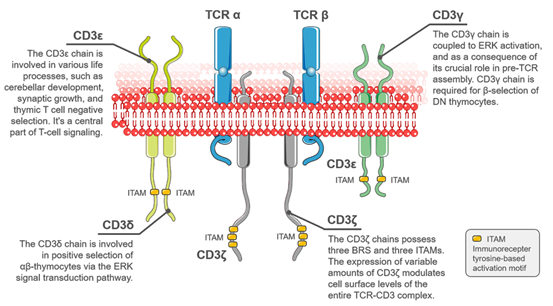
图1. T细胞的表面的TCR-CD3复合物[1]
二、T细胞的分类
① 根据表面CD分子的不同,T细胞可以分为:
CD4+ T细胞:细胞表面标志性分子为CD4,占总T细胞的60% ~ 70%,识别MHC II类分子呈递的抗原,这些细胞活化后通过分泌细胞因子,调动其他免疫细胞,如B细胞、巨噬细胞和树突状细胞,帮助协调和放大免疫反应。
CD8+ T细胞:细胞表面标志性分子为CD8,占总T细胞的30%~40%,识别MHC I类分子呈递的抗原,激活后变身为细胞毒性T细胞,释放穿孔素、颗粒酶等直接杀死被病毒或细菌感染的细胞、肿瘤细胞。
② 根据表达的TCR类型不同,T细胞可分为:
αβ T细胞:占总T细胞的95%-99%,表面表达的TCR由α链和β链组成,能特异性识别由MHC分子(通常为MHC I或II类分子)呈递的肽抗原,因此核心作用是介导抗原特异性免疫应答。广泛分布于血液、淋巴结、脾脏及其他淋巴组织,在抗感染、抗肿瘤及免疫调节等过程中发挥中枢作用。
γδ T 细胞:仅占T细胞总数的1%-5%,表面表达的TCR由γ链和δ链组成。γδ T细胞对抗原的识别方式多样,不依赖MHC分子,能对多种应激刺激产生快速反应,在感染防御、组织修复和炎症反应中具有重要作用。其优势在于非特异性、早期应答,γδ T细胞弥补了αβ T细胞激活前的防御空白。它们主要分布在皮肤、肠道、呼吸道等上皮及黏膜组织,是机体固有免疫系统的重要组成部分。
③ 按激活状态分类,T细胞可分为:
辅助性T细胞(Helper T cell,Th):属于CD4+ T细胞亚群,是调节免疫应答的关键细胞。根据所分泌细胞因子的不同,主要分为Th1、Th2、Th17、Tfh等。Th1主导细胞免疫,促进巨噬细胞活化;Th2 促进B细胞产生抗体,主导体液免疫;Th17参与黏膜防御和炎症调节;Tfh帮助B细胞在淋巴器官形成生发中心。辅助性T细胞的平衡失调常与过敏和自身免疫疾病等相关。
细胞毒性T细胞(Cytotoxic T cell,CTL):大多属于CD8+ T细胞,激活后通过分泌穿孔素、颗粒酶等方式直接杀伤受感染细胞或肿瘤细胞。其激活需要抗原递呈细胞(APC)和多种细胞因子的协助。CTL同时具有记忆功能,为宿主再次遭遇同一病原体时提供快速应答。
调节性 T 细胞(Regulatory T cell,Treg):调节性T细胞一般为 CD4+ CD25+ Foxp3+表型,主要分泌IL-10、TGF-β等免疫抑制因子,抑制过度免疫反应,维护免疫耐受、减少自身免疫病发生。Treg细胞也参与器官移植的免疫耐受和肿瘤微环境的免疫抑制,是当前免疫治疗的重点研究对象之一。
④ 按免疫功能分类,T细胞可分为:
初始 T 细胞(Naive T cell):在胸腺内完成分化、离开胸腺进入外周免疫器官、尚未遇到抗原刺激的成熟 T 细胞。初始 T 细胞处于细胞周期G0期、代谢低,易于在血液与淋巴系统中循环。当机体首次遭遇特定抗原时,这些细胞能迅速激活和增殖,并根据外部刺激分化为效应 T 细胞或记忆 T 细胞。
效应 T 细胞(Effector T cell):来自初始 T 细胞,经抗原激活和分化。活化后脱离淋巴器官、迁移到炎症或感染部位,这类细胞能在短时间内大量产生免疫因子、执行免疫防御,免疫反应后大多数效应 T 细胞凋亡,仅有极少数转化为记忆 T 细胞。
记忆 T 细胞(Memory T cell):在免疫反应后期由存活下来的效应 T 细胞分化形成,具有长期存活、自我复制和快速应答二次抗原刺激的能力。根据表面分子CCR7的不同,分为中央记忆 T 细胞(Tcm,CCR7+,主要分布在二级淋巴器官,对抗原二次识别时能迅速扩增)和效应型记忆 T 细胞(Tem,CCR7-,多见于外周组织,可迅速产生效应分子)。记忆 T 细胞能维持数年甚至更久,对二次感染提供快速、增强的免疫保护。
由于T细胞疗法技术的日渐成熟,针对T细胞体内外感染的研究文献逐年增多。体外T细胞的感染主要是针对上述CD4+T细胞和CD8+T细胞仅进行体外相关实验的研究,而体内T细胞的研究主要是通过靶向AAV载体对T细胞进行特异性感染的方式,但也允许体内提取的T细胞在体外通过基因编辑等技术进行治疗,随后回输至动物体内实现精准的靶向疗法等操作。那么我们就一起来了解下T细胞体内外感染的操作方法及使用案例。
三、体外T细胞的感染
汉恒生物适用于原代 T 细胞感染的病毒产品包括T 细胞专用慢病毒、逆转录病毒和悬浮细胞专用腺病毒。其中慢病毒和逆转录病毒可以用来构建稳转细胞系,悬浮细胞专用腺病毒适用于瞬转实验。那我们就来了解下体外T细胞的感染步骤以及汉恒客户的T细胞感染使用案例:
(1)体外T细胞的感染步骤
① T细胞激活培养48 h后,离心换新鲜T细胞完全培养基,若考虑长期表达目的基因,可按MOI=50-100摸索最适值并加入慢病毒或逆转录病毒,加入病毒后轻轻吹打混匀;若考虑瞬时(一周以内)表达目的基因,可按 MOI=500-1500摸索最适值并加入汉恒悬浮细胞专用腺病毒。进行病毒感染操作时,可选择同时加入适宜浓度的polybrene(polybrene常规使用浓度为1-10 μg/mL)。
注:具体 MOI 选择可在 96 孔板中预实验进行梯度摸索,对于慢病毒建议使用 10,30,50,100的梯度进行,对于腺病毒建议使用500,1000,1500的梯度进行摸索。
② 置于平板离心机离心60 ~ 90 min,转速1000 g左右(如细胞敏感可以降低转速至200 ~ 300 g,如细胞不敏感最高可升至1200 g)。离心结束后将平板放入37 ℃培养箱感染 4 ~ 24 h(敏感细胞可尽早换液)。注:离心结束观察细胞分散状态,除非细胞全聚集在一处,否则不建议吹散细胞。
③ 感染结束后取出培养板,吸弃含病毒液的培养基,加入T细胞完全培养基。
④ 将细胞放入培养箱中继续培养,如病毒带荧光基因,可在病毒感染48 h后观察荧光,观察病毒感染效率。
案例1. 慢病毒感染小鼠CD8+ T细胞
文献标题:CDK4/6 Inhibitor Priming Enhances PD-1 Blockade via Sellhi Neutrophil-Induced Stat5a+ Progenitor Exhausted CD8+ T Cell
发表杂志:《Advanced Science》(IF=14.1)
病毒种类:HBLV-CMV-mStat5a-3flag-EF1-T2A-Puro
使用方法:将慢病毒采用离心感染法(900 g,25 ℃,3 h)转导CD8+ T细胞,polybrene的使用浓度为10 μg/mL。
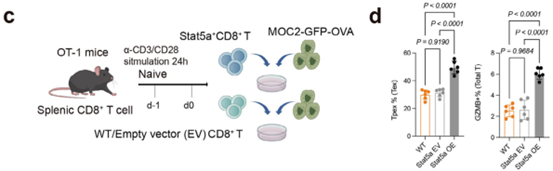
图2. 慢病毒感染CD8+ T细胞[2]
案例2. 悬浮细胞专用腺病毒感染小鼠 T 细胞
文献标题:Engineered peripheral CD4 T cells delivery across the BBB promote intracerebral Treg conversion unleashes microglial phagocytotic activity for Alzheimer's disease treatment.
发表杂志:《Biomaterials》(IF=12.9)
病毒种类:悬浮细胞专用腺病毒
使用方法:将CD4+T细胞与5 μg/mL polybrene在24孔板中共培养30 min,然后加入腺病毒(MOI= 500),培养6 h。随后,对T细胞进行洗涤,并继续用腺病毒感染24 h,最后收集细胞用于后续检测。

图3. 悬浮细胞专用腺病毒感染小鼠T细胞[3]
四、体内特异性靶向T细胞感染的载体
T细胞在免疫治疗以及药物靶向递送方面的潜力巨大,已逐渐成为研发的热点,而腺相关病毒(adeno-associated virus,AAV)因为安全性高、宿主范围广、靶向性强作为基因递送的工具被广泛使用,但早期AAV血清型对T细胞的特异性转导效率较低,限制了应用。2023年,Nyberg等人通过结构引导进化的方法,针对AAV6进行突变筛选,最终获得了Ark313这一新型AAV血清型[4],研究发现Ark313能够有效靶向循环T细胞、脾脏T细胞和组织驻留T细胞[5],在脾脏T细胞中可以实现高达10.2%的转导效率,并且对比了AAV5、AAV6与Ark313的转导效率,结果显示,仅Ark313在脾脏CD4+ T细胞和CD8+ T细胞中实现了大于10%的转导效率[5]。
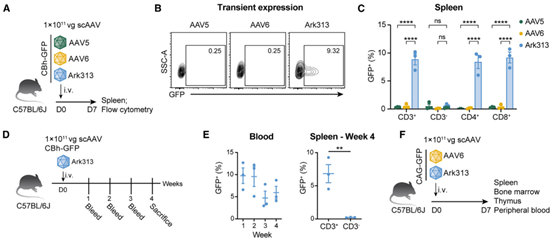
图4. Ark313血清型在体内可以有效转导T细胞[5]
2024年,南京医科大学周文斌、王水等人使用AAV-Ark313血清型并结合DIO系统成功敲低了CD8a-Cre小鼠的CD8+T细胞中的STAT1基因的表达,证实了STAT1在联合疗法中调控T细胞记忆分化的关键作用[6],该研究团队使用的AAV-Ark313由汉恒生物提供。

图5. CD8a-cre小鼠注射AAV-Ark313感染CD8+T细胞[6]
五、体内特异性靶向T细胞感染的注射方式和剂量
由于T细胞分布范围广,更适合用系统性注射的方式感染体内T细胞,上文提到的Nyberg等人就是用静脉注射的方式感染小鼠体内T细胞,以及南京医科大学周文斌、王水等人也是用静脉注射(用量:200μl)的方式感染小鼠体内的CD8+ T细胞。也可采取体外分离感染T细胞后再回输体内的方式进行靶向治疗,Sidi Chen等人从Cas9转基因小鼠的脾脏和淋巴结肿瘤中分离了原代CD8+ T细胞,并使用AAV6介导的sgRNA病毒库感染激活的CD8+ T细胞,之后通过尾静脉注射将这些CD8+ T细胞回输到小鼠体内再进行后续研究[7]。
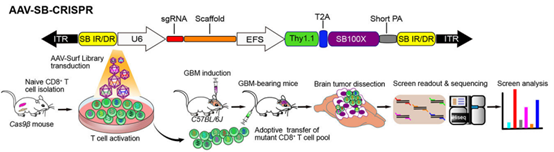
图6. CD8+ T的体外分离感染并回输[7]
综上所述,相信大家对T细胞的基因调控方式有了一个初步了解,除本文介绍的慢病毒、悬浮细胞专用腺病毒和AAV-Ark313外,汉恒生物还研发了靶向神经、肌肉、肾脏、肝脏、视网膜、胰腺等组织器官的AAV特异性启动子和特异性血清型,使用合适的血清型和特异性启动子,可对不同组织、器官进行高效靶向感染,欢迎各位老师咨询,下期我们将介绍对内皮细胞的特异性基因调控策略,请小伙伴们继续关注哦!
参考文献:
[1] Liu DY,Hu XX,Chen ZY,Wei W,Wu YJ. Key links in the physiological regulation of the immune system and disease induction:T cell receptor-CD3 complex. Biochem Pharmacol.2024 Sep:227:116441.doi: 10.1016/j.bcp.2024.116441.
[2] Zhang Y,Sun B,Zhou R.et al.CDK4/6 Inhibitor Priming Enhances PD-1 Blockade via Sellhi Neutrophil-Induced Stat5a+ Progenitor Exhausted CD8+ T Cell.Adv Sci.2025 Sep 11:e10501.doi: 10.1002/advs.202510501.
[3] Zuo ZJ,Xiao ZC,Zhang LY.et al.Engineered peripheral CD4 T cells delivery across the BBB promote intracerebral Treg conversion unleashes microglial phagocytotic activity for Alzheimer's disease treatment.Biomaterials.2026 Feb:325:123574.doi: 10.1016/j.biomaterials.2025.123574.
[4] William A Nyberg, Jonathan Ark, Angela To.et al. An evolved AAV variant enables efficient genetic engineering of murine T cells. Cell. 2023 Jan 12; 186(2): 446–460.e19. doi: 10.1016/j.cell. 2022.12.022.
[5] William A Nyberg, Charlotte H Wang, Jonathan Ark.et al. In vivo engineering of murine T cells using the evolved adeno-associated virus variant Ark313. Immunity.2025 Feb 11;58(2):499-512.e7.doi: 10.1016/j.immuni.2025.01.009.
[6] Tang XY,Mao XR,Ling PW.et al. Glycolysis inhibition induces anti-tumor central memory CD8+T cell differentiation upon combination with microwave ablation therapy. Nat Commun.2024 May 31;15(1):4665.doi: 10.1038/s41467-024-49059-6.
[7] Lupeng Ye,Jonathan J Park, Matthew B Dong.et al.In vivo CRISPR screening in CD8 T cells with AAV-Sleeping Beauty hybrid vectors identifies membrane targets for improving immunotherapy for glioblastoma. Nat Biotechnol.2019 Nov;37(11):1302-1313.doi: 10.1038/s41587-019-0246-4.

查看更多

查看更多

查看更多

联系我们

返回顶部