查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
药物性肝损伤(DILI)指在药物使用过程中,因药物本身或/及其代谢产物或由于特殊体质对药物的超敏感性或耐受性降低所导致的肝脏损伤,占非病毒性肝病中的20%-50%,是急性肝衰竭(ALF)的最常见原因,而对乙酰氨基酚(APAP)过量是药物性ALF的主要原因。
Mas是调节性RAS的效应受体,在组织内广泛表达,有研究显示Mas在损伤、炎症及代谢中占据重要地位,激活Mas具有减轻损伤、抗炎、改善脂代谢紊乱等有益作用。
近日,同济大学杨长青教授团队在《Journal of Hepatology》(IF=30.083)发表文章“Hepatocyte-specific Mas activation enhances lipophagy and fatty acid oxidation to protect against acetaminophen-induced hepatotoxicity in mice(肝细胞特异性Mas激活增强噬脂和脂肪酸氧化以保护小鼠对抗对乙酰氨基酚诱导的肝毒性)”该团队提出肝细胞Mas基因的激活增强了AKT-FOXO1信号通路调控的脂噬和下游脂肪酸氧化(FAO),可以保护小鼠免受APAP诱导的肝毒性,Mas可能是DILI的一个新的治疗靶点。值得一提的是,在该研究中使用了汉恒生物的AAV2/8来抑制Mas基因的表达,以此研究Mas基因在肝内的作用。
首先,作者通过比较人类DILI组和健康组的Mas基因水平,发现DILI组肝内Mas明显上调,接着利用APAP刺激人类和小鼠肝细胞,发现肝细胞中的Mas mRNA同样显著上调(图1),因此,作者得出结论:Mas可能在DILI进程中发挥重要作用。
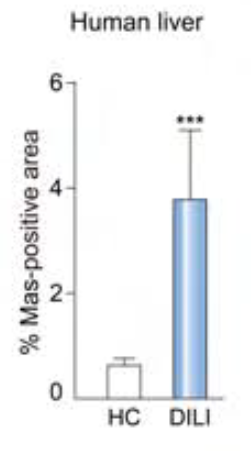
图1. Mas的表达水平
为了证实这一结论,作者敲除肝细胞中的Mas1基因后使用APAP刺激小鼠,通过肝细胞死亡和炎症浸润的组织学评估(图2A)和测定血清丙氨酸氨基转移酶(ALT)水平(图2B),发现肝损伤显著加重,当使用致死量的APAP刺激小鼠时,小鼠的存活率明显降低(图2C)。
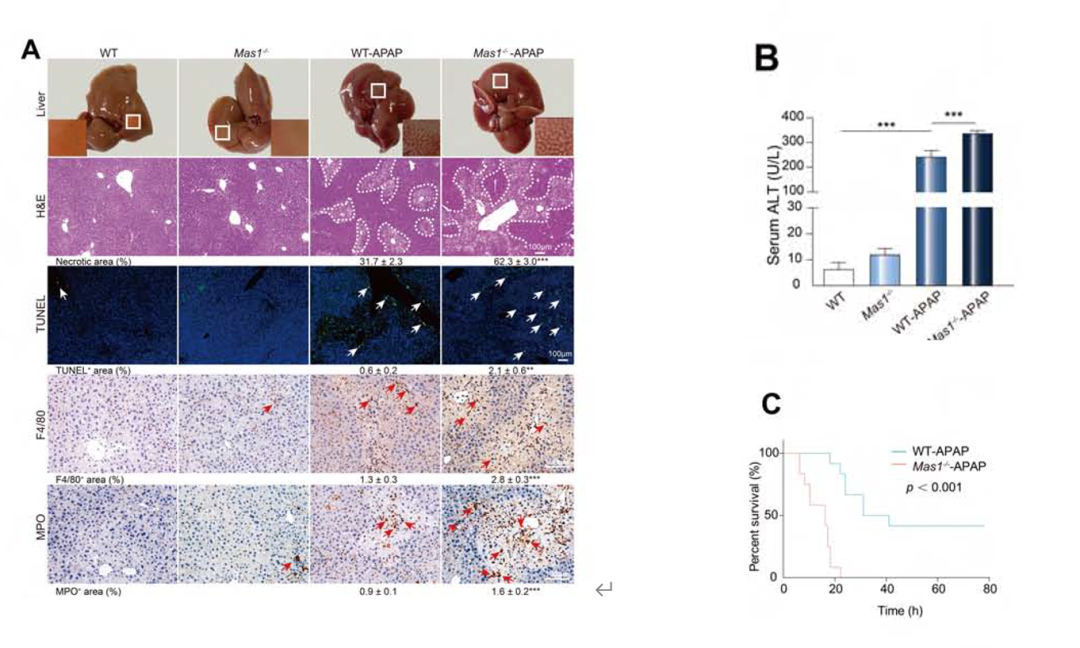
图2.Mas基因敲除实验
另外,作者还使用了AVE0991(Mas活化剂)进一步实验,组织学和生化评估结果表明,预给药AVE0991对使用过量APAP刺激的小鼠有保护作用(图3A和B),显著提高了WT-APAP小鼠的存活率(图3C)。
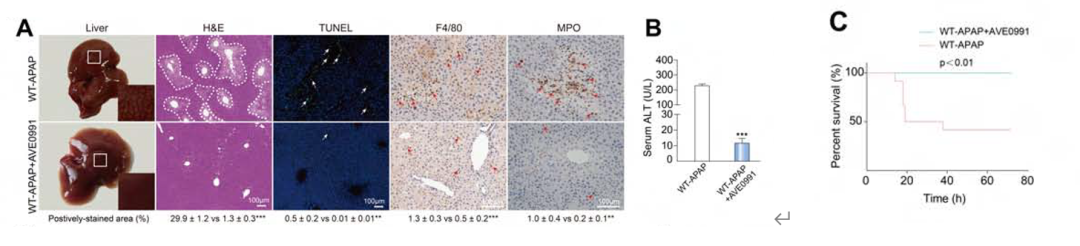
图3. AVE0991对WT-APAP小鼠的保护作用
以上实验证明Mas在DILI进程中发挥了重要作用,敲除Mas导致肝损伤加重,而激活Mas则可以减轻肝损伤,那么Mas是如何发挥作用的呢?作者猜想Mas是通过影响AKT-FOXO1轴进而调节脂噬和脂肪酸降解最终在肝损伤进程中发挥作用。
脂噬是一种特殊类型的自噬,指脂滴被自噬小体吞噬后,自噬小体与溶酶体融合,脂滴内的甘油三酯(TAG)被溶酶体内的酸性脂肪酶水解的过程。水解产生的游离脂肪酸(FFA)通过脂肪酸氧化(FAO),被氧化分解生成二氧化碳和水,并释放出大量能量供机体利用。
为了验证这一猜想,作者通过Western Blot、电镜、免疫荧光检测和生化评估等实验来检测Mas1缺失的转基因小鼠(Mas1-/-)和野生型小鼠(WT)被APAP刺激后的差异。首先,作者分析了自噬过程中相应标志物的蛋白表达,Western Blot结果显示Mas1-/- APAP小鼠自噬、脂解和FAO受损,AKT增强和FOXO1信号通路受到抑制(图4E)。另外,透射电子显微镜(TEM)检测到Mas1-/- APAP小鼠自噬液泡(AVs)数量显著减少(图4F和G)。免疫荧光检测显示Mas1-/- APAP小鼠LDs显著累积(BODIPY阳性点),同时脂噬(BODIPY/LAMP1共定位)和脂解(BODIPY/ATGL共定位)减少(图4H-J)。在生化评估实验中(图4K)观察到Mas1-/- APAP细胞中TG水平的显著升高。以上实验结果均表明Mas1-/- APAP小鼠自噬和FAO受损。
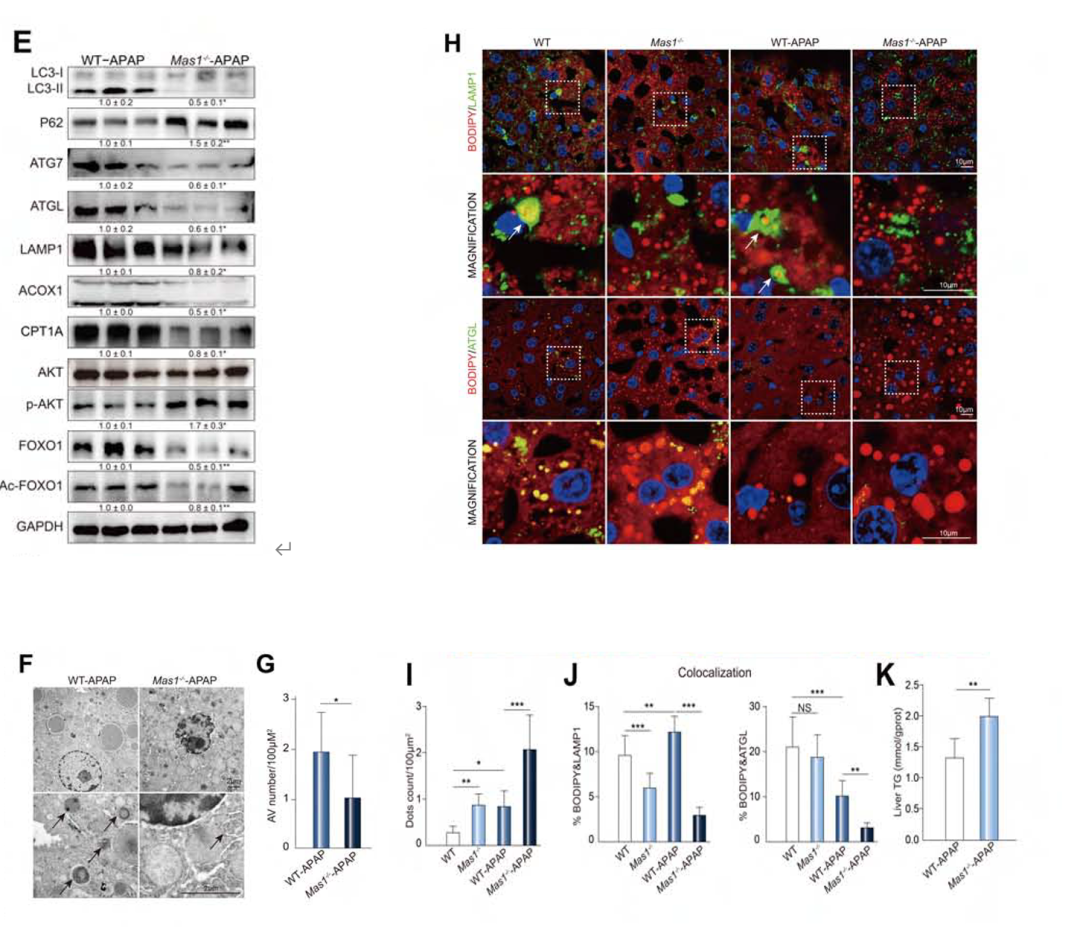
图4.Mas1缺失实验结果
除此之外,作者还发现给WT-APAP小鼠使用AVE0991后,自噬(TEM,图5F)和脂噬(免疫荧光,图5G)显著上调,并伴有标记物的蛋白表达(WB,图5H),表明自噬、脂噬和FAO恢复,AKT被抑制,FOXO1信号通路增强。
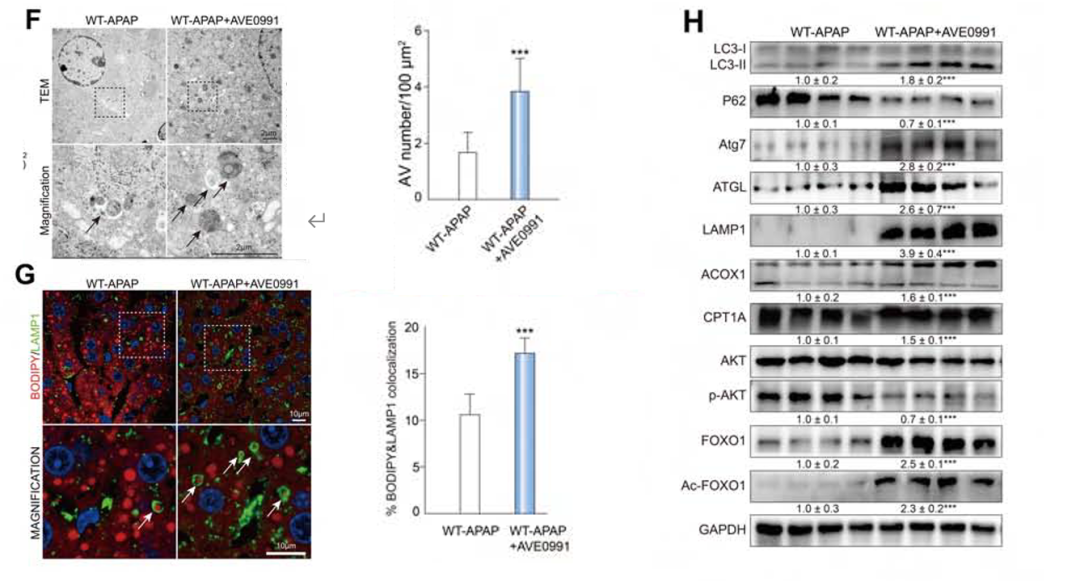
图5.Mas激动剂(AVE0991)实验结果
以上实验均说明,Mas可能是通过影响AKT和FOXO1信号通路在DILI进程中发挥作用。为了进一步验证作用机制的猜想,作者进行了多组学研究。转录组学中,与WT-APAP小鼠相比,WT-APAP+AVE0991小鼠脂肪酸降解和自噬途径增强,脂滴途径被抑制(图6 I)。代谢组学中,使用AVE0991后,小鼠体内的一种与自噬密切相关的磷脂——磷脂酰乙醇胺(PE)水平升高(图6J)。靶向组学中,通过量化肝内TAG、DAG、FFA和PE含量(图6K和L),作者发现AVE0991可能会增强TAG的降解,释放FFA用于后续的FAO。为了获得AVE0991诱导的FAO调节的更直接证据,作者通过[U-13C]-棕榈酸盐转化为13c标记的酰基肉碱和乙酰辅酶a来确定脂肪酸的代谢通量(图6M)。数据显示,棕榈酰肉碱(C16)、肉豆蔻酰肉碱(C14)、桂酰肉碱(C12)和乙酰辅酶a的肝内丰度显著增强(图6N-P),说明AVE0991显著增加了脂肪酸的体内周转。
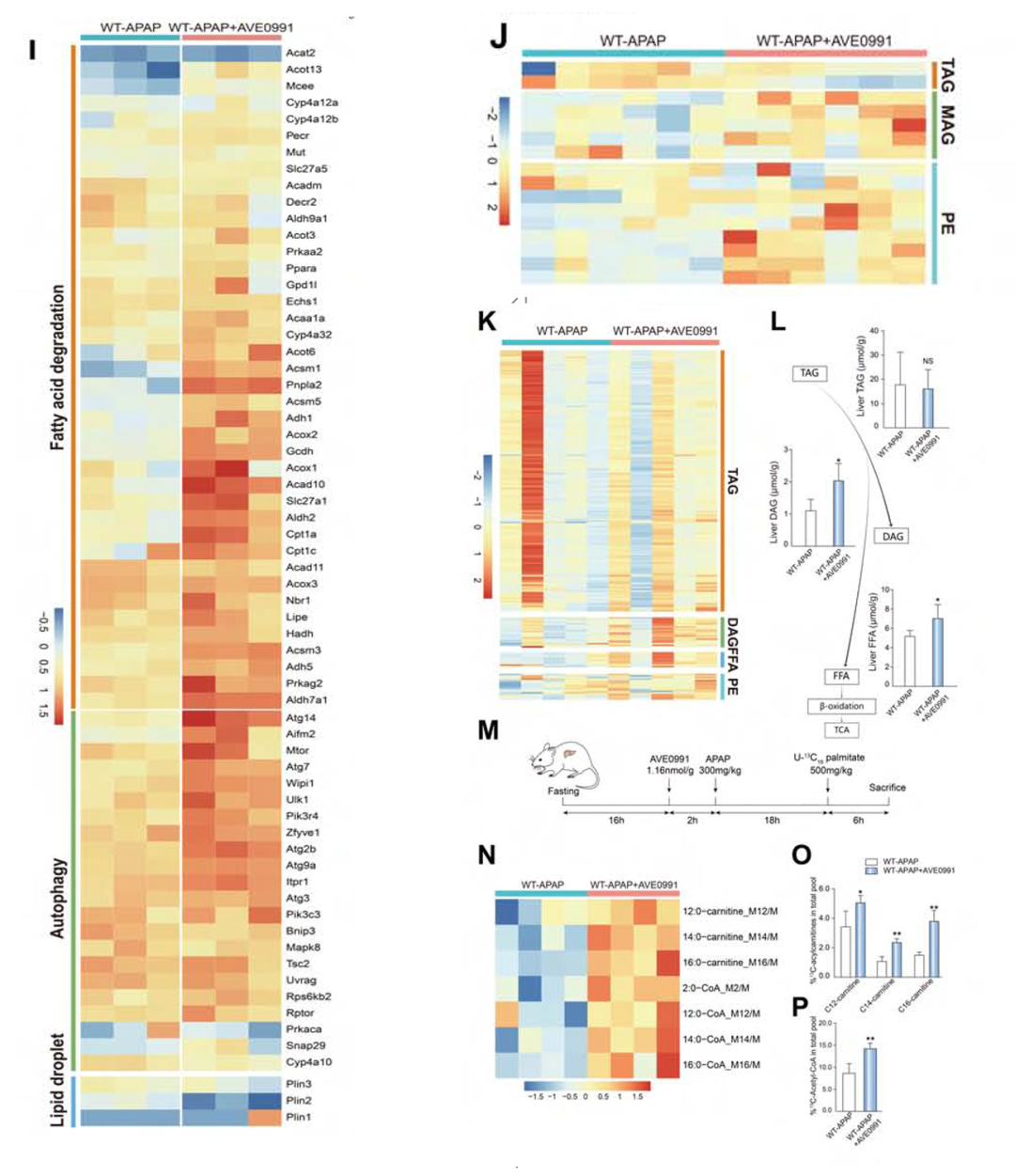
图6.多组学实验结果
为了进一步验证脂噬和脂肪酸氧化是Mas的下游效应环节,作者给WT-APAP+AVE0991小鼠使用雷帕霉素(自噬激动剂)、非诺贝特(脂肪酸氧化激动剂)、lanifibranor(脂肪酸氧化激动剂)进行实验,结果这些药物显著减轻了APAP诱导的肝损伤(图7A,B)。而使用FAO的拮抗剂乙莫克舍后,小鼠的肝损伤显著加重(图7C,D)。
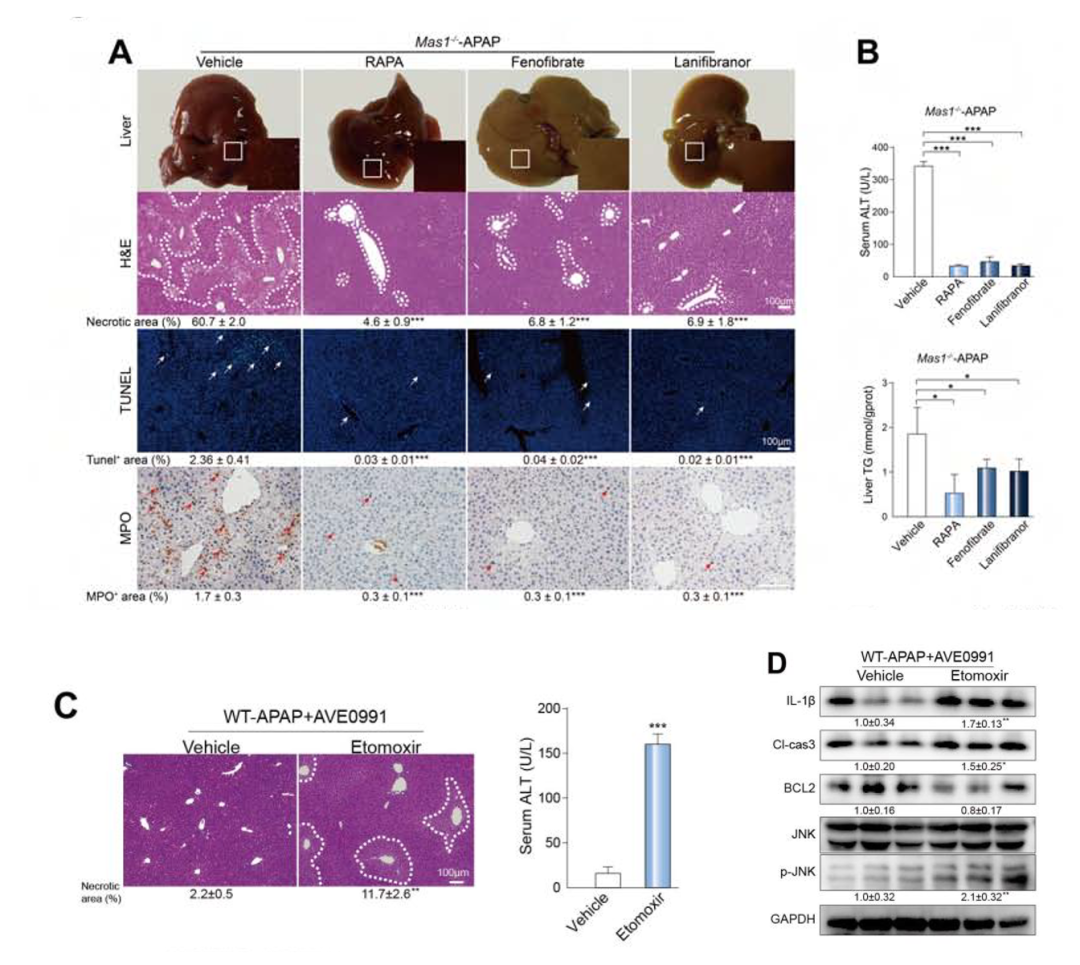
图7.药物实验结果
作者通过给小鼠使用哌立福辛 (p-AKT的抑制剂)、AS1842856 (FOXO1的抑制剂)和去乙酰化酶(去乙酰化酶的抑制剂)来分析AKT和FOXO1的作用。在Mas1-/- APAP小鼠中,哌立福辛显著减轻了肝毒性和TG积累,增加了FOXO1总蛋白表达,增强了自噬、脂噬和FAO(图8A-C)。在WT-APAP小鼠中,AS1842856显著降低了AVE0991的作用,并抑制了自噬、脂噬和FAO(图8D-F)。相比之下,去乙酰化酶显著逆转了Mas1-/- APAP小鼠的疾病表型,激活的FOXO1蛋白水平增加,自噬、脂解和FAO增强(图8G-I)。此外,BODIPY/LAMP1的共定位证实了去乙酰化酶增强的脂噬作用(图8J)。以上实验结果表明,APAP刺激后,Mas可能通过AKT和FOXO1信号通路调节脂噬和FAO。
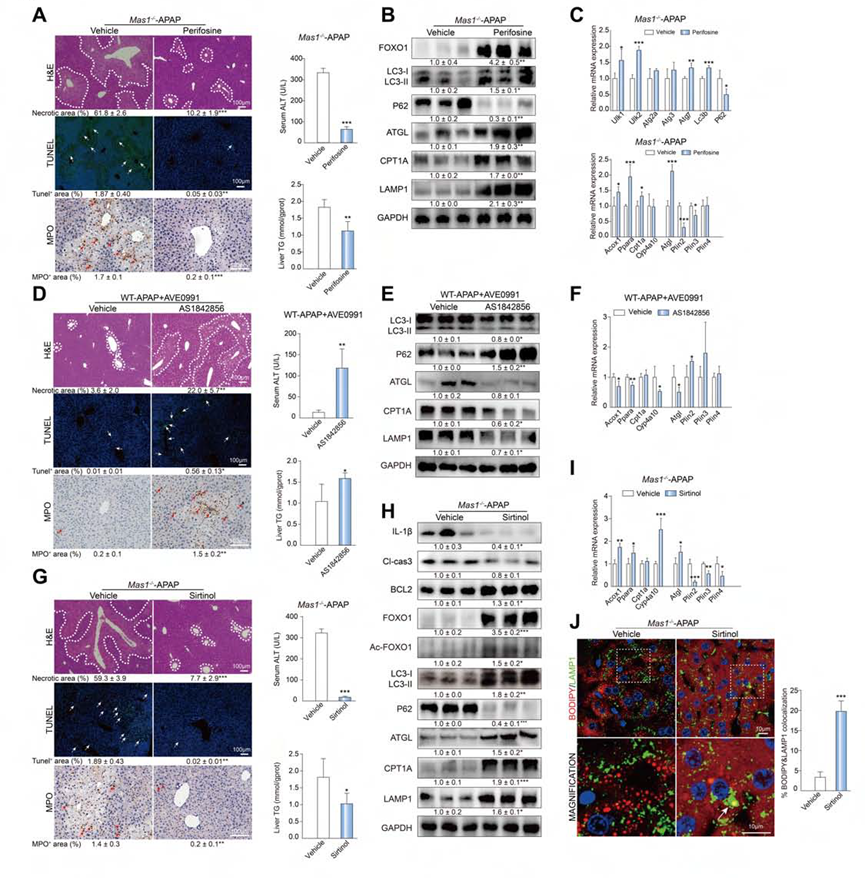
图8.抑制剂实验结果
值得一提的是,作者使用了汉恒生物的携带Sh-Mas1的AAV2/8来抑制Mas基因的表达,观察Mas基因在使用过量APAP刺激的小鼠(WT-Sh-Mas1)肝内和肝细胞中的作用,同时设置肝细胞特异性Mas1敲除(AlbcreMas1f/f)小鼠进行研究。结果显示WT-Sh-Mas1(图9A-E)和AlbcreMas1f/f(图9F-I)肝毒性加重,脂噬和FAO受损,说明抑制肝细胞Mas表达或敲除Mas会抑制脂噬及FAO,加重肝损伤及炎症。
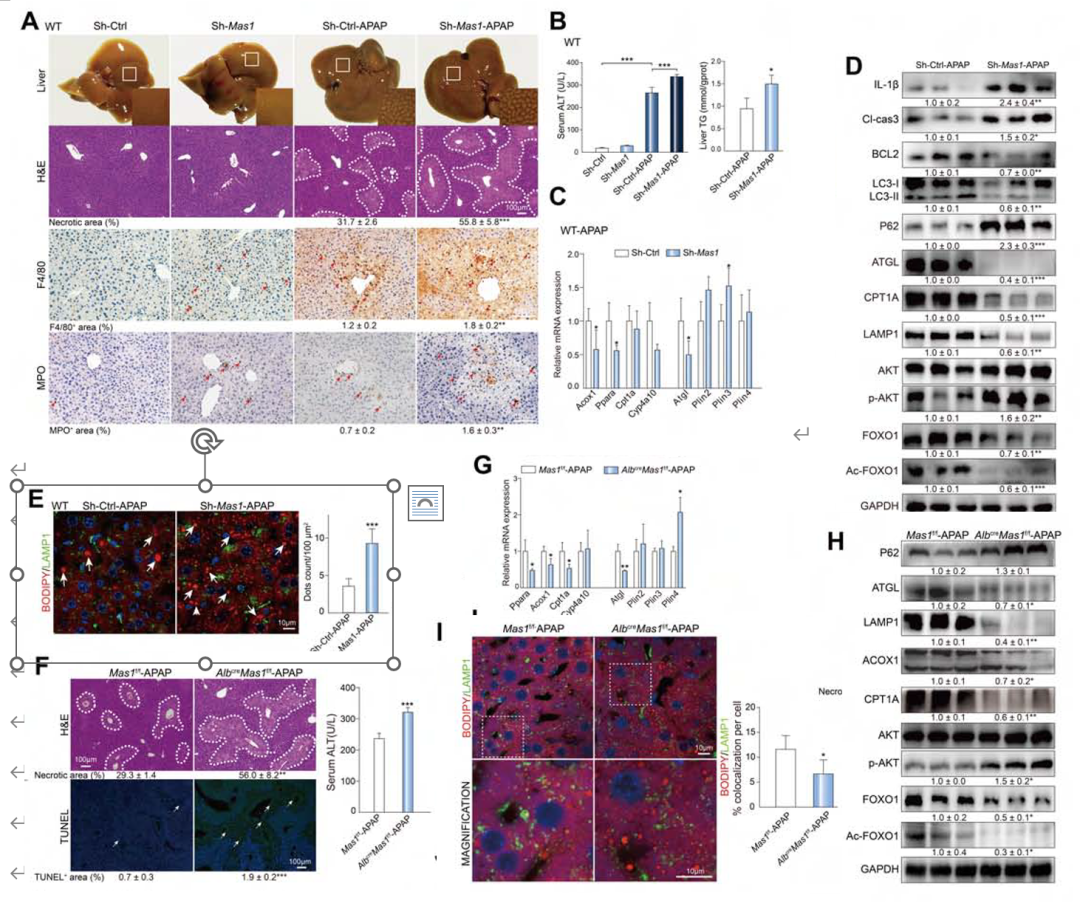
图9.Mas1缺失/敲除实验结果
为了确定AKT和FOXO1的作用,作者设计了siAkt(图10A-I)和siFoxo1(图10J-P),以此在体外下调小鼠肝细胞中Mas信号相关基因的表达。从Mas1-/-小鼠获得的原代肝细胞中,siAkt显著诱导了指示标记物的蛋白表达,这表明APAP攻毒期间FOXO1信号通路被激活,自噬、脂解和FAO增强(图10A)。说明siAkt显著增加自噬、脂噬和FAO活性。相反,在WT小鼠获得的原代肝细胞中,siFox 1大大降低了APAP攻毒期间AVE0991增强的脂噬和FAO(图10J-P)。综上所述,在APAP攻毒中,Mas激活通过抑制AKT信号通路和激活FOXO1信号通路来增强肝细胞的脂噬和FAO。
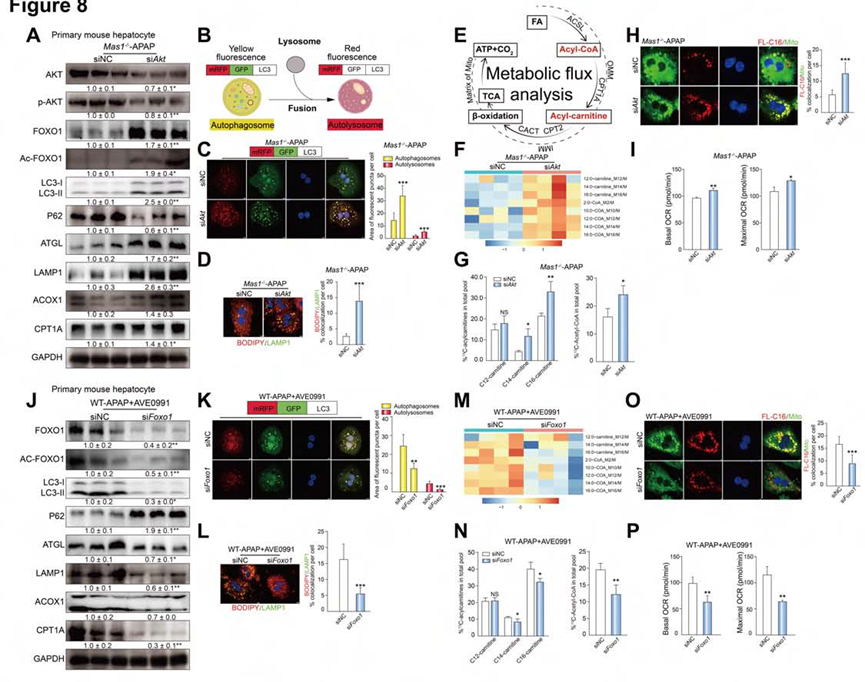
图10. siAkt和siFoxo1实验结果
在明确了Mas在DILI进程中作用机制的基础上,作者就Mas在APAP诱导的小鼠肝毒性中的治疗作用进行了研究。通过在APAP攻毒后的不同时间点给药AVE0991,结果显示攻毒2h后,AVE0991基本上恢复了受损的自噬和脂肪酸降解(图11K, L),对比WT-APAP小鼠,使用AVE0991的小鼠存活率上升。但在攻毒24h后,AVE0991 对肝修复的影响不显著,攻毒48h后,AVE0991仍未能在WT-APAP小鼠中显示出保护作用。该实验说明Mas在一定程度上可以保护小鼠免受APAP诱导的肝毒性,但其治疗方法仍需进一步实验测试。
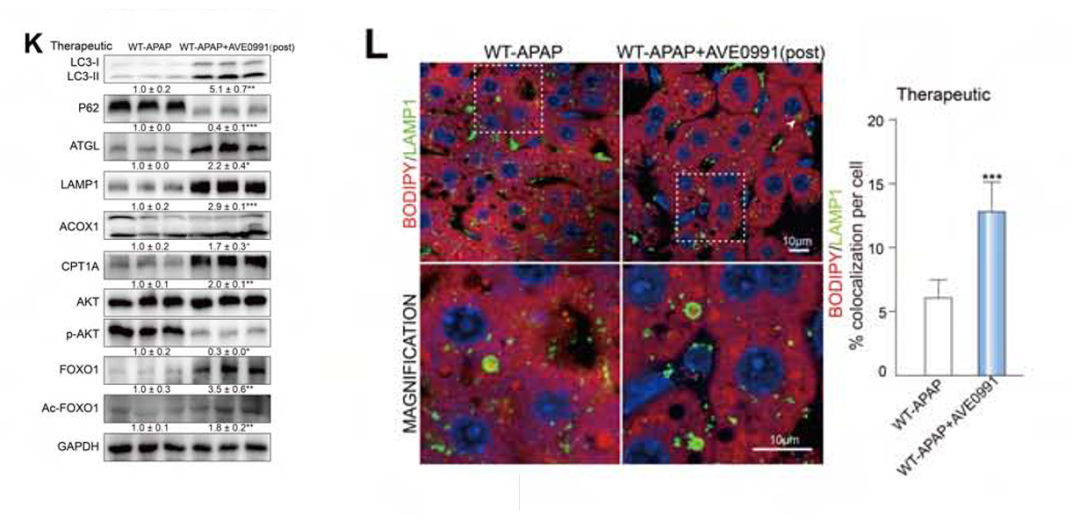
图11.APAP攻毒实验结果
综上,该研究阐明了Mas在DILI中的作用,肝细胞Mas敲除或缺失会下调AKT-FOXO1信号通路从而抑制脂噬以及下游脂肪酸氧化,进而加重肝损伤及验证;相反,激活肝细胞中的Mas基因,则会上调AKT-FOXO1轴,脂噬以及下游脂肪酸氧化,减轻肝损伤及炎症。因此,Mas有望成为DILI的一个新的治疗靶点。
查看更多

查看更多

查看更多

联系我们

返回顶部