查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上一期小恒为大家介绍了组织特异性调控之心脏,本期小编将继续带大家来了解一下关于体内血管组织或细胞的特异性基因调控方式,主要从血管系统的介绍、血管组织/细胞特异性调控的血清型、血管组织/细胞特异性调控的启动子、血管组织/细胞的注射方式及剂量等四个方面展开分享。

一、血管系统的介绍
血管系统是人体内的一大循环系统,按广义可分为心脏和全身的血管系统,按部位又可分为心血管(心脏周围的供血系统)、脑血管(脑部供血系统)和外周血管(躯干、四肢和内脏的血管),它们共同维持着机体内环境的稳态、新陈代谢和各组织器官的正常生理机能。
动脉和静脉的管壁主要是由血管内皮细胞和血管平滑肌细胞等组成(图1左)[1],毛细血管则主要是单层的内皮细胞和基膜组成,血管壁细胞在调节血管稳态中起着非常重要的作用。另外,血脑屏障是中枢神经系统的微血管系统,由内皮细胞和周细胞组成(图1右)[2],是血液与大脑进行物质交换、保护神经组织免受毒素和病原体侵害至关重要的屏障。更重要的是,内皮功能障碍或中膜血管平滑肌受损都会导致一系列心血管疾病的发生,例如动脉粥样硬化、主动脉瘤、脑卒中、高血压等等。目前大部分心血管疾病都没有很好的治疗策略,主要以预防和外科手术介入为主,因此研究人员都在积极寻找有效的药物治疗靶点。与此同时,基因治疗的兴起和迅速发展为心血管疾病的治疗拓宽了道路。在往期《AAV在心血管疾病研究中的靶向策略》中小编通过心脏疾病的研究,已经为大家介绍了腺相关病毒在靶向心脏中的应用,接下来我们再来看下其在体内靶向感染血管的策略吧。
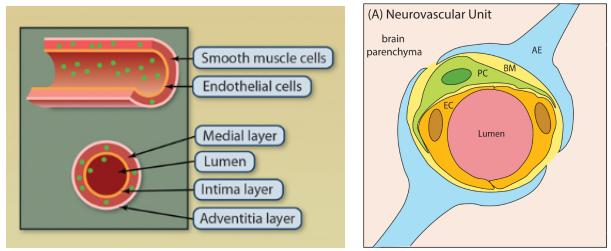
图1. 血管解剖结构[1, 2]。左:动、静脉主要结构;右:中枢神经系统微血管结构(EC:内皮细胞;PC:周细胞;BM:基底膜;AE:星形胶质细胞末端)
腺相关病毒载体(adeno-associated virus,AAV)具有安全性高、宿主范围广、免疫原性低等优点,已成为基因治疗的热门工具。AAV可以通过携带不同的血清型和特异性启动子去感染相应的组织或细胞,那么目前有哪些血清型、启动子和注射方式可以靶向心血管呢?除此之外,对于脑血管和外周血管的感染可不可以做到呢?本期小编将为您一一介绍。
二、血管组织/细胞特异性调控的血清型
AAV血清型是由Cap基因编码的衣壳蛋白决定的,通过识别细胞表面受体来靶向不同的组织器官,从而达到感染特定组织的目的。目前已有研究报道,AAV1、AAV5和AAV9血清型均可感染主动脉(图2,3)[3, 4]。

图2. AAV1、AAV2、AAV5感染大鼠主动脉效率比较[3]。用Luc抗体进行免疫染色,结果显示AAV2组(C和H)未观察到明显的染色,AAV1组(B和G)和AAV5组(D和I)均观察到了显著的染色。
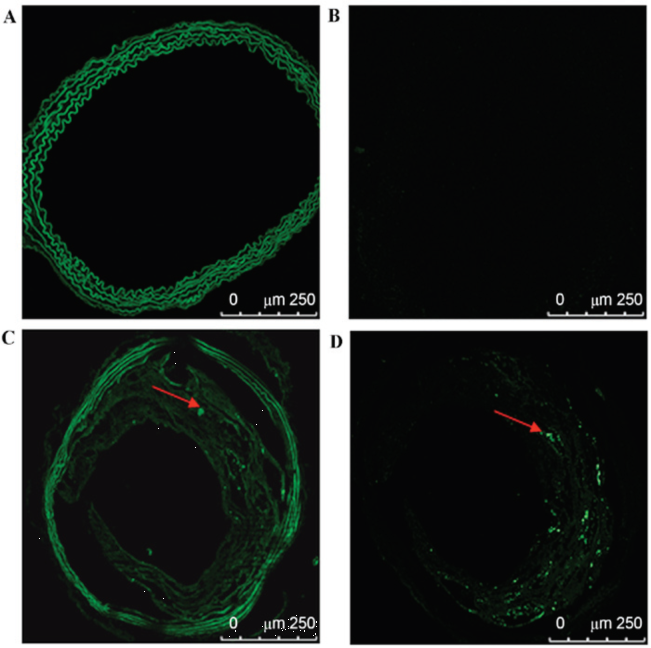
图3. AAV9感染小鼠颈动脉[4]
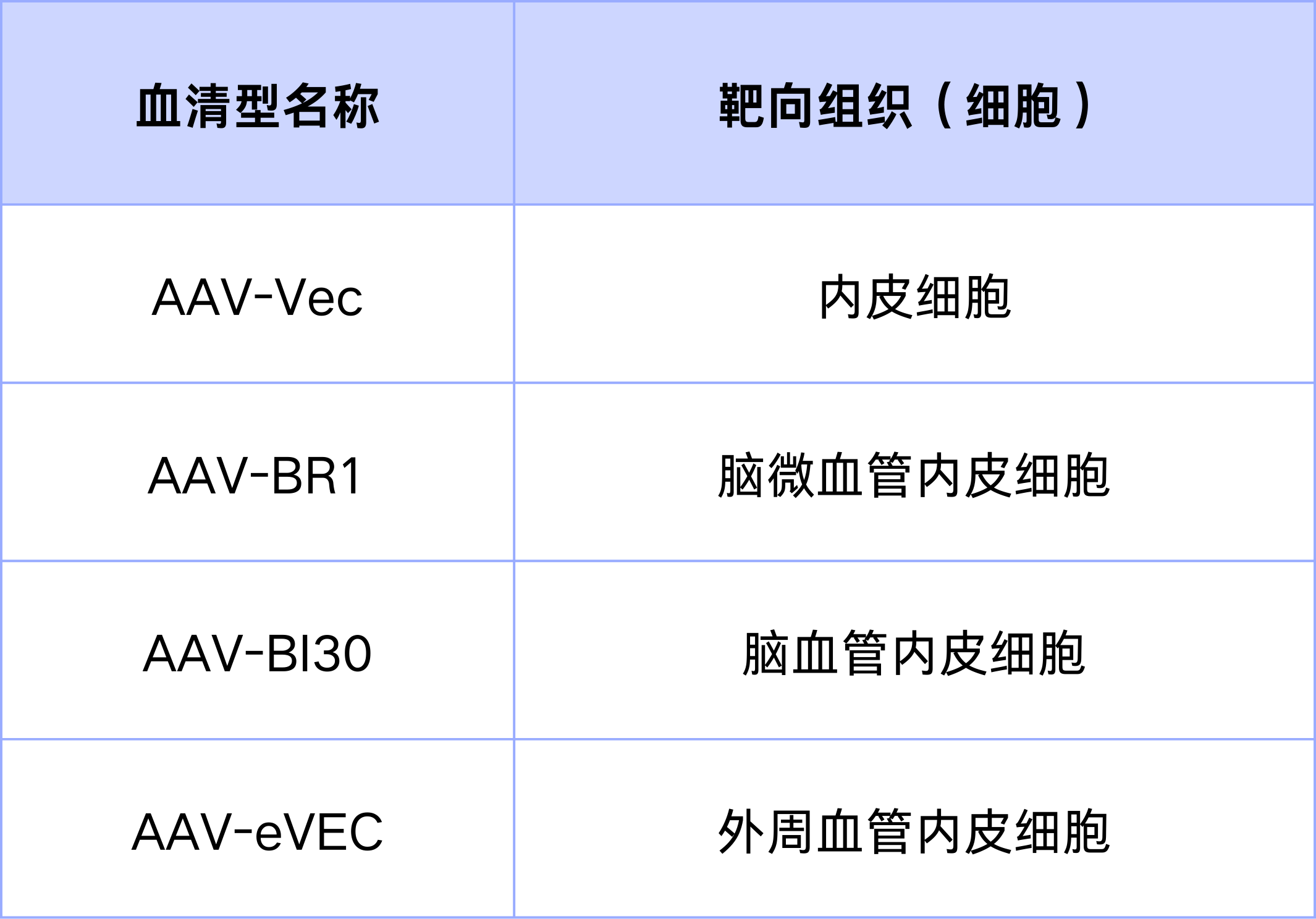
在实际应用中,AAV1、5、9在体内感染的组织具有一定的广泛性。汉恒生物可提供更具靶向性的AAV血清型:AAV-Vec、AAV-BR1、AAV-BI30和AAV-eVEC,各血清型靶向细胞类型见表1。
表1. 特异性感染内皮细胞的AAV血清型
(1)AAV-Vec高效感染血管内皮细胞
Vec血清型是在AAV2血清型的基础上改造而来的,它可以与内皮细胞表面的HSPG结合,尽管与AAV2的结合能力相似,但AAV-Vec的细胞内化率更高。据文献报道,作者将AAV2、AAV-Nec(先前报道过靶向内皮细胞的血清型)、AAV-Vec分别感染人脐静脉内皮细胞(HUVECs),在不同GOI(载体基因组与细胞的比值)下,AAV-Vec的感染效率都是最高且具有统计学意义的(图4)[5]。因此,提示AAV-Vec更适合用于体内外转导血管内皮细胞。
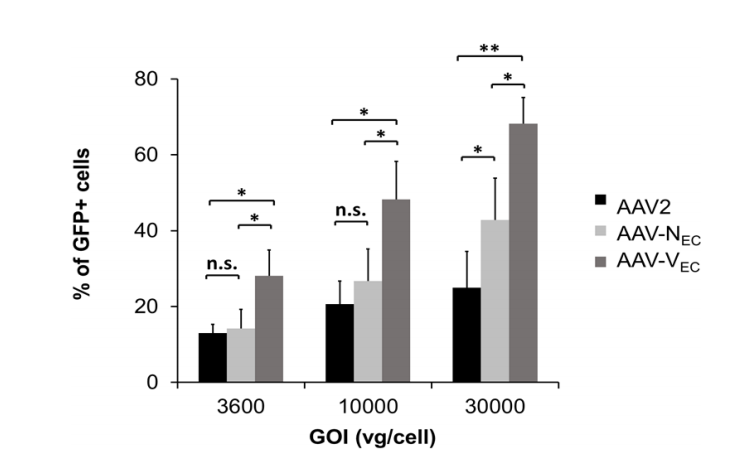
图4. 与AAV2相比,AAV-Nec、AAV-Vec转导HUVECs的效率[5]
(2)AAV-BR1高效感染脑微血管内皮细胞
BR1血清型也是通过在AAV2血清型中插入相应多肽筛选出来的,具有较好的脑血管内皮特异性。据文献报道[6],作者将野生型AAV2、AAV-PPS(先前报道过的脑靶向血清型)、AAV-BR1通过尾静脉注射感染小鼠,2周后经活体成像显示,与AAV2和AAV-PPS相比,AAV-BR1仅在大脑中聚集(图5 左);随后,来自小脑、嗅球、纹状体和大脑皮层的免疫荧光结果显示,AAV-BR1所携带的eGFP与内皮细胞标志物CD31在这些部位中共定位(图5 右),表明AAV-BR1能高效感染脑血管内皮细胞。
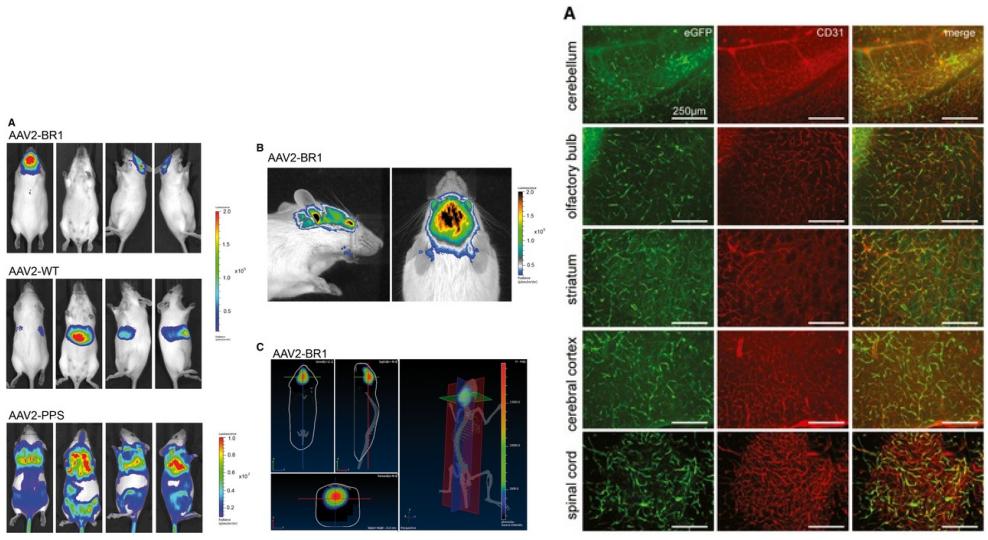
图5. 左:AAV-BR1经尾静脉注射靶向感染大脑;右:AAV-BRA1感染脑内皮细胞[6]
(3)AAV-BI30高效感染脑血管内皮细胞
AAV-BR1更倾向于感染脑微血管内皮细胞,即毛细血管内皮细胞,对于动脉和静脉内皮的感染效率相对不足。为了解决这一问题,科研人员在AAV9血清型的基础上进行了改造,并命名为AAV-BI30血清型。经实验验证,AAV-BI30能够有效感染脑部动脉、静脉和毛细血管的内皮,而AAV-BR1主要局限于毛细血管内皮(图6)[7]。因此,相比于AAV-BR1,AAV-BI30感染脑血管内皮细胞的效率更高、用途更广;除大脑外,对整个中枢神经系统和视网膜血管的内皮细胞也有很好的嗜性[7]。
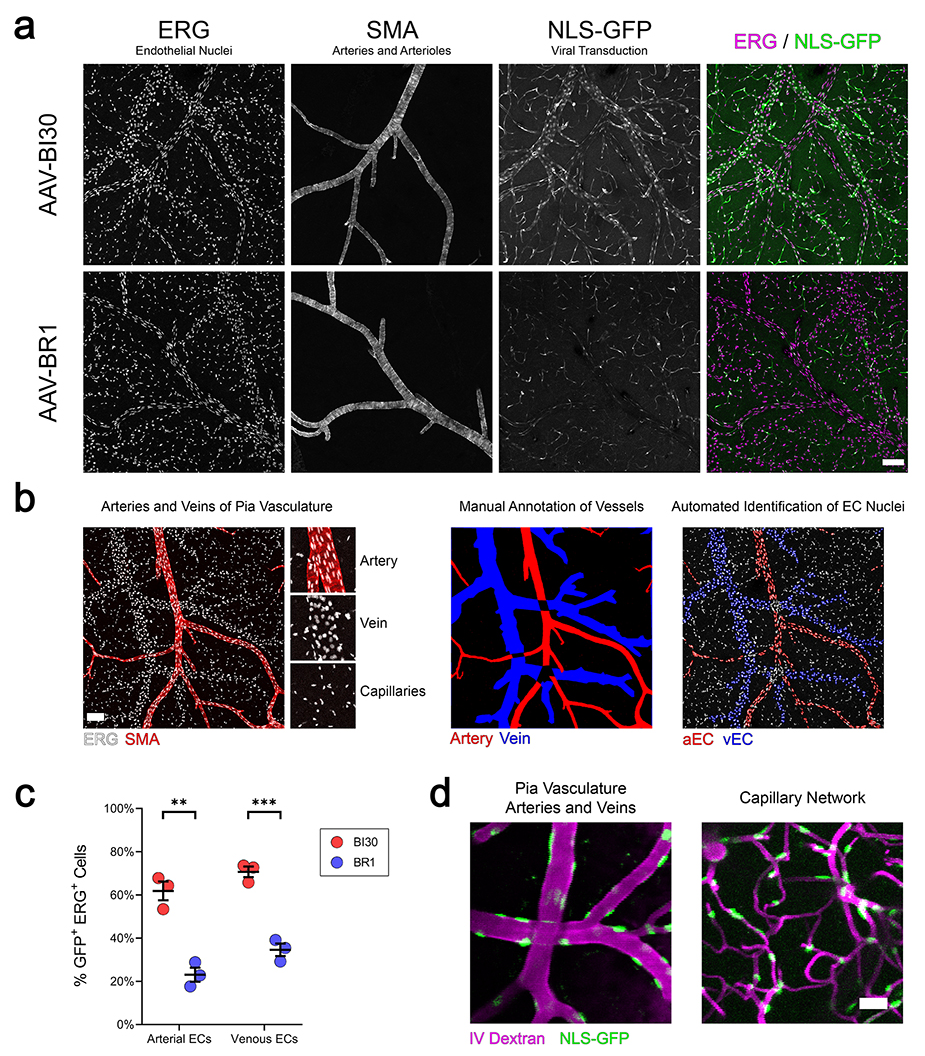
图6. c[7]
三、血管组织/细胞特异性调控的启动子
在特异性调控的载体选择中,除了血管靶向的特异性血清型外,还有针对血管内皮细胞(TIE1/TIE2/CDH5/ICAM2)和血管平滑肌细胞(SM22α)的特异性启动子,可以增强血管的靶向性感染,详情见表2。
表2. 靶向血管内细胞的特异性启动子

(1)TIE1内皮细胞特异性启动子
TIE1是一种酪氨酸激酶受体,在血管内皮细胞中特异性表达,因此TIE1启动子可以作为靶向血管内皮细胞的特异性启动子。有文献报道,将AAV-CMV-eGFP和AAV-TIE1-eGFP通过颈动脉结扎法注射到家兔动脉腔中,3周后的冰冻切片结果显示,TIE1启动子使eGFP在颈动脉内皮细胞中高表达(图7)[8],证实了TIE1启动子的血管内皮细胞特异性。
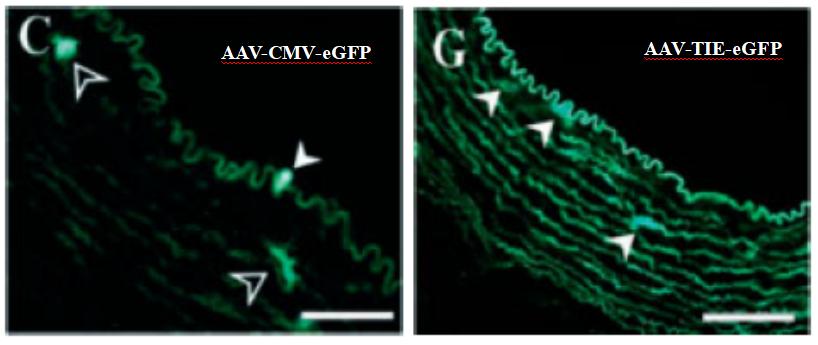
图7. AAV-TIE1-eGFP高效感染血管内皮细胞[8]
如图8所示[9],发表在《Antioxidants》杂志上题为“Hydroxysafflor Yellow A Blocks HIF-1α Induction of NOX2 and Protects ZO-1 Protein in Cerebral Microvascular Endothelium”的文章,作者将汉恒生物提供的AAV2/BR1-TIE1-miR30-m-Tjp1经小鼠尾静脉注射,成功感染脑微血管内皮细胞,并实现对目的基因ZO-1(Tjp1的别名)的敲低。
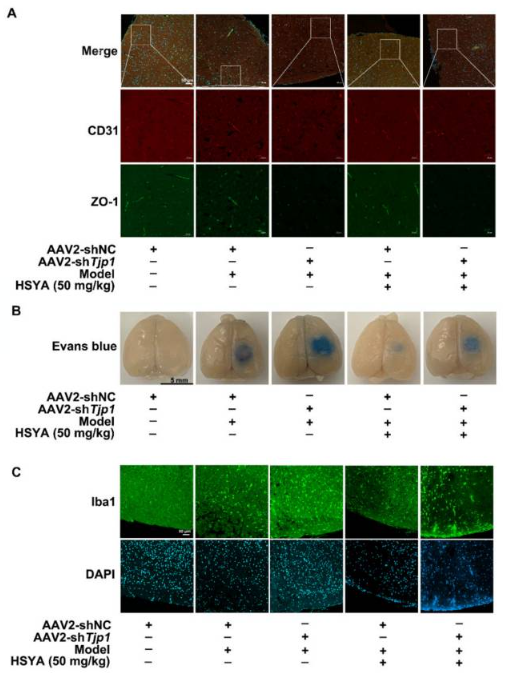
图8. AAV2/BR1-TIE1-miR30-m-Tjp1感染小鼠脑微血管内皮细胞并敲低ZO-1 [9]
(2)TIE2内皮细胞特异性启动子
TIE2作为血管系统中公认的内皮细胞标志物,不仅在内皮细胞中稳定表达,也见于内皮祖细胞,是维持内皮细胞完整性与增殖功能的关键分子。早期研究利用TIE2-Cre等转基因动物模型,证实了TIE2启动子可用于特异性靶向内皮细胞[10, 11]。基于这一特性,该启动子被广泛应用于AAV载体中,用以实现在内皮细胞中特异性调控目的基因的表达[12]。例如,研究为明确Fads1/2能否减轻LPS诱导的小鼠急性肺损伤,构建了AAV-VEC-TIE2-Fads1、AAV-VEC-TIE2-Fads2(由汉恒生物提供),通过气管内注射70 μL的AAV,成功感染上了肺血管内皮(图9),并证实内皮特异性过表达Fads1/2能显著减轻小鼠模型的肺损伤[13]。然而,值得注意的是,有研究指出TIE2启动子存在表达偏好性,其更倾向于在动脉内皮中表达,在静脉内皮中表达则相对较弱,这在后续相关研究应用中需加以考量[14]。
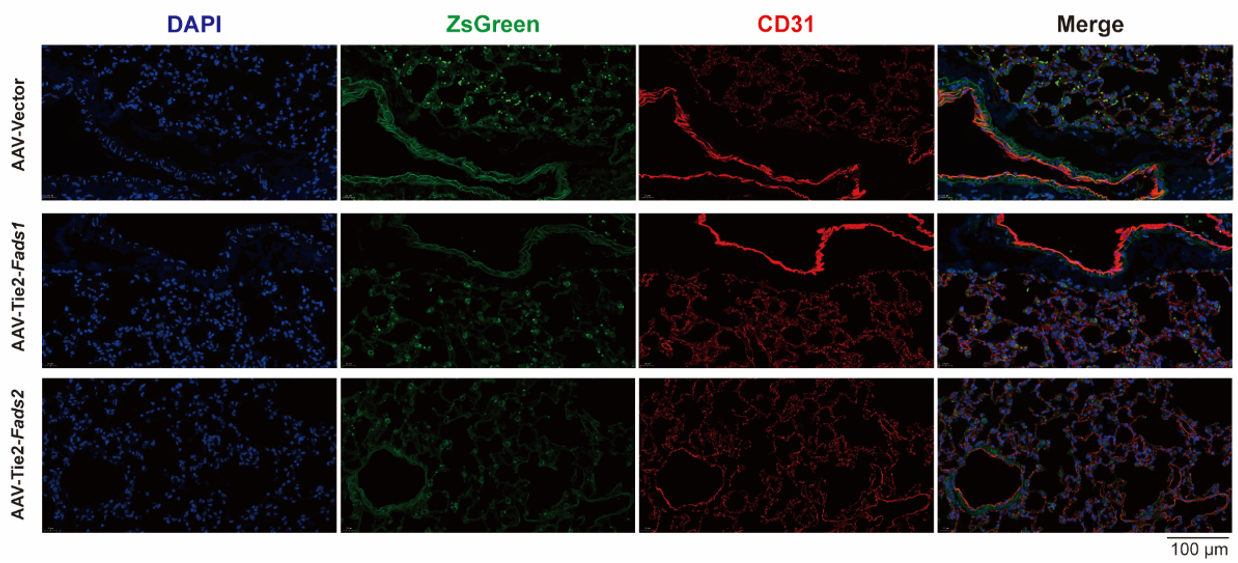
图9. AAV-VEC-TIE2通过气管内注射感染小鼠肺血管内皮[13]
(3)CDH5内皮细胞特异性启动子
血管内皮钙粘蛋白(VE-cadherin,亦称CDH5)是一种钙依赖性黏附分子,特异性表达于正常血管和肿瘤血管的内皮细胞间连接处[15]。研究表明,小鼠内源性CDH5启动子从胚胎期血管发育到成年血管的内皮细胞中均具有活性[16]。进一步对人CDH5启动子的研究发现,在成年小鼠中,该启动子在肺、心脏、卵巢、脾脏、肾小球以及肿瘤血管的内皮细胞中表现出高度特异性与较强活性,而在脑、胸腺、肝脏及骨骼肌的血管系统中活性相对较弱[15]。
在《Basic Research in Cardiology》发表的一项研究中[17],复旦大学葛均波教授团队探讨了心脏缺血-再灌注(I/R)损伤后微血管内皮细胞中钙浓度的变化。作者通过向小鼠尾静脉注射AAV9-Cdh5-GCaMP8(汉恒生物提供),使GCaMP8特异表达于血管内皮细胞,从而观察到I/R损伤后心脏微血管内皮出现明显钙超载现象(图10)。进一步研究显示,抗高血压药物吡那地尔(Pinacidil)能够抑制内皮钙超载,进而发挥对心脏微血管功能的保护作用。
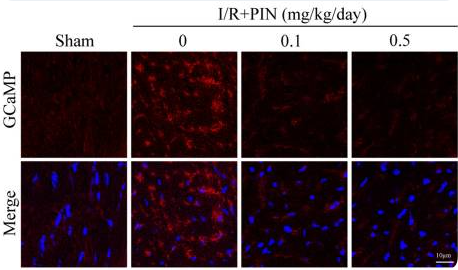
图10. AAV9-Cdh5-GCaMP8感染小鼠心脏微血管内皮并监测其钙水平变化[17]
(4)ICAM-2内皮细胞特异性启动子
细胞间黏附分子2(ICAM-2)广泛表达于所有血管内皮细胞,在人体中还表达于巨核细胞[18, 19]。研究已对人ICAM-2启动子区域中涵盖内皮特异性转录活性的关键信号进行了系统分析,确认其在内皮细胞中具有特异性活性,但在GATA家族转录因子高表达的非内皮细胞中也可能被激活[19-21]。基于这些研究,ICAM-2启动子已被用于构建内皮特异性AAV载体,以实现外源基因在内皮细胞的特异性表达。例如, 天津医科大学何金龙教授团队在《eLife》上发表的一项研究中[22],为探讨Aff3ir-ORF2是否能在体内抑制动脉粥样硬化的发展,通过尾静脉注射AAV-ICAM2-Aff3ir-ORF,在Apoe-/-小鼠主动脉内皮中特异性过表达了Aff3ir-ORF(图11),这显著减少了主动脉和主动脉根部的斑块面积和脂质沉积。
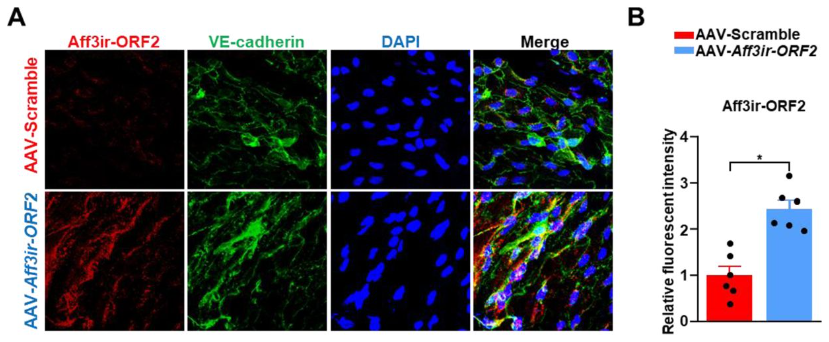
图11. AAV-ICAM2-Aff3ir-ORF2感染小鼠主动脉内皮并特异性表达Aff3ir-ORF2 [22]
(5)SM22α平滑肌细胞特异性启动子
SM22α是一种编码22 kDa的钙调相关蛋白,在平滑肌中特异性表达,且为平滑肌细胞最为广泛的标志物。因此,AAV携带SM22α启动子可用于靶向感染平滑肌细胞。然而,平滑肌不仅分布在血管,在消化道、呼吸道和生殖系统等也有广泛的分布,所以SM22α启动子通常需要配合相应的AAV血清型来靶向血管平滑肌细胞。如图12所示[23],发表在《Cell Death & Differentiation》杂志题为“Ferroptotic stress facilitates smooth muscle cell dedifferentiation in arterial remodelling by disrupting mitochondrial homeostasis”的文章,作者通过汉恒生物构建了AAV2/9-SM22α-mGPX4-Flag-ZsGreen和AAV2/9-SM22α-ZsGreen,将病毒经小鼠颈总动脉原位注射至血管腔中,2周后再进行尾静脉注射,成功在小鼠颈动脉血管平滑肌细胞中实现GPX4基因的过表达。
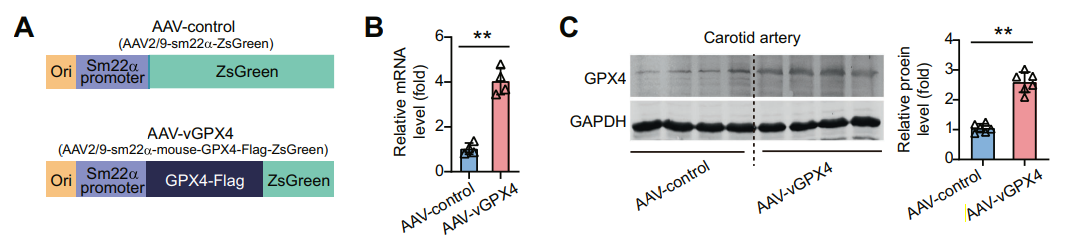
图12. AAV2/9-SM22α-mGPX4-Flag-ZsGreen感染小鼠颈动脉血管平滑肌细胞并过表达GPX4 [23]
四、血管组织/细胞的注射方式和剂量
向血管中递送AAV的方式主要有系统性注射(尾静脉注射和眼眶后静脉注射)、原位注射(结扎法和凝胶孵育法),对于脑血管感染还可以采用脑立体定位注射等方式,针对不同注射方式的用量和优劣势详情见表3。
表3. 血管递送AAV的注射方式对比

心血管系统的血管特异性调控部分就介绍到这里啦,大家可以查阅往期内容《AAV在心血管疾病研究中的靶向策略》,进一步了解AAV在心脏中的应用策略。后续我们将会给大家带来更多体内不同组织/细胞特异性调控的干货。除本文介绍的血管特异性载体外,汉恒生物还研发了靶向神经、肌肉、肾脏、肝脏、视网膜、胰腺等组织器官的AAV特异性启动子和特异性血清型,使用合适的血清型和特异性启动子,可对不同组织、器官进行高效靶向感染,欢迎各位老师咨询,请小伙伴们继续关注哦!
参考文献:
[1]. North, B.J. and D.A. Sinclair. The intersection between aging and cardiovascular disease. Circ Res, 2012, 110(8): 1097-108.
[2]. Langen, U.H., S. Ayloo, and C. Gu. Development and Cell Biology of the Blood-Brain Barrier. Annu Rev Cell Dev Biol, 2019, 35(591-613.
[3]. Chen, S., M. Kapturczak, S.A. Loiler, et al. Efficient transduction of vascular endothelial cells with recombinant adeno-associated virus serotype 1 and 5 vectors. Hum Gene Ther, 2005, 16(2): 235-47.
[4]. Chen, Q., H. Zhai, X. Li, et al. Recombinant adeno-associated virus serotype 9 in a mouse model of atherosclerosis: Determination of the optimal expression time in vivo. Mol Med Rep, 2017, 15(4): 2090-2096.
[5]. Zhang, L., A. Rossi, L. Lange, et al. Capsid Engineering Overcomes Barriers Toward Adeno-Associated Virus Vector-Mediated Transduction of Endothelial Cells. Hum Gene Ther, 2019, 30(10): 1284-1296.
[6]. Korbelin, J., G. Dogbevia, S. Michelfelder, et al. A brain microvasculature endothelial cell-specific viral vector with the potential to treat neurovascular and neurological diseases. EMBO Mol Med, 2016, 8(6): 609-25.
[7]. Krolak, T., K.Y. Chan, L. Kaplan, et al. A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System. Nat Cardiovasc Res, 2022, 1(4): 389-400.
8]. Gruchala, M., S. Bhardwaj, K. Pajusola, et al. Gene transfer into rabbit arteries with adeno-associated virus and adenovirus vectors. J Gene Med, 2004, 6(5): 545-54.
[9]. Li, Y., X.T. Liu, P.L. Zhang, et al. Hydroxysafflor Yellow A Blocks HIF-1alpha Induction of NOX2 and Protects ZO-1 Protein in Cerebral Microvascular Endothelium. Antioxidants (Basel), 2022, 11(4):
[10]. Ward, N.L. and D.J. Dumont. The angiopoietins and Tie2/Tek: adding to the complexity of cardiovascular development. Semin Cell Dev Biol, 2002, 13(1): 19-27.
[11]. Kisanuki, Y.Y., R.E. Hammer, J. Miyazaki, et al. Tie2-Cre transgenic mice: a new model for endothelial cell-lineage analysis in vivo. Dev Biol, 2001, 230(2): 230-42.
[12]. Gao, R., L. Liang, L. Yang, et al. Targeting Endothelial KDM5A to Attenuate Aging and Ameliorate Age-Associated Metabolic Abnormalities. Adv Sci (Weinh), 2025, e12657.
[13]. Xu, J., Y. Wang, W. Mao, et al. Metabolic Interplay in Acute Lung Injury: PARK7 Integrates FADS1/2-Dependent PUFA Metabolism and H3K14 Lactylation to Attenuate Endothelial Ferroptosis and Dysfunction. Adv Sci (Weinh), 2025, e08725.
[14]. Anghelina, M., L. Moldovan, and N.I. Moldovan. Preferential activity of Tie2 promoter in arteriolar endothelium. J Cell Mol Med, 2005, 9(1): 113-21.
[15]. Prandini, M.H., I. Dreher, S. Bouillot, et al. The human VE-cadherin promoter is subjected to organ-specific regulation and is activated in tumour angiogenesis. Oncogene, 2005, 24(18): 2992-3001.
[16]. Alva, J.A., A.C. Zovein, A. Monvoisin, et al. VE-Cadherin-Cre-recombinase transgenic mouse: a tool for lineage analysis and gene deletion in endothelial cells. Dev Dyn, 2006, 235(3): 759-67.
[17]. Liu, M., S. Li, M. Yin, et al. Pinacidil ameliorates cardiac microvascular ischemia-reperfusion injury by inhibiting chaperone-mediated autophagy of calreticulin. Basic Res Cardiol, 2024, 119(1): 113-131.
[18]. Cowan, P.J., T.A. Shinkel, E.J. Witort, et al. Targeting gene expression to endothelial cells in transgenic mice using the human intercellular adhesion molecule 2 promoter. Transplantation, 1996, 62(2): 155-60.
[19]. Cowan, P.J., D. Tsang, C.M. Pedic, et al. The human ICAM-2 promoter is endothelial cell-specific in vitro and in vivo and contains critical Sp1 and GATA binding sites. J Biol Chem, 1998, 273(19): 11737-44.
[20]. Velasco, B., J.R. Ramirez, M. Relloso, et al. Vascular gene transfer driven by endoglin and ICAM-2 endothelial-specific promoters. Gene Ther, 2001, 8(12): 897-904.
[21]. Cowan, P.J., T.A. Shinkel, N. Fisicaro, et al. Targeting gene expression to endothelium in transgenic animals: a comparison of the human ICAM-2, PECAM-1 and endoglin promoters. Xenotransplantation, 2003, 10(3): 223-31.
[22]. He, S., L. Huang, Z. Chen, et al. Disruption of the novel nested gene Aff3ir mediates disturbed flow-induced atherosclerosis in mice. Elife, 2025, 13(
[23]. Ji, Q.X., F.Y. Zeng, J. Zhou, et al. Ferroptotic stress facilitates smooth muscle cell dedifferentiation in arterial remodelling by disrupting mitochondrial homeostasis. Cell Death Differ, 2023, 30(2): 457-474.
[24]. Li, J.L., Z. Bi, X.J. Chen, et al. A targeted vector for brain endothelial cell gene delivery and cerebrovascular malformation modelling. Nat Biomed Eng, 2025,
[25]. Fazal, Z.H., K. Hosaka, F.P. Manfredsson, et al. Introducing a Novel Method of Intravascular Adeno-associated Virus-mediated Gene Delivery. Virology (Hyderabad), 2018, 2(1)
[26]. Zhao, Y., A. Xia, C. Li, et al. Methyltransferase like 3-mediated N6-methylatidin methylation inhibits vascular smooth muscle cells phenotype switching via promoting phosphatidylinositol 3-kinase mRNA decay. Front Cardiovasc Med, 2022, 9(913039.
[27]. Remes, A., D.I. Basha, T. Puehler, et al. Alginate hydrogel polymers enable efficient delivery of a vascular-targeted AAV vector into aortic tissue. Mol Ther Methods Clin Dev, 2021, 21(83-93.

查看更多

查看更多

查看更多

联系我们

返回顶部