查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息

类器官技术概况
在现代生物医学研究中,针对人类自身的研究面临着多重挑战,包括样本的可获得性和伦理道德是必须考虑的问题,以及细胞系和原代细胞无法完全代表生物体内实际发生的情况等。近年来,“类器官”这一概念逐渐走入人们的视野,这正是科学家们为了解决上述难题而提出的一种创新性解决方案。类器官(Organoids),顾名思义是类似器官的一种生物学模型,能够模拟真实组织器官的形态和功能,为深入理解人类生理和病理过程提供了全新的技术平台。
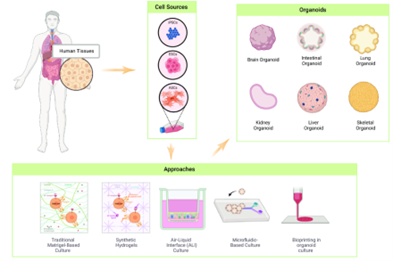
图1 类器官的构建示意图[1]
类器官研究的历史可追溯至20世纪初,1907年,美国科学家Wilson等[2]首次发现在体外被机械分离的海绵细胞能够自发组装并形成新的具备一定生理功能的海绵有机体。之后的数十年间,这种解离重组现象在两栖动物前肾细胞、鸡胚胎细胞、人角质形成细胞等一些特殊生物组织中得到复现[3]。但是,这一时期的研究并未明确何种特征的细胞能够发生这种自发性重组。直到1981年,研究人员首次揭示了具有干性的细胞具备在体外自发重组形成器官结构的能力[4]。1987年,体外3D培养基得到重要优化,Li等[5]提取小鼠Engelbreth-Holm-Swarm(EHS)肉瘤的细胞外基质制作基质胶,成为后来体外3D培养基的重要成分。2009年,类器官研究取得重大突破,Sato等[6]首次利用表达LGR5的小鼠肠道干细胞培养出具有隐窝-绒毛结构的微组织,并且保持基因组稳定3个月以上,标志着类器官的正式问世。随后,科学家们相继培育出了多种类型的类器官,包括肺类器官、肝类器官、脑类器官等,小恒将分期逐一为大家介绍。今天,我们先介绍肠道类器官。
肠道类器官的发展史
肠道作为重要的消化器官,承担着营养物质代谢、免疫调节和维持黏膜屏障功能的重要作用。肠上皮细胞损伤、免疫应激和肠道菌群紊乱都可能导致肠道疾病的进展,然而由于肠道各部分独特的生理构造,导致在体外模拟肠道内环境来探究肠道疾病的发病机制十分困难。肠道类器官的出现,极大地改变了这一局面。
肠道黏膜层的核心功能单元由肠绒毛及其基部的隐窝结构构成。隐窝作为特殊的微环境龛,容纳着维持肠上皮动态更新的成体干细胞群体[7]。在类器官技术问世前,科研人员长期致力于隐窝-绒毛结构的体外重建研究。早期尝试中,Sträter团队[8]于1996年率先开展了肠上皮隐窝分离培养工作,但发现离体隐窝在4小时内即发生程序性死亡。后续研究揭示,特定生长因子的补充是实现肠腺长期培养的关键突破。2007年Barker课题组[9]的突破性研究发现,Wnt和Notch旁分泌信号通路通过调控Lgr5+肠道干细胞(该群体特异性表达富含亮氨酸重复序列的G蛋白偶联受体)在组织再生中发挥核心作用,这一发现为肠道类器官技术的发展奠定了理论基础。
随着技术发展,2009年成为肠道类器官研究的关键节点:Ootani等[10]不仅验证了Wnt/Notch信号对培养体系的重要性,更建立了小鼠隐窝的特异性培养方案;同期Sato团队[11]通过分离小鼠Lgr5+隐窝基底柱状细胞,在基质胶三维培养体系中成功获得能稳定维持8个月隐窝特征的类器官模型。2011年Spence等[12]实现了技术跨越,他们通过多能干细胞(PSCs)分阶段定向分化策略——先将PSCs诱导为内胚层祖细胞,再经肠球体中间阶段,最终获得具有极化上皮特征的肠道类器官。该体系不仅可实现连续传代,冷冻复苏后仍能保持基因组稳定性和生物学特性。
在肠肿瘤研究领域,2015年vande Wetering团队[13]建立的结直肠癌类器官模型取得90%的原代培养成功率,冻存后存活率达80%。2018年Fujii等[14]通过优化Wnt信号调控,成功培育出五种分子亚型的CRC类器官,这些模型均保留了源肿瘤的组织病理特征。这些突破性工作推动了类器官技术在各类癌症研究中的广泛应用。
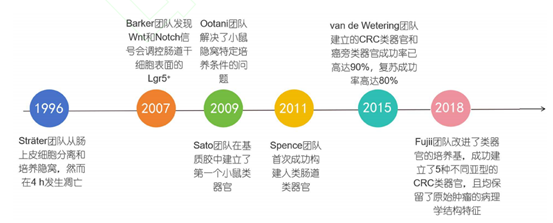
图2 肠道类器官构建的简史图[15]
肠道类器官的建立
肠道类器官模型的构建关键步骤之一是识别器官组织中的干细胞,这一直是研究中的热点和难点。肠道上皮由隐窝—绒毛这个基本单位构成,肠道干细胞就位于隐窝的底部,它们快速分裂增殖产生过渡扩增(transit amplifying,TA)细胞。TA细胞沿着隐窝向上迁移并生长至绒毛两侧,同时伴随着增殖分化,最终形成成熟且完全分化的肠功能细胞,包括肠上皮吸收细胞、潘氏细胞、杯状细胞、内分泌细胞等[16]。2007年,Hans Clevers等[17]利用体内谱系示踪技术,发现LGR5+仅表达于隐窝底部柱状细胞表面,证实LGR5+细胞是真正的肠道干细胞。LGR5是一种跨膜蛋白,与配体R-spondin1结合可增强Wnt-β-catenin信号通路[16]。在隐窝底部,LGR5+干细胞与潘氏细胞交错排列,CD24+潘氏细胞可以表达表皮生长因子EGF、Wnt激动剂Wnt3A、转化生长因子TGF-α、Notch配体Dll4,这些因子可以促进干细胞的增殖分化[18]。自从肠干细胞特异性标记物Lgr5得到鉴定以后,肠道干细胞的研究得到了迅速发展。2009年Hans Clevers等[6],首次利用小鼠Lgr5+干细胞在体外培养出3D小肠绒毛状上皮空心球体结构。接下来,我们对小鼠肠道类器官的基本建立过程进行整理,便于大家快速了解大致过程。
小鼠肠道类器官培养主要包括隐窝分离、基质包埋和三维培养三个关键步骤,具体操作如下[19-26]:
一、组织预处理
1、取10cm小鼠肠段,PBS缓冲液冲洗。
2、纵向剖开肠管,冰PBS反复冲洗清除内容物。
3、机械法去除绒毛层,组织分切为5-10mm片段。
二、隐窝分离纯化
1、EDTA溶液(2mM)37℃消化处理。
2、梯度离心法富集隐窝(100×g,4℃)。
3、显微镜下评估隐窝完整性。
三、三维培养体系建立
1、隐窝悬液与Matrigel基质1:1混合。
2、24孔板每孔接种50uL混合液(含200个隐窝)。
3、覆盖ENR完全培养基(含EGF 50ng/mL,Noggin 100ng/mL)。
四、培养监测
1、24h:形成球形结构。
2、5d:发育为典型花瓣状形态。
3、7-10d:可进行传代操作。
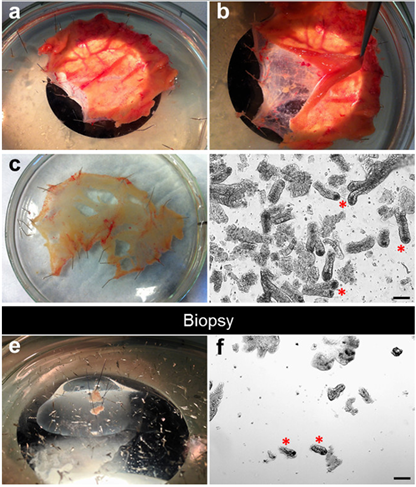
图3 肠隐窝分离过程[25]
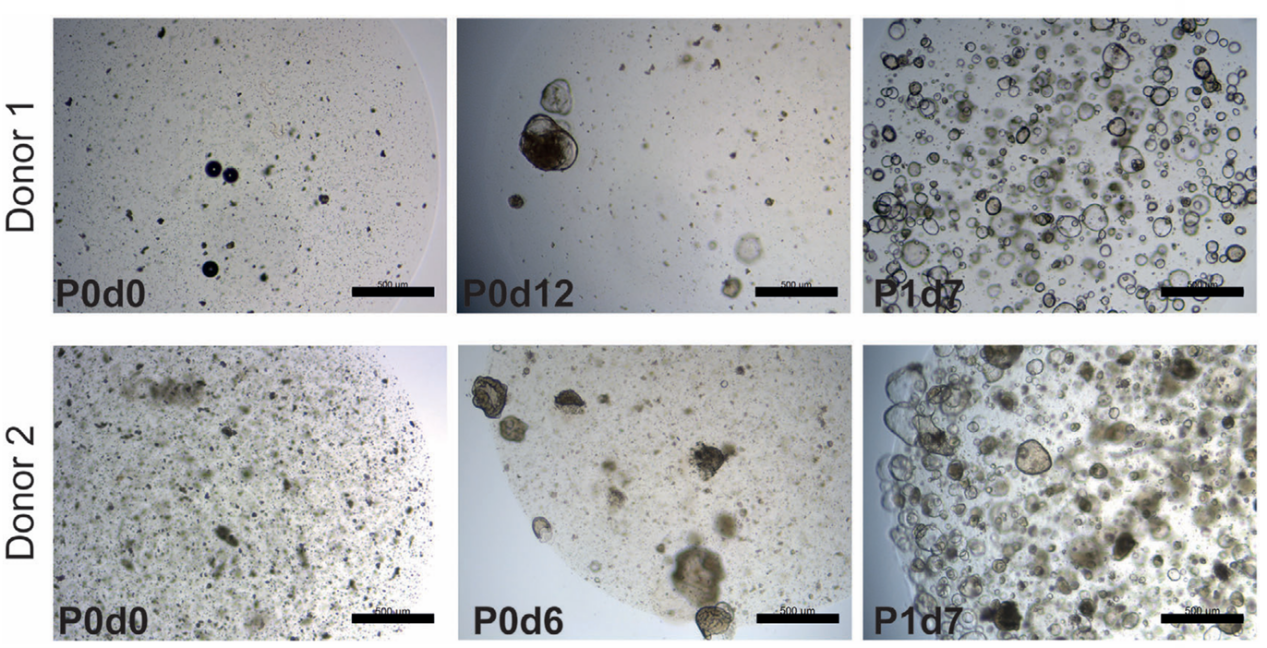
图4 不同阶段肠道类器官培养物形态[26]
肠道类器官的感染方法
肠道类器官是一种高度仿生肠道三维结构和生理功能的体外培养体系,目前已在多个研究领域展现出重要价值,包括基因功能解析、病理模型建立及药物开发评估等。在这些研究过程中,基因表达调控工具发挥着关键作用,其能够精准操纵肠道类器官中特定基因的表达水平,进而建立更具针对性的研究模型,为深入探索肠道疾病发病机理及开发新型治疗方案开辟了创新途径。
基因表达载体的选择对于肠道类器官的感染至关重要,慢病毒载体、腺病毒载体和腺相关病毒载体(AAV)是目前做类器官基因表达载体的三大主力,有着各自的优势和适用范围。例如慢病毒可将目的基因整合到宿主细胞基因组中,实现长期稳定表达,适合做类器官的稳定基因编辑以及致癌基因建模;腺病毒可携带较大的外源DNA片段,转导效率高,适合难以转染的原代类器官;AAV的免疫原性极低,可长期表达,适合需低毒性长期表达的实验和临床转化研究,如体内移植类器官。慢病毒、腺病毒和腺相关病毒在肠道类器官中的转导方法是类似的。
肠道类器官的病毒转导标准化操作流程:
1. 类器官预处理与解离
为提高病毒转导效率,需对已形成的肠道类器官进行适当解离处理:
清洗步骤:使用PBS冲洗类器官,去除残留培养基成分;
解离方法:
机械解离:轻柔吹打使类器官分散为小细胞簇;
酶消化:采用胰蛋白酶(0.25%)处理5-10分钟,获得单细胞悬液;
洗涤与重悬:解离后细胞经PBS清洗去除酶残留,最终重悬于转导专用培养基中。
2. 病毒转导操作
病毒-细胞共孵育:
将病毒颗粒(如慢病毒、腺病毒或AAV)与解离细胞混合,病毒滴度需根据预实验优化(通常MOI=5-50);可添加助转剂(如Polybrene,终浓度4-8 μg/mL)以增强感染效率;
离心增强感染:
混合液室温600×g离心1小时,促进病毒颗粒与细胞接触;离心后转移至37℃培养箱继续孵育6小时;
类器官回收:
转导结束后,1000×g离心5分钟收集细胞;
去除上清,将细胞重新包埋于Matrigel中,接种至多孔板继续培养。
3. 转导后处理与验证
培养基更换:转导后24小时内更换新鲜类器官完全培养基,维持细胞活性;
效率评估:
荧光标记法:通过荧光显微镜观察报告基因(如GFP)表达;
分子检测:采用qPCR或Western Blot定量目标基因表达水平;
抗性筛选(可选):
若病毒载体携带抗性基因(如Puromycin抗性),在转导48小时后加入相应抗生素(如2 ug/mL Puromycin),持续筛选3-5天以获得稳定转导的类器官群体。
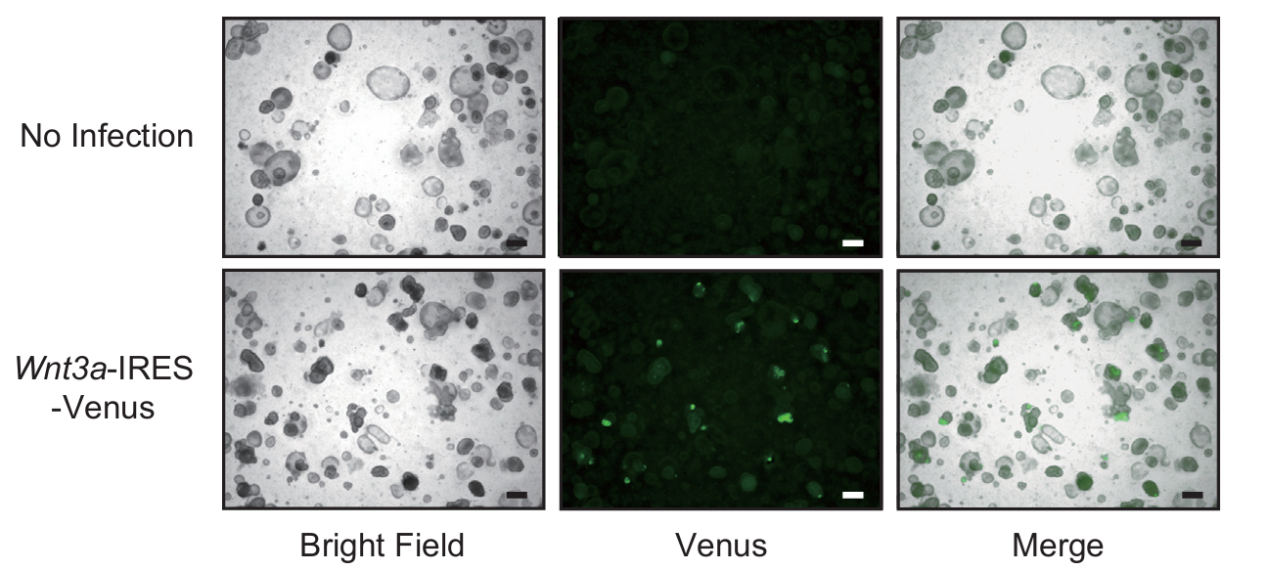
图5 慢病毒转导肠道类器官后观察荧光[27]
肠道类器官的研究应用
肠道类器官作为高度仿生的人体器官微模型,已在多个研究领域展现出重要价值,其应用主要涵盖:(1)疾病机制研究,例如构建结直肠癌类器官,保留原肿瘤突变谱(如APC、KRAS突变),用于研究肿瘤发生、转移和异质性。(2)药物开发与精准医疗,例如制备患者来源类器官(PDOs),预测个体对药物的响应,用于肿瘤药物筛选和个性化治疗。(3)再生医学,例如移植肠类器官修复辐射损伤或炎症性肠病(IBD)模型中的肠黏膜。
(1)作为肿瘤模型研究结肠癌发生发展机制
传统的2D肿瘤细胞培养和患者来源异种移植瘤模型(PDTXs)在癌症研究中发挥了重要作用,但存在明显局限性:2D细胞系因长期传代易发生遗传变异,难以维持原始肿瘤的异质性;而PDTXs建模成功率较低。相比之下,肿瘤类器官模型克服了这些缺陷,既能保留原发肿瘤的生物学和遗传特征,又具备操作简便、成功率高的优势,成为肿瘤研究的新兴工具[28]。类器官技术结合基因编辑,可精准模拟CRC的发生发展过程。例如,Drost等[29]通过CRISPR/Cas9依次编辑APC、p53、KRAS和SMAD4,发现四基因突变的类器官可不依赖外源生长因子存活,并证实APC和p53缺失是CRC发生的关键。进一步研究发现,此类类器官皮下移植后仅能局部生长,而盲肠原位移植则可自发转移,表明肠道微环境对肿瘤转移至关重要。类似地,在正常结肠类器官中引入Braf V600E突变可构建锯齿状结肠癌模型,证实TGFβ信号驱动其向侵袭性更强的间充质亚型转化[30]。肿瘤类器官与基因编辑技术的结合,极大推动了CRC的机制研究和治疗探索。

图6 利用CRISPR/Cas9基因组编辑技术在人类结肠类器官中引入APC、P53、KRASG12D及SMAD4突变[29]
(2)肿瘤药物筛选和个性化治疗
尽管2D培养的肠癌细胞系一直用于检测药物反应,但细胞系无法完全代表CRC的各种亚型,因此2D实验结果不能全面体现在体疗效[31]。相比之下,患者来源类器官(PDO)能高度保留原发肿瘤的基因组特征,为大规模药物筛选及个体化治疗提供可靠平台。Hans Clevers等[32]利用囊性纤维化(CF)患者的类器官来检测其对各种药物的反应。他们测试了源自荷兰600名囊性纤维化患者的类器官,通过观察药物是否能够引起类器官膨胀来决定该药物是否对患者起作用,为精准医疗奠定基础。E. Voest实验室[33]创新性地将外周血单核细胞与肺癌/CRC类器官共培养,成功诱导出肿瘤特异性T细胞。这类T细胞仅靶向肿瘤类器官,对正常组织无杀伤作用,展现出潜在的临床回输治疗价值,此类研究提示了利用肿瘤类器官进行免疫疗法的可能性。

图7 通过与自体肿瘤类器官共培养,诱导循环T细胞产生肿瘤反应性[33]
(3)肠道再生修复
再生医学旨在通过替代缺失或修复功能缺陷受损的细胞、组织或器官,促进机体再生,进而帮助机体恢复或者建立正常的功能。肠道类器官的建立可以在体外利用肠干细胞培养出大量类器官,这为肠道的再生修复提供了条件。肠道类器官是类器官模型中较为成熟的体系,其最先应用于再生医学领域。早在2012年,Yui等[34]通过在体外培养结肠类器官,将结肠类器官以碎片的形式灌肠注入到葡聚糖硫酸钠诱导的小鼠结肠炎模型中,于移植后第6天在受体小鼠结肠中观察到了多个界限清楚的增强绿色荧光蛋白阳性(enhanced green fluorescent protein positive, EGFP+)区域,移植细胞黏附于受损伤的肠道部位。在移植后4周,组织学检测发现移植物在受体小鼠结肠中形成了隐窝样的结构并包含了结肠隐窝所有终末分化类型的细胞。在个体水平上,移植后12至14天,接受肠道类器官移植的小鼠体重要高于对照组。功能学检测结果表明,移植物可以维持肠道上皮屏障功能。
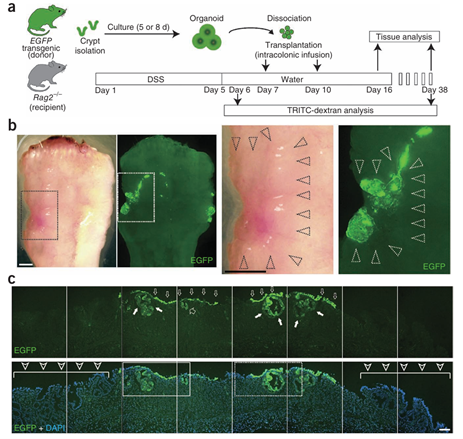
图8 肠道类器官移植改善急性结肠炎[34]
本文为大家梳理了肠道类器官的发展史、培养建立技术、病毒感染技术及其在肠道疾病和肿瘤研究中的应用进展。尽管该领域仍处于快速发展阶段,面临着规模化培养效率、移植存活率等技术瓶颈需要突破,但其展现出的应用前景令人振奋。作为新兴的生物医学研究平台,类器官技术具有三大核心价值:精准模拟器官发育和疾病进程、作为新型药物筛选和评估工具、开创再生医学治疗新途径。可以预见,随着技术的不断成熟,类器官必将成为转化医学研究的重要基石,为精准医疗和个性化治疗开辟新的可能性。这项融合了干细胞生物学、组织工程和基因编辑等多学科优势的技术,正在重塑我们对人类疾病的认识和干预方式。
参考文献:
[1] Liu K., Fang X., Aazmi A., et al., (2024). Organoids: Principle, application and perspective. The Innovation Life 2(3): 100088.
[2] Wilson HV. A NEW METHOD BY WHICH SPONGES MAY BE ARTIFICIALLY REARED. Science. 1907 Jun 7;25(649):912-5.
[3] Corrò C, Novellasdemunt L, Li VSW. A brief history of organoids. Am J Physiol Cell Physiol. 2020 Jul 1;319(1):C151-C165..
[4] Evans M. Origin of mouse embryonal carcinoma cells and the possibility of their direct isolation into tissue culture. J Reprod Fertil. 1981 Jul;62(2):625-31.
[5] Li ML, Aggeler J, Farson DA,et al. Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells. Proc Natl Acad Sci U S A. 1987 Jan;84(1):136-40..
[6] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
[7] Wang W D, Zhou X, Fu W. Progress in the application of organoids in colorectal cancer research (in Chinese). Chin J Mini Invas Surg, 2017, 17: 1126–1128+1136.
[8] Sträter J, Wedding U, Barth TF, et al. Rapid onset of apoptosis in vitro follows disruption of beta 1-integrin/matrix interactions in human colonic crypt cells. Gastroenterology. 1996 Jun;110(6):1776-84.
[9] Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 2007 Oct 25;449(7165):1003-7.
[10] Ootani A, Li X, Sangiorgi E, Ho QT, et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 2009 Jun;15(6):701-6.
[11] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.
[12] Spence JR, Mayhew CN, Rankin SA, et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 2011 Feb 3;470(7332):105-9.
[13] van de Wetering M, Francies HE, Francis JM, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015 May 7;161(4):933-45.
[14] Fujii M, Matano M, Toshimitsu K, et al. Human Intestinal Organoids Maintain Self-Renewal Capacity and Cellular Diversity in Niche-Inspired Culture Condition. Cell Stem Cell. 2018 Dec 6;23(6):787-793.e6.
[15] 路小欢,徐鲁明,王星月,等.结直肠癌类器官的构建与应用进展[J].中华医学杂志, 2019, 99(36):3.
[16] BARKER N, VAN DE WETERING M, CLEVERS H. The intestinal stem cell[J]. Genes Dev, 2008, 22(14): 1856-1864.
[17] BARKER N, VAN ES J H, KUIPERS J, et al. Identification ofstem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449(7165): 1003-1007.
[18] CARMON K S, GONG X, LIN Q, et al. R- spondins function as ligands of the orphan receptors LGR4 and LGR5 to regulate Wnt/beta- catenin signaling[J]. Proc Natl Acad Sci USA, 2011, 108(28): 11452-11457.
[19] SATO T, VAN ES J H, SNIPPERT H J, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415-418.
[20] Takahashi Y, Sato S, Kurashima Y, et al. Reciprocal Inflammatory Signaling Between Intestinal Epithelial Cells and Adipocytes in the Absence of Immune Cells. EBioMedicine. 2017 Sep;23:34-45.
[21] 陆晓溪.阿克曼菌促进肠干细胞增殖缓解肠炎机制的研究[D].硕士学位论文.南 京: 南京农业大学,2020.
[22] Sato T, Stange DE, Ferrante M, et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 2011 Nov;141(5):1762-72.
[23] Gjorevski N, Sachs N, Manfrin A, et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 2016 Nov 24;539(7630):560-564.
[24] Lee SB, Han SH, Park S. Long-Term Culture of Intestinal Organoids. Methods Mol Biol. 2018;1817:123-135.
[25] Mahe MM, Sundaram N, Watson CL, et al. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. J Vis Exp. 2015 Mar 6;(97):52483.
[26] Pleguezuelos-Manzano C, Puschhof J, van den Brink S, et al. Establishment and Culture of Human Intestinal Organoids Derived from Adult Stem Cells. Curr Protoc Immunol. 2020 Sep;130(1):e106.
[27] Takahashi Y, Sato S, Kurashima Y, et al. A Refined Culture System for Human Induced Pluripotent Stem Cell-Derived Intestinal Epithelial Organoids. Stem Cell Reports. 2018;10(1):314-328.
[28] DROST J, CLEVERS H. Organoids in cancer research[J]. Nat Rev Cancer, 2018, 18(7): 407-418.
[29] DROST J, VAN JAARSVELD R H, PONDIOEN B, et al. Sequential cancer mutations in cultured human intestinal stecells[J]. Nature, 2015, 521(7550): 43-47.
[30] FESSLER E, DROAT J, VAN HOOFF S R, et al. TGFβ signaling directs serrated adenomas to the mesenchymal colorectal cancer subtype[J]. EMBO Mol Med, 2016, 8(7): 745-760.
[31] BARRETINA J, CAPONIGRO G, STRANSKY N, et al. The cancer cell line encyclopedia enables predictive modelling of anticancer drug sensitivity[J]. Nature, 2012, 483(7391): 603-607.
[32] BOJ S F, VONK A M, STAIA M, et al. Forskolin- induced swelling in intestinal organoids: an in Vitro assay for assessing drug response in cystic fibrosis patients[J]. J Vis Exp, 2017 (120): 55159.
[33] DIJKSTRA K K, CATTANEO C M, WEEBER F, et al. Generation of tumor-reactive T cells by co-culture of peripheral blood lymphocytes and tumor organoids[J]. Cell, 2018, 174(6): 1586- 1598.
[34] YUI S, NAKAMURA T, SATO T, et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5 + stem cell[J]. Nat Med, 2012, 18(4): 618-623.

查看更多

查看更多

查看更多

联系我们

返回顶部