查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是由糖尿病诱发的原发性心肌损伤,其发病机制复杂,或与心肌脂毒性和细胞死亡有关。DCM也是导致糖尿病患者死亡的主要原因。视黄醇(也称维生素A,Retinol,Rol)和全反式维甲酸(all-trans retinoic acid,atRA)是视黄醇代谢的产物,视黄醇脱氢酶(Retinol dehydrogenase 10,RDH10)是视黄醇代谢中的限速酶,在Rol转化为atRA中起重要作用。有研究表明,补充atRA有助于预防糖尿病大鼠的心肌损伤[1]。目前,Rol和atRA水平在糖尿病小鼠心脏中是否会发生改变?又是否与DCM有关?另外RDH10是如何参与其中?这些问题尚未得到阐明。
2023年3月2日,中山大学蔡卫斌教授及其团队在《nature communications》(IF=17.694)上发表了题为《Retinol dehydrogenase 10 reduction mediated retinol metabolism disorder promotes diabetic cardiomyopathy in male mice》的研究论文,该研究证实了心脏RDH10的减少是视黄醇代谢紊乱的始动因素,并通过引起心肌脂毒性和铁死亡导致DCM的发生发展。值得注意的是,作者使用了汉恒生物提供的腺相关病毒(AAV9),成功在db/db小鼠心脏中过表达了RDH10,助力作者阐明RDH10介导DCM的新机制。
下面我们一起来看看作者是如何挖掘其中的机制:
研究团队的前期研究表明,db/db小鼠模型不仅是2型糖尿病(type 2 diabetes mellitus,T2DM)模型,而且是一个非常好的DCM模型,具有心脏功能从代偿期到失代偿期变化的典型模式。作者首先分别对4周龄、24周龄和32周龄的db/db小鼠的心脏进行差异表达基因(differentially expressed genes,DEGs)分析,结果发现分别有1695、2584和2147个DEGs(fold change≥1.5),其中对应有643、1293和1153个基因表达上调,1052、1291和994个基因表达下调(图1 a)。接着,经KEGG和GO分类分析,显示这三组小鼠样本中共有215个DEGs发生显著变化(图1 b),且代谢途径(mmu01100)相关的基因最多(图1 c),其中Rol反应(GO:0033189)、视黄酸代谢途径(GO:0042573)和视黄醇代谢途径(GO:0042572)的显著富集(p < 0.001, q < 0.001)(图1 d)。
进一步分析DEGs中视黄醇代谢相关基因(mmu00830)的表达情况,结果显示与视黄酸合成相关的基因表达逐渐下调,而与视黄酸降解相关的基因表达逐渐上调(图1 e)。更重要的是,32周龄db/db小鼠心脏中Rol增加近一倍,atRA减少了一半,而RARα(视黄酸受体α)和RARβ显著降低(图1 f, g),表明T2DM小鼠的心脏中存在以Rol过载、atRA缺乏和RARs减少为特征的视黄醇代谢障碍。在T2DM患者的心脏中也发现RARs降低,提示患者心脏同样存在视黄醇代谢紊乱(图1 h)。
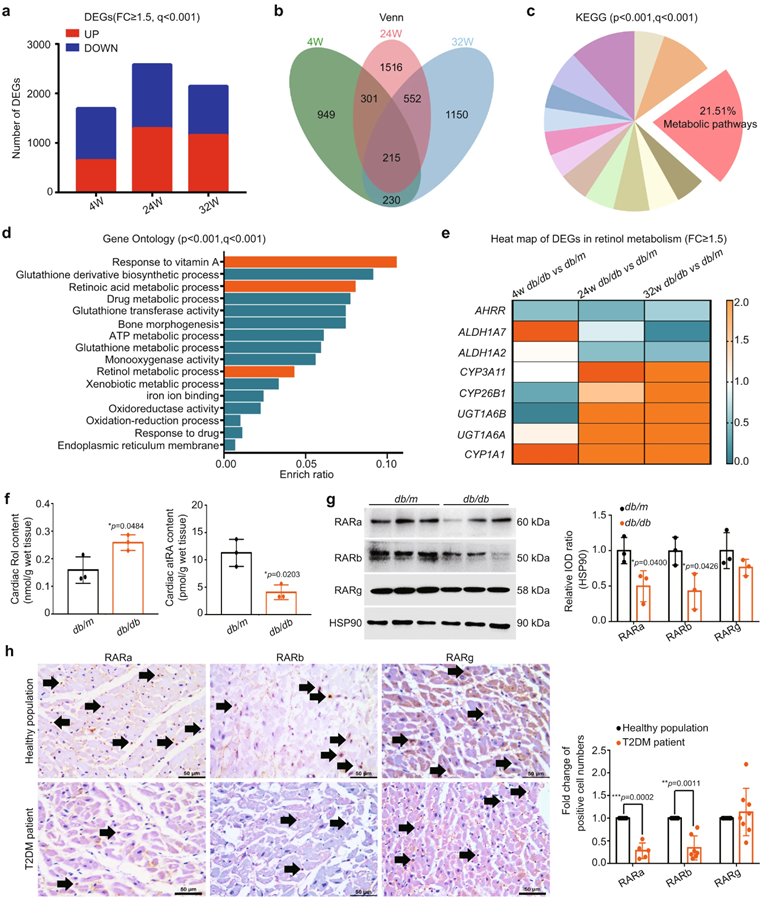
Fig 1. T2DM中心脏视黄醇代谢改变。(n表示生物学独立的动物)
为了证明Rol过载在DCM中的作用,作者设定了一个实验基线,在8周龄db/db小鼠出现稳定高血糖时开始补充Rol,同时开始测量体重、血糖和心功能直到基线后24周。结果发现,补充Rol的db/db小鼠出现了心力衰竭,心脏中的Rol显著增加,但atRA或视黄酸酯没有增加(图2 a-d);同时心脏重构加剧,包括心肌纤维化、细胞凋亡、肌纤维碎裂和心肌细胞线粒体增加(图2 e-g)。此外,作者发现Rol能降低db/db小鼠的高血糖、高胰岛素血症、胰岛素抵抗,并在一定程度上降低血脂异常(图2 h, i)。这些结果表明,Rol对db/db小鼠的心肌损伤不是通过加重糖尿病来实现的,而是由于心脏中Rol过载。
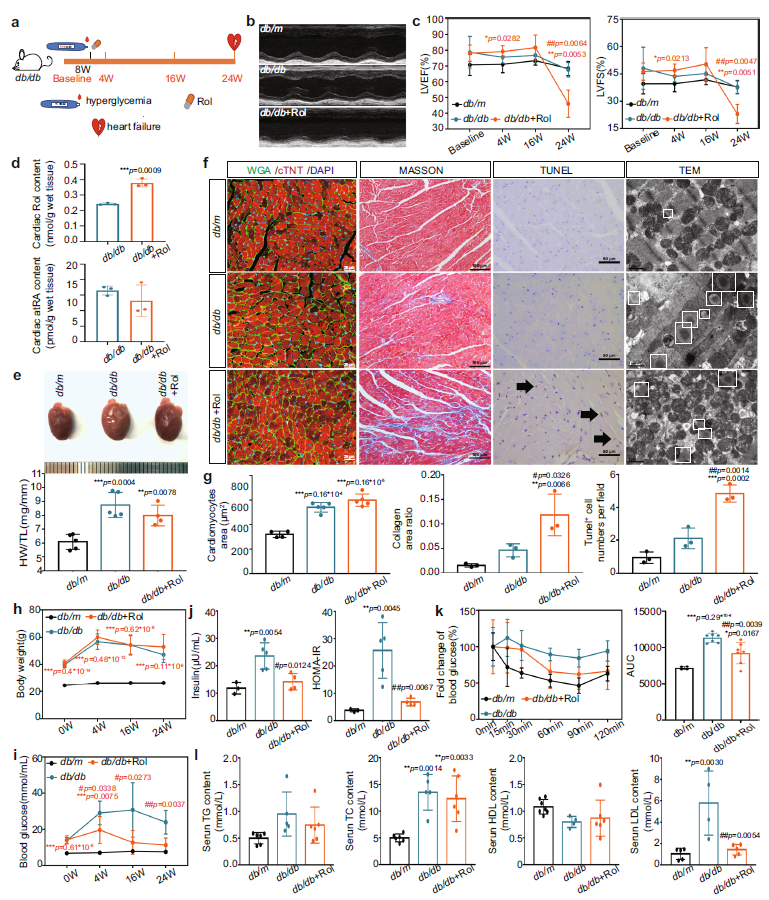
Fig 2. 补充Rol的T2DM小鼠心脏视黄醇代谢状态、结构、功能以及血清胰岛素和脂质。(n表示生物学独立的动物)
接着,作者给db/db小鼠补充atRA,使用同样的方法探讨atRA缺乏在DCM中的作用。在没有补充atRA的db/db小鼠中出现了心力衰竭(图3 a-c),而补充了atRA能恢复心脏atRA水平(图3 d),并减轻了心脏重构(图3 e-g),降低高胰岛素血症、胰岛素抵抗以及一定程度的血脂异常(图3 h, i)。这些结果提示,额外补充atRA可以通过恢复心脏atRA水平和改善全身代谢紊乱来预防T2DM小鼠的心肌损伤。
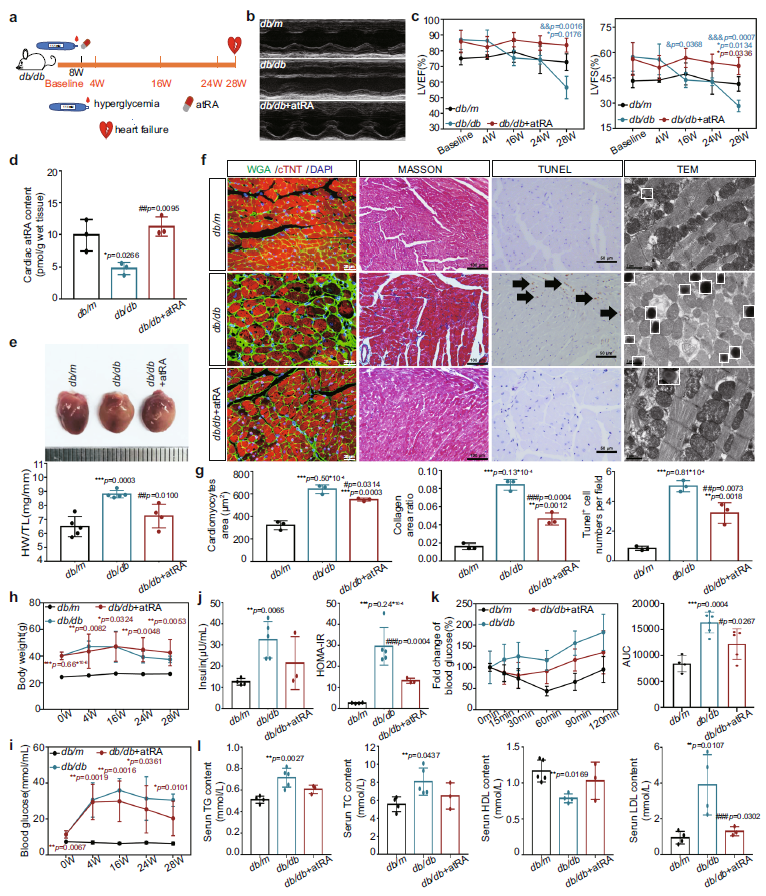
Fig 3. 补充有atRA的T2DM小鼠的心脏视黄醇代谢状态,结构和功能以及血清胰岛素和脂质。(n表示生物学独立的动物)
上述实验检测了给与Rol补充的db/db小鼠的心脏中Rol和atRA水平(图1 f和图2 d)表明,T2DM小鼠心脏中Rol向atRA转换受阻。随后作者检测了RDH10的表达,发现RDH10呈先增加后减少的趋势(补充图3 a, b, d),并且活性也显著降低(补充图3 c)。同时,发现T2DM患者心脏RDH10也明显减少(补充图3 d)。结果提示RDH10可能与T2DM中心脏视黄醇代谢紊乱及其引起的DCM密切相关。
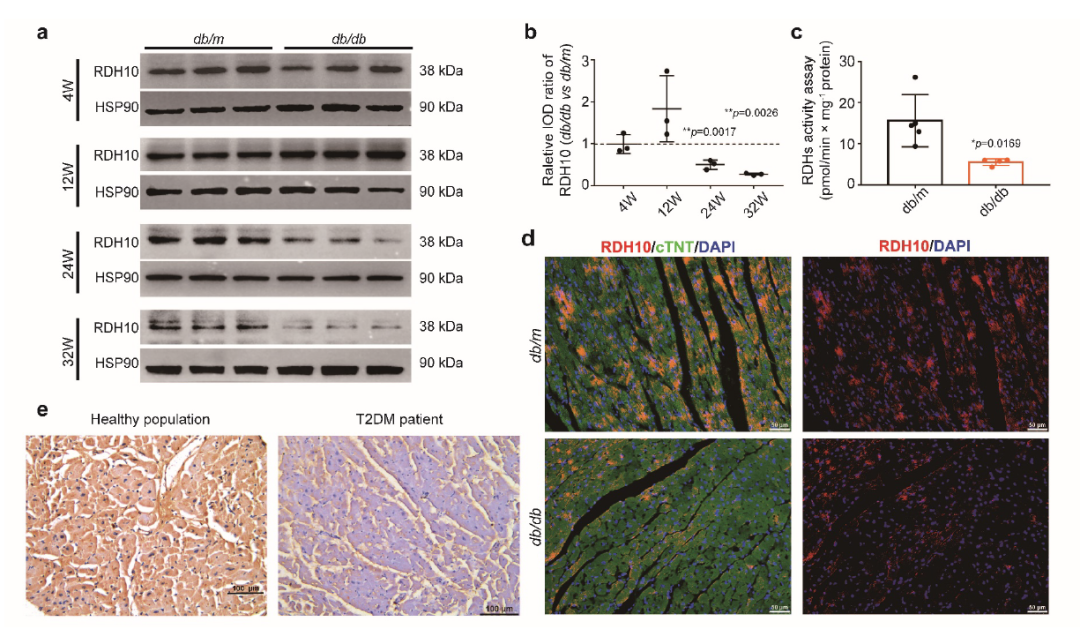
补充材料 图3. RDH10在T2DM小鼠和患者中表达情况。
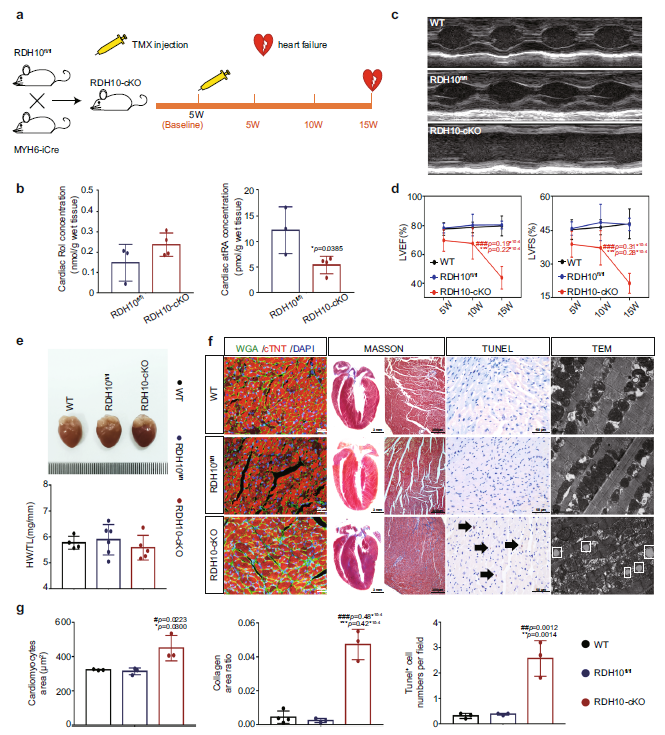
Fig 4. 心肌细胞条件性RDH10基因敲除小鼠的心脏视黄醇代谢状态、结构和功能。(n 表示生物学独立动物)
接着,作者探讨了RDH10和心脏视黄醇代谢在DCM中的作用。作者在实验基线后8周给db/db小鼠注射AAV9-RDH10,实现了心脏过表达RDH10,并在5周后恢复到与db/m小鼠相当的水平(图5 a)。同时,AAV9-RDH10减轻了db/db小鼠心脏视黄醇代谢紊乱(图5 b),预防了心力衰竭(图5 c, d),减轻了心肌损伤(包括心肌肥大、纤维化、细胞凋亡、脂质沉积以及线粒体数量)(图5 e-g)。结果提示RDH10减少和心脏视黄醇代谢紊乱是T2DM患者发生DCM的主要原因。
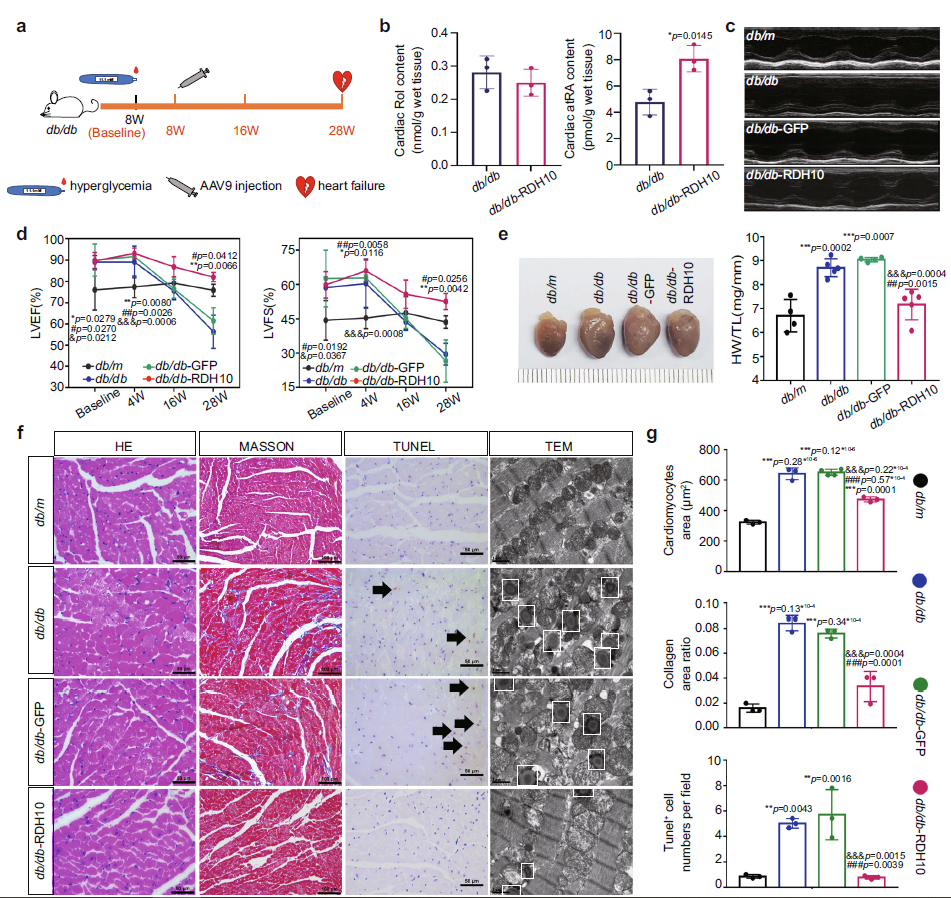
Fig 5. 注射AAV9-RDH10的T2DM小鼠的心脏视黄醇代谢状态、结构和功能。(n表示生物学独立的动物)
已有研究表明DCM的心脏脂质沉积与游离脂肪酸(FFAs)过度摄取有关,而FFAs的摄取主要由脂肪酸转位酶(FAT/CD36)介导[2-4]。前面的结果也提示着DCM中RDH10、视黄醇代谢紊乱和心肌脂毒性之间可能存在联系(图2-5 f)。通过油红O染色和心脏甘油三酯(TG)的检测,发现RDH10表达减少增加了db/db小鼠心肌的脂肪沉积和TG水平,而过表达RDH10可以拮抗这一过程,其中是atRA参与发挥了主要作用而不是Rol(图6 a-f)。这表明RDH10的减少及其导致的视黄醇代谢紊乱使得atRA缺乏,从而促进T2DM的心脏脂毒性。对于新生小鼠原代心肌细胞(NMPC)脂质沉积的检测,验证这一结论;并且AGN193109(RARs抑制剂)可阻断atRA的积极影响(图6 g)。此外,RDH10的抑制通过减少atRA来促进CD36的表达,增加了心脏FFAs摄取;在补充atRA后可逆转这一现象(图6 h-j)。这些结果表明,心脏RDH10减少通过降低心脏中atRA的水平来增加其脂质沉积和FFAs摄取,从而促进T2DM患者的心肌脂毒性。
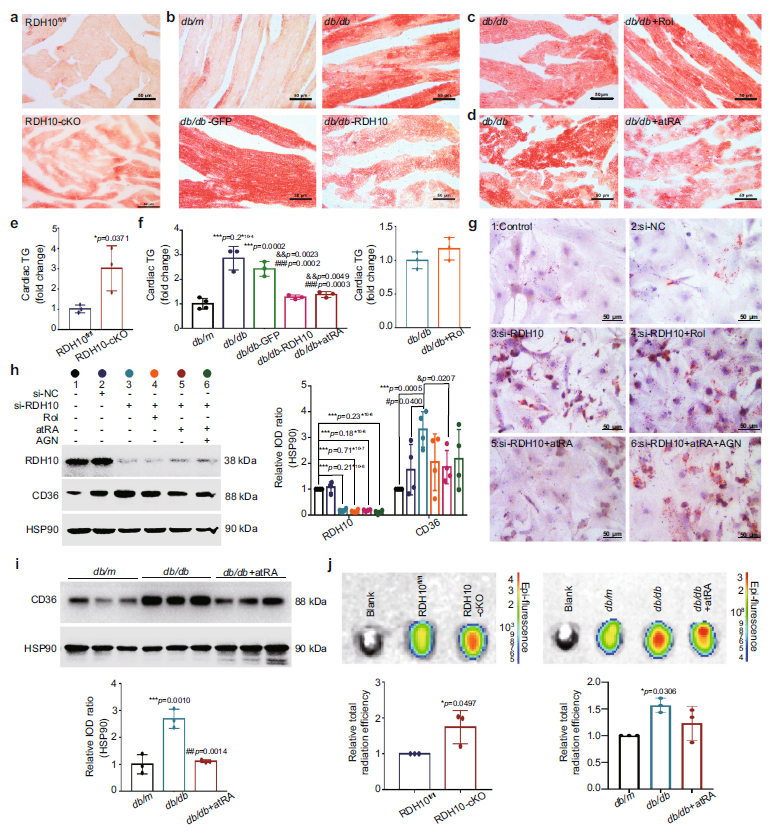
Fig 6. RDH10减少诱导的视黄醇代谢紊乱通过使atRA缺乏介导T2DM小鼠脂质蓄积和FFAs摄取增加,促进心脏脂毒性(e,f,i和j中n表示生物学独立的动物;而h中n表示独立实验)。
铁死亡是依赖于铁催化的脂质过氧化,并参与DCM的病变[5-6]。作者验证了T2DM患者的心脏中也发生了铁死亡。有研究表明,atRA可预防铁过载引起的肝损伤,表明视黄醇代谢与铁死亡之间存在联系[7]。作者随即检测了RDH10-cKO小鼠心脏中脂质过氧化相关标志物的表达水平,发现4-羟基壬烯酸(4-HNE)和丙二醛(MDA)升高(图7 a-d);但在给与铁死亡抑制剂ferrostatin-1(Fer-1)治疗后,不仅抑制了心脏4-HNE的积累,还挽救了小鼠的心力衰竭(图7 e-h);结果表明脂质过氧化引起的铁死亡参与了RDH10-cKO小鼠的心肌损伤。作者进一步探究了心脏视黄醇代谢紊乱中与铁死亡相关的脂质过氧化标志物。结果显示,在RDH10-cKO小鼠的心脏中谷胱甘肽过氧化物酶4(GPX4)和铁死亡抑制蛋白1(FSP1)表达下调(图7 i),DHODH和SLC7A11没有变化;而在NMPC中atRA逆转了GPX4和FSP1的下调,可以被AGN193109阻断(图7 j, k)。这表明心脏视黄醇代谢紊乱使atRA减少通过抑制GPX4和FSP1表达,促进了脂质过氧化,导致心脏发生铁死亡。此外,在db/db小鼠中过表达RDH10和补充atRA,逆转了其心脏GPX4、FSP1的表达,并显著减少了脂质过氧化水平(图7 l, m)。结果提示视黄醇代谢紊乱使atRA减少,进而抑制GPX4和FSP1表达,促进了铁死亡。
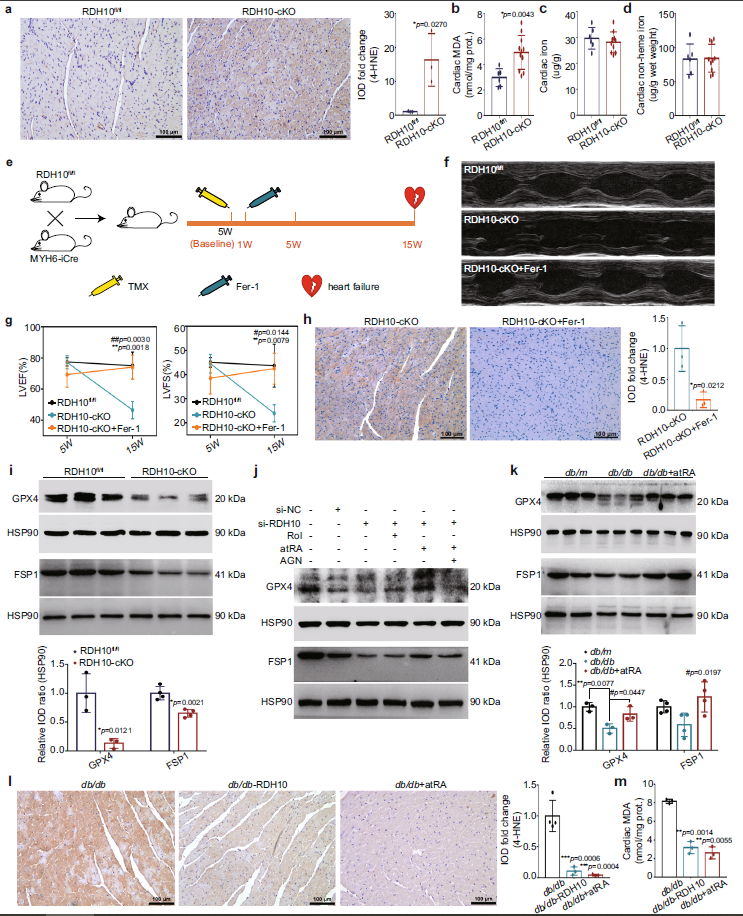
Fig 7. RDH10减少诱导的视黄醇代谢紊乱通过使atRA缺乏介导GPX4在T2DM心脏中减少,促进铁死亡。(n表示生物学独立的动物)
T2DM小鼠心脏铁死亡也表现出了铁的蓄积,但RDH10-cKO小鼠没有(图7 c, d)。随后作者给与RDH10-cKO小鼠高铁饮食喂养三周后,出现了心力衰竭和心脏铁蓄积(图8 a-e)。重要的是,注射AAV-RDH10和补充atRA可显著抑制db/db小鼠心脏的铁蓄积(图8 f, g)。同时还检测了转铁蛋白受体(TFRC)和铁转运蛋白1(FPN1)的水平,发现心脏视黄醇代谢变化只改变了FPN1的表达(图8 h),而不改变TFRC。此外,atRA与核RARs相互作用后可作为转录因子,影响视黄醇代谢变化中GPX4、FSP1和FPN1的转录水平。总之,在T2DM中,RDH10的减少抑制了心脏atRA-RARs复合物的形成,导致GPX4、FSP1和FPN1表达下调,促进铁死亡。
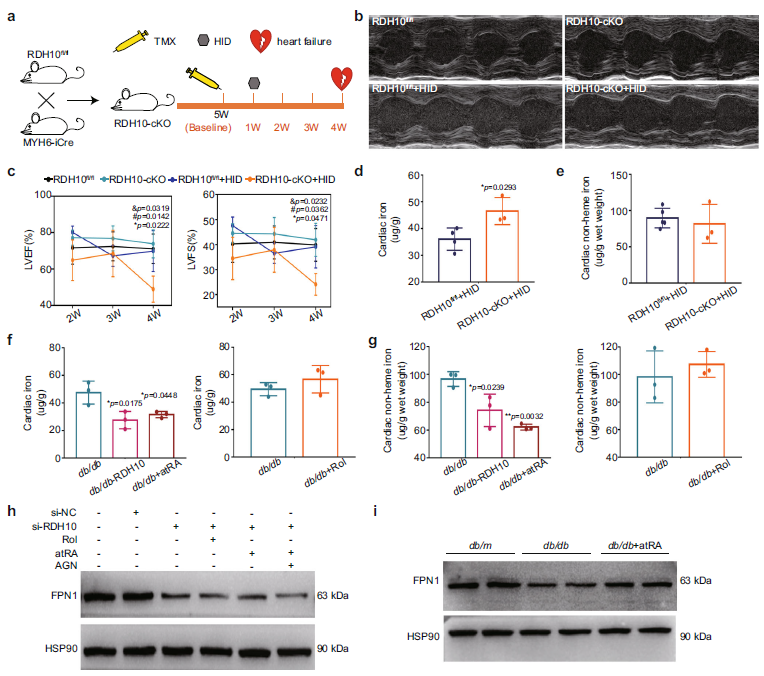
Fig 8. RDH10减少诱导的视黄醇代谢紊乱使T2DM心脏中atRA缺乏促进铁蓄积。(n表示生物学独立的动物)
综上所述,作者报道了在T2DM中,RDH10减少会导致心脏视黄醇代谢紊乱,主要特征表现为Rol过载、atRA缺乏和RARs减少,并通过Rol过载引起的心脏毒性和atRA引起的脂毒性和铁死亡促进DCM病变。作者研究提示,RDH10和atRA可能是通过逆转视黄醇代谢紊乱来预防和治疗DCM的潜在靶标,且Rol过量对心脏有害,因此T2DM患者应避免使用。
参考文献:
[1] Guleria, R. S., Choudhary, R., Tanaka, T., Baker, K. M. & Pan, J. Retinoic acid receptor-mediated signaling protects cardiomyocytes from hyperglycemia induced apoptosis: role of the reninangiotensin system. J. Cell. Physiol. 226, 1292–1307 (2011).
[2] Sowton, A. P., Griffin, J. L. & Murray, A. J. Metabolic profiling of the diabetic heart: toward a richer picture. Front. Physiol. 10, 639 (2019).
[3] Glatz, J. F., Luiken, J. J. & Bonen, A. Membrane fatty acid transporters as regulators of lipid metabolism: implications for metabolic disease. Physiol. Rev. 90, 367–417 (2010).
[4] Luiken, J. J. et al. Contraction-induced fatty acid translocase/CD36 translocation in rat cardiac myocytes is mediated through AMPactivated protein kinase signaling. Diabetes 52, 1627–1634 (2003).
[5] Ni, T., Huang, X., Pan, S. & Lu, Z. Inhibition of the long non-coding RNA ZFAS1 attenuates ferroptosis by sponging miR-150-5p and activates CCND2 against diabetic cardiomyopathy. J. Cell. Mol. Med. 25, 9995–10007 (2021).Tsuchiya, H. et al. Suppressive effects of retinoids on iron-induced oxidative stress in the liver. Gastroenterology 136, 341–350.e348 (2009).
[6] Wang, X. et al. Ferroptosis is essential for diabetic cardiomyopathy and is prevented by sulforaphane via AMPK/NRF2 pathways. Acta Pharm. Sin. B. 12, 708–722 (2022).
[7] Tsuchiya, H. et al. Suppressive effects of retinoids on iron-induced oxidative stress in the liver. Gastroenterology 136, 341–350.e348 (2009).

查看更多

查看更多

查看更多

联系我们

返回顶部