查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
PHx(Partial hepatectomy,部分肝切除术)和肝移植是多种终末期肝病唯一可用的有效治疗手段。术后肝脏再生能力是肝功能恢复的重要保障,但目前仍缺乏有效的促进肝脏再生的临床药物。因此,寻找可促进PHx后良性肝脏增大与再生的药物及明确相关作用机制具有重要价值。

2024年3月26日,南方医科大学药学院毕惠嫦教授在Acta Pharmaceutica Sinica B(IF=14)发表了题为《Fenofibrate-promoted hepatomegaly and liver regeneration are PPARa-dependent and partially related to the YAP pathway》的研究论文。该研究揭示了非诺贝特促进肝脏增大和再生依赖于PPARa的激活,并与YAP信号激活部分相关。作者前期研究发现PPARa激活可通过与YAP信号通路相互作用诱导肝脏增大及再生。非诺贝特是一种PPARa激动剂,已广泛用于治疗高脂血症,有研究表明它在各种肝脏疾病中也具有治疗潜力,但其对肝脏增大和再生的影响及其机制尚不清楚。本研究中作者借助野生型小鼠、肝细胞PPARa敲除小鼠PPARaΔHep及部分肝切除PHx小鼠模型,证明了非诺贝特对于肝脏的再生作用依赖于肝细胞PPARa,并通过调节YAP泛素化和提高YAP-TEAD互作和转录活性来促进肝脏增大和再生。利用抑制 YAP-TEAD互作的维替泊芬或利用AAV-YAP-shRNA-EGFP(汉恒生物提供)敲低YAP可显著降低非诺贝特诱导的肝增大。此外,其它因子如MYC、KRT23、RAS和 RHOA也可能参与非诺贝特诱导的肝脏增大与再生作用。这些研究为非诺贝特作为促进肝脏再生的新型药物提供了证据。

接下来,我们一起来看看作者的研究结果:
1.非诺贝特引起的肝增大依赖于PPARa
首先,为了评估非诺贝特对肝脏大小的影响,作者对C57BL/6小鼠注射不同剂量的非诺贝特。分析发现相对于对照组,非诺贝特处理组肝脏/体重比值升高,肝脏变大(图1B),且HE染色未发现非诺贝特注射造成肝损伤(图1C),相关生化指标和炎症因子水平正常。进一步采用CTNNB1免疫染色分析肝细胞大小,发现非诺贝处理组中心静脉(CV)周围的细胞明显增大(图1D和E)。KI67染色测定增殖肝细胞的数量,发现非诺贝特处理组显著提高了门静脉(PV)区附近KI67 +细胞的比例(图1D和E)。据报道,非诺贝特是一种PPARa激动剂,且PPARa激活可以促进肝细胞增殖和肝肿大。因此,作者测量了PPARa下游蛋白的表达,发现非诺贝特处理组ACOX1和CYP4A表达上调(图1F和G),表明PPARa在非诺贝特处理后被激活。
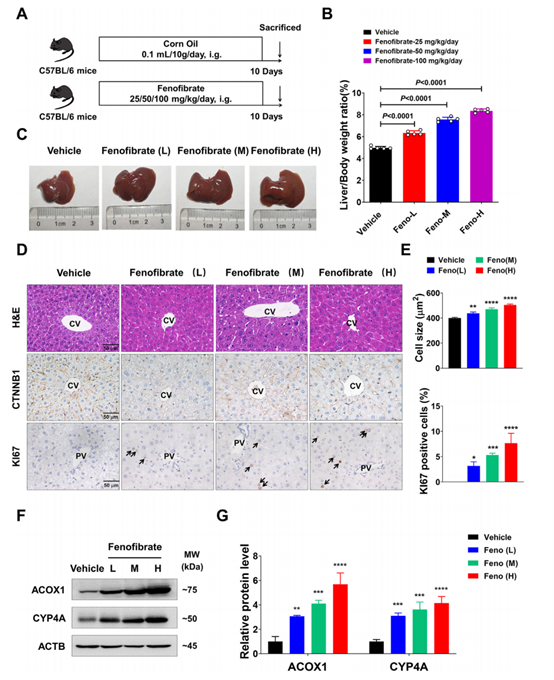
图1. 非诺贝特诱导C57BL/6小鼠肝增大
已有研究表明,肝细胞表达的PPARa,而非非实质细胞表达的PPARa,是激动剂诱导肝细胞增殖的主要因素。因此,作者使用肝细胞特异性敲除PPARa的小鼠(PPARaΔHep)来评估肝细胞PPARa在非诺贝特诱导的肝增大中的作用。与PPARaΔHep小鼠相比,非诺贝特显著增加了PPARafl/fl小鼠的肝脏/体重比(图2A-C)。H&E染色及生化指标检测显示,非诺贝特处理后肝脏无明显损伤(图2D和E),炎症因子水平无变化。另外,相比于非诺贝特PPARaΔHep小鼠组,非诺贝特PPARafl/fl小鼠组CV区周围的肝细胞增大,PV区周围的KI67+细胞增加(图2E和F)。且ACOX1和CYP4A在非诺贝特处理的PPARafl/fl小鼠中表达上调,PPARaΔHep小鼠中无变化。这些结果表明,肝细胞中表达的PPARa在非诺贝特诱导的肝增大中起主导作用。
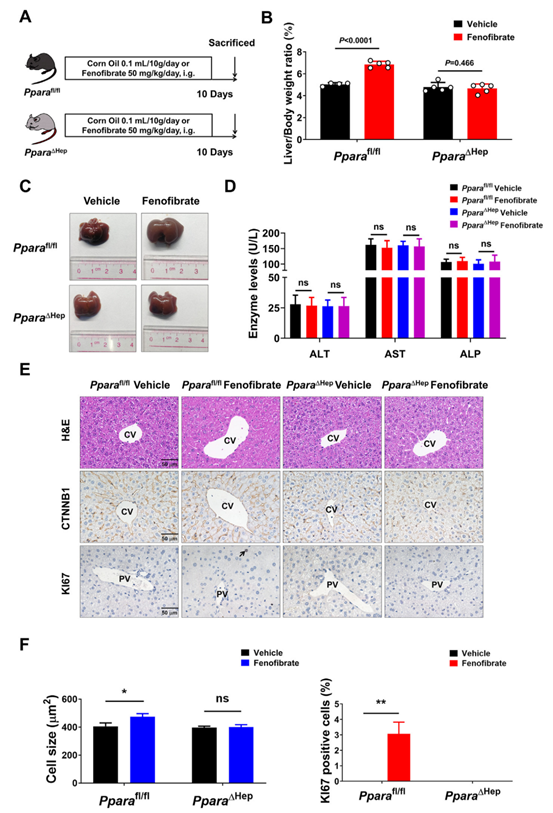
图2. 肝细胞特异性PPARa敲除抑制非诺贝特诱导的肝增大
2.非诺贝特通过激活PPARa促进肝脏再生
为了清楚肝细胞PPARa在非诺贝特促进肝再生中的作用,作者对PPARaΔHep和PPARafl/fl小鼠进行了2/3 PHx,并用非诺贝特处理两天。同样的,与PPARaΔHep小鼠组相比,非诺贝特促进了PPARafl/fl小鼠肝脏大小和肝脏/体重比增加(图3B和C)。且H&E染色和生化指标检测表明没有引起明显的肝损伤(图3D和E),炎症因子水平表达没有明显变化。PPARafl/fl小鼠组CV区周围肝细胞增大,PV区周围细胞增殖活性增加(图3E和F),ACOX1和CYP4A表达上调。以上结果表明,非诺贝特以肝细胞PPARa依赖的方式加速肝重恢复、促进肝细胞增大和增殖,可能有助于促进术后肝脏再生。

图3. PHx后非诺贝特可促进肝再生,但肝细胞特异性PPARa敲除抑制非诺贝特诱导的肝再生
3.非诺贝特调节YAP泛素化并促进YAP-TEAD互作
YAP信号级联在控制肝脏生长和再生中起关键作用。作者早期研究发现,由WY-14643引起的PPARa激活通过YAP-TEAD途径刺激肝脏增大和再生。YAP是一种转录共激活因子,主要与TEAD转录因子相互作用,促进CTGF、CYR61、ANKRD1等下游靶点的表达(图4A)。为了探究YAP是否与非诺贝特诱导的肝脏增大和再生有关,作者测量了不同小鼠模型中YAP及其下游靶点的表达水平。PPARafl/fl和PHx小鼠组中非诺贝特处理显著上调YAP及其下游靶点CTGF、CYR61和ANKRD1的表达(图4B-G);且核质分离分析发现胞核YAP水平上调,胞质磷酸化的p-YAP水平下调(图4D-G),表明YAP信号的激活。然而PPARaΔHep小鼠组非诺贝特处理未明显改变YAP信号通路相关蛋白,这说明肝细胞中PPARa的敲除影响了非诺贝特诱导的YAP激活。除磷酸化外,YAP活性还受到泛素化影响。已有研究证明YAP通过K48连接的泛素化修饰进行降解,K63连接的泛素化修饰促进其转录活性并刺激其促进生长的作用。检测发现非诺贝特处理后,K48连接的YAP多泛素化修饰下调,而K63连接的YAP多泛素化修饰上调(图4I和J),表明非诺贝特通过抑制YAP K48连接的泛素化修饰并增强K63连接的泛素化修饰来促进YAP的活性。由于YAP通常与TEAD相互作用调控靶基因表达,作者结合Co-IP及荧光素酶报告实验发现(图4K和L),非诺贝特可促进YAP和TEAD之间的相互作用,并提高其转录活性。以上结果表明非诺贝特可调节YAP泛素化并促进YAP-TEAD活性。
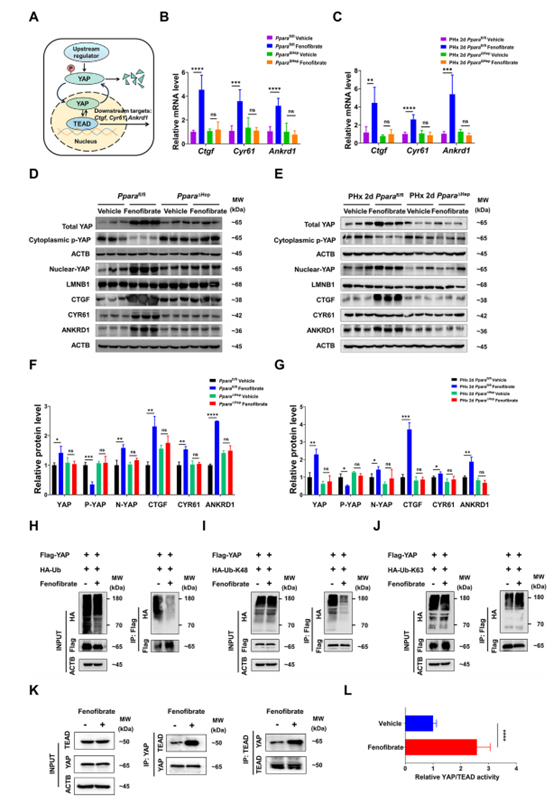
图4. 非诺贝特调控YAP信号通路
4.YAP-TEAD互作有助于非诺贝特诱导的肝增大
为了进一步明确是否YAP-TEAD互作促进非诺贝特诱导的肝脏增大,作者给予小鼠维替泊芬(抑制YAP-TEAD互作的化合物)处理。结果表明,维替泊芬处理可破坏YAP-TEAD相互作用(图5C),并显著减轻非诺贝特诱导的肝脏增大(图5D和E),且减弱了CV区附近的肝细胞增大和PV区周围的肝细胞增殖(图5F和G)。表明YAP-TEAD相互作用对非诺贝特诱导的肝脏增大至关重要。
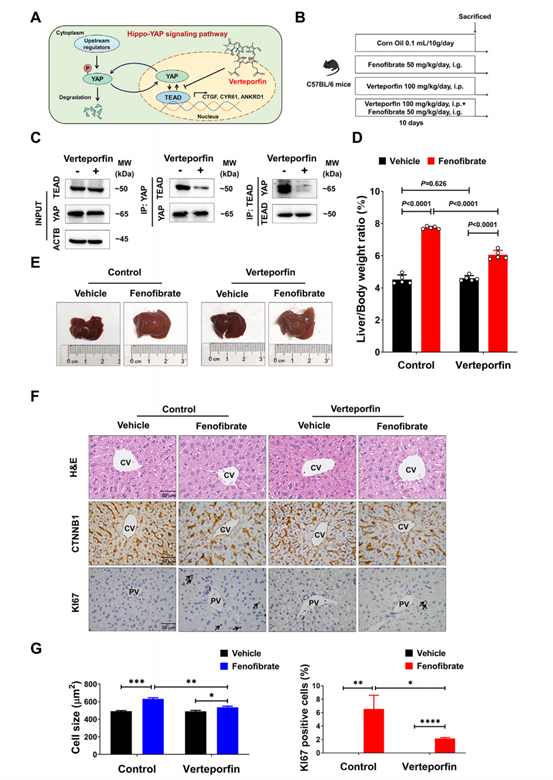
图5. 抑制YAP-TEAD互作减弱非诺贝特诱导的肝增大
5.非诺贝特诱导的肝增大与YAP部分相关
为了进一步研究YAP在非诺贝特诱导的肝脏增大中的作用,作者利用汉恒生物提供的AAV-Control-EGFP和AAV-YAP-shRNA-EGFP腺相关病毒来敲低小鼠肝脏YAP(图6B和C)。非诺贝特在AAV对照小鼠和AAV YAP shRNA小鼠中均诱导了显著的肝脏增大,但是AAV YAP shRNA小鼠的平均肝脏/体重比低于AAV对照小鼠(6.45%和8.56%,P < 0.0001)。此外,无非诺贝特处理的AAV YAP shRNA小鼠中观察到肝脏大小略有减少,这表明YAP参与维持正常肝脏大小(图6D和E)。两组小鼠CV区附近肝细胞均增大,PV区周围肝细胞增殖增加,但YAP敲低组增加水平不如对照组(图6F和G)。因此,以上实验表明非诺贝特诱导的肝脏增大与YAP部分相关。
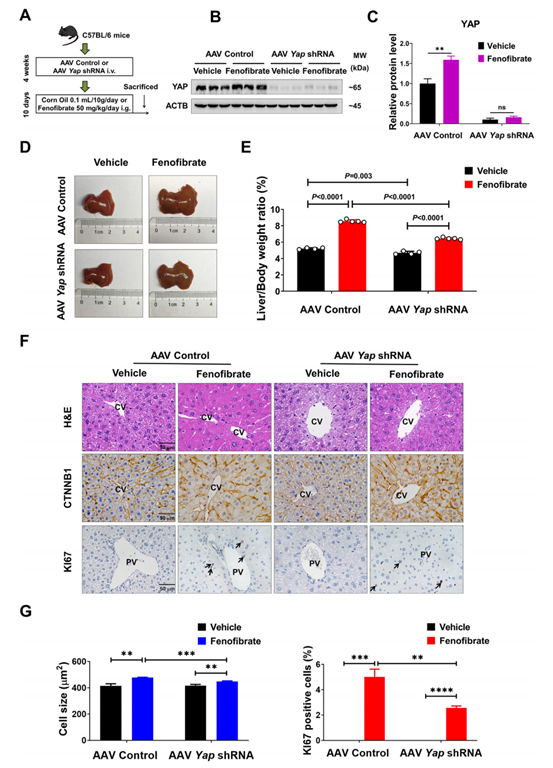
图6. 敲低肝脏YAP抑制非诺贝特诱导的肝增大
6.与非诺贝特诱导的肝增大与再生相关的其它因素
由于前面实验发现YAP-TEAD药理抑制或YAP敲低可减轻但不能完全消除非诺贝特引起的肝脏增大,因此作者假设可能有其它因素参与非诺贝特诱导的肝脏增大和再生。作者检测 PPARa诱导的肝脏增大和再生中的相关因子MYC、KRT23、KRAS和RHOA的表达水平,发现其在非诺贝特处理的对照和YAP敲低小鼠组中均有上调;另外,YAP敲低减弱了非诺贝特对MYC、KRT23和RHOA的诱导(图7A-C),表明YAP可能参与了非诺贝特对这些基因的诱导。作者也检测了PHx小鼠中MYC、KRT23、KRAS和RHOA的表达,其在非诺贝特处理后也上调(图7D-E)。以上数据表明,除YAP信号外,MYC、KRT23、RAS和RHOA等其它因子也可能参与非诺贝特诱导的肝增殖。
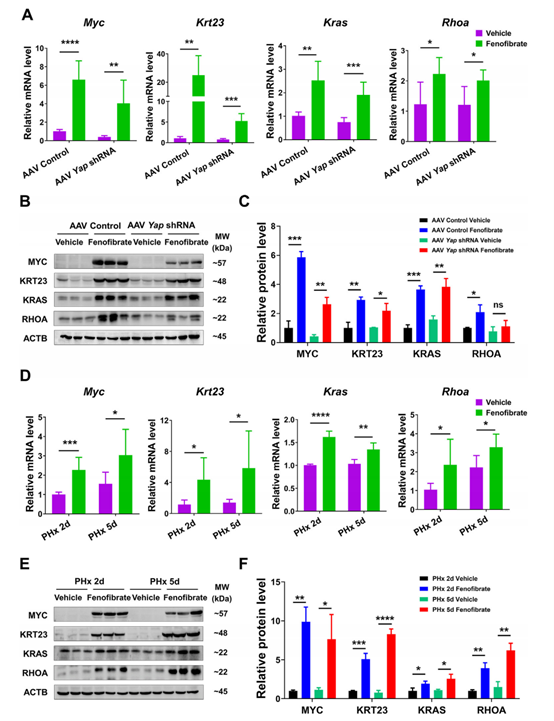
图7. 其它因子参与非诺贝特诱导的肝增大与再生
以上研究表明,非诺贝特诱导的肝脏增大与再生依赖于肝细胞的PPARa,通过抑制K48连接的YAP泛素化,促进K63连接的YAP泛素化,增强YAP-TEAD的相互作用和转录活性来激活YAP信号。抑制YAP-TEAD相互作用或抑制肝脏YAP表达可显著抑制非诺贝特诱导的肝增大,表明YAP信号在这一过程中的重要作用。其它因素,如MYC、KRT23、RHOA和RAS,也有助于非诺贝特诱导的肝增大。这些发现为非诺贝特作为促进PHx后肝脏再生的潜在药物提供了新的见解。
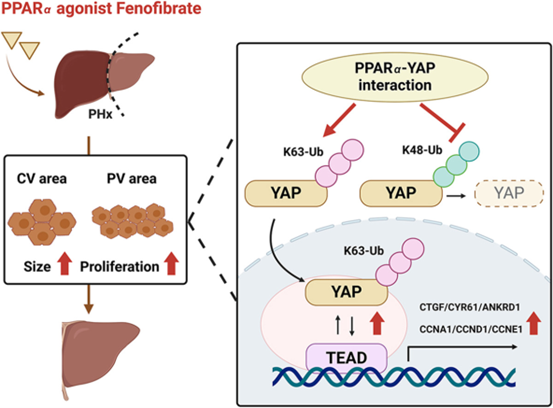
图8. 非诺贝特诱导肝增大与再生的作用机制
原文链接:https://www.sciencedirect.com/science/article/pii/S2211383524001230#sec2

查看更多

查看更多

查看更多

联系我们

返回顶部