查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
恶病质(Cachexia),在医学上指人体显著消瘦、贫血、精神衰颓等全身机能衰竭的现象,脂肪和肌肉组织的丧失是恶病质的主要表现,多由癌症和其他严重慢性病引起。其中以肿瘤伴发的恶病质最为常见,称为肿瘤恶病质,影响50-80%的癌症患者,占癌症相关死亡的20%。肿瘤恶病质患者会出现虚弱、厌食、贫血和疲劳,导致生活质量下降和对癌症治疗的耐受性差。虽然肿瘤恶病质体现了一种突出的未满足的医疗需求,但其潜在机制知之甚少。

2024年3月18日,北京大学肖瑞平团队和胡新立团队联合在Nature Metabolism上在线发表了题为“Activation of GPR81 by lactate drives tumour-induced cachexia”的研究论文。研究发现循环乳酸水平与肿瘤恶病质患者(包括男性和女性)的体重减轻程度呈正相关,该结果在临床相关的动物模型中也得到验证。同时研究发现乳酸输注可以在无肿瘤小鼠中以剂量依赖的方式触发恶病质表型。进一步的研究表明,特异性敲除脂肪细胞中的GPR81,能缓解乳酸诱导或肿瘤诱导的脂肪和肌肉消耗,这一现象与全身GPR81缺失的表型相似,从而确认脂肪组织中的GPR81是乳酸促分解代谢效应的主要介体。从机制上讲,乳酸/ GPR81介导的恶病质并不依赖于已建立的蛋白激酶A降解通路,而是通过激活Gi-Gβγ-RhoA/ROCK1-p38信号级联反应来实现。该研究结果首次发现乳酸与肿瘤和脂肪分解代谢及随后的肌肉萎缩之间存在必要且充分的联系,揭示了乳酸-GPR81信号传导是肿瘤恶病质的潜在治疗靶点。
值得注意的是,在本研究中作者使用了汉恒生物提供的Ad-Cre腺病毒,成功在KrasLSL-G12D/+;p53R172H/+小鼠肺组织中实现了Kras G12D基因的条件性表达。
下面,我们一起来了解具体的研究内容:
1,癌症恶病质导致循环乳酸水平升高
为了探究与恶病质相关的全身代谢的变化,作者利用Lewis肺癌细胞系(LLC)建立了小鼠异种移植模型,研究结果显示:与对照组(Control)比较,肿瘤组(LLC-TB)小鼠的体重显著降低,白色脂肪组织(WAT)和骨骼肌质量也显著下降(LLC-TB组小鼠腹股沟WAT(iWAT)质量的减少在LLC植入后12天被检测到,骨骼肌质量的减少在LLC植入后18天被检测到)。接着,作者对两组小鼠的血清进行非靶向代谢组学分析,结果显示Control组和LLC-TB组小鼠血清样本的代谢物有明显的差异,并且在差异代谢物中,乳酸含量的变化最显著。重要的是,随着肿瘤的生长,循环乳酸的水平逐渐升高且与LLC-TB小鼠的体重变化呈正相关,并且研究结果显示这一现象并不是由于主要器官摄取乳酸减少而导致的。此外,作者通过小鼠尾静脉注射LLC建立小鼠原位肺癌模型,结果显示,与对照组(Control)小鼠相比,肿瘤组(LLC)小鼠血清中乳酸含量显著增加,脂肪和骨骼肌质量显著减少,与前面结果一致。为了更好的模拟患者的癌症恶病质,作者使用KrasLSL-G12D/+;p53R172H/+小鼠通过鼻腔内给予Ad-Cre腺病毒,建立自发性肺癌小鼠模型。与对照组相比(KrasLSL-G12D/+;p53R172H/+;null),实验组组(KrasLSL-G12D/+;p53R172H/+;cre)小鼠体重明显减轻,血液中乳酸的含量显著增加;在给予Ad-Cre病毒8周后,实验组小鼠的肺部有明显的肿瘤结节;此外,与对照组小鼠相比,实验组小鼠还表现出恶病质的典型特征,包括WAT、棕色脂肪组织(BAT)和骨骼肌质量减少,以及握力减弱,能量消耗增加。更重要的是,原发性肺癌小鼠的血液乳酸含量与体重变化密切相关。为了进一步探究乳酸在人类癌症恶病质中的临床相关性,作者收集了肺腺癌患者的血清,主成分分析结果显示:有恶病质患者与无恶病质患者相比,血清代谢物存在显著差异,其中恶病质患者的血清乳酸水平显著高于无恶病质患者的血清乳酸水平,且血清乳酸水平与体重减轻密切相关。此外,肿瘤患者通过手术切除肿瘤后,血清乳酸水平显著下降,表明肿瘤是血清乳酸升高的主要原因。为了验证上述现象也出现在其他类型的癌症,作者通过在C57BL/6J、BALB/c和BALB/c裸鼠的皮下接种小鼠黑色素瘤细胞B16-F10(B16)、小鼠乳腺癌细胞EMT6和人胰腺癌细胞MIA PaCa-2(MIA)构建不同的肿瘤模型。在三种肿瘤模型中,注射B16细胞的小鼠血清乳酸水平升高最显著,体重减轻最多(约10%),并且在第14天时脂肪组织和骨骼肌质量均显著下降;注射EMT6细胞的小鼠血清乳酸水平表现出中等程度升高,这与相对温和的恶病质表型有关;注射MIA细胞2周后,尽管肿瘤重量与测试的其他癌细胞系产生的肿瘤重量相似,但是小鼠乳酸水平没有变化,体重或 WAT 或骨骼肌质量也没有减少。综上研究结果显示:在肺腺癌患者和动物模型中,肿瘤引起的恶病质都伴随着循环乳酸的增加,即癌症恶病质导致循环乳酸水平升高。
2,循环乳酸水平升高可以诱发癌症恶病质表型
为了确定乳酸在引发恶病质中的作用,作者利用渗透泵使小鼠血液中的乳酸水平保持在1.5mmol/l或者2 mmol/l(相当于恶病质患者血清的乳酸水平升高了50%或者与携带LLC肿瘤的恶病质小鼠的血清乳酸水平相同),经过7天的输注后,L-乳酸以剂量依赖的方式导致小鼠体重减轻以及脂肪重量减轻,但D-乳酸没有产生类似的影响,表明L-乳酸可以诱导小鼠体重减轻和脂肪消耗。此外,长达14天的L-乳酸输注进一步降低了小鼠体重以及脂肪组织质量,并且14天的乳酸输注后,可以观察到小鼠骨骼肌的消耗。总之,这些实验结果表明:乳酸会引发与癌细胞诱导的相似脂质代谢重编程。因此,乳酸不仅是癌症恶病质的特征代谢物,还是癌症诱导的高分解代谢表型的关键介质。
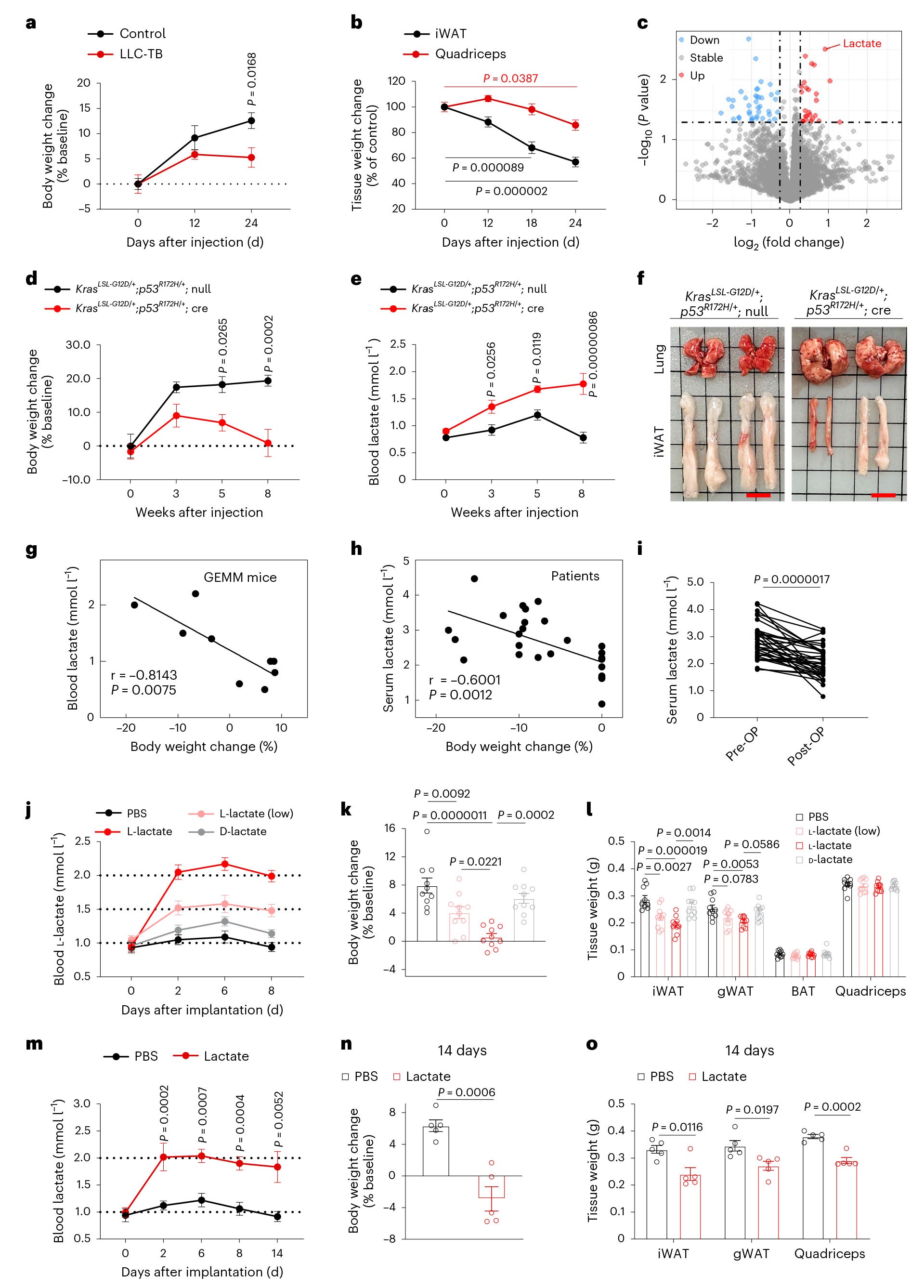
图1 乳酸诱导恶病质表型
3,乳酸通过GPR81诱导癌症恶病质表型
脂肪线粒体解偶联蛋白1(UCP1)的上调是WAT褐变的标志物,是恶病质的一个关键特征。为了进一步探究乳酸介导癌症恶病质的发病机制,作者通过免疫组织化学染色检测到乳酸输注增加了小鼠脂肪组织中UCP1的表达,并且在癌症相关恶病质患者中也出现了脂肪UCP1的表达上调。更重要的是,与野生型(WT)小鼠比较,UCP1敲除小鼠的LLC肿瘤引起的恶病质表型显著得到改善。研究结果表明UCP1上调在癌症恶病质的发生中起重要作用。为了鉴定脂肪细胞中乳酸的传感器,作者分别敲低了来自基质血管部分(SVF)衍生的脂肪细胞中的乳酸转运蛋白单羧酸转运蛋白1和4(分别为MCT1和MCT4)及其已知受体GPR132、GPR4或GPR81的表达。结果显示,乳酸诱导的UCP1上调仅被GPR81特异性siRNA消除,而靶向其他候选者的siRNA则没有类似的作用。为了进一步探讨GPR81在恶病质中的作用,作者选择体重、脂肪质量以及UCP1表达与WT对照组小鼠无差异的GPR81敲除(GPR81-/-)小鼠进行实验。通过微泵输送乳酸7天后,GPR81-/-小鼠的体重、脂肪质量、细胞大小及UCP1的表达没有发生变化,血液或食物摄入的 pH 值不受乳酸输注或GPR81 敲除的影响。在原位肺癌模型中,GPR81敲除显著延长了携带肿瘤的GPR81-/-小鼠的寿命,此外还改善了癌症相关的恶病质表型。在LLC异种移植模型中,尽管肿瘤诱导的血清乳酸升高与WT同窝小鼠相当,但GPR81-/-小鼠保持体重以及脂肪和肌肉质量不变,此外,乳酸水平的增加并未导致代谢性酸中毒或厌食症。GPR81缺失也阻断了B16肿瘤诱导的体重减轻。另外,GPR81 缺乏消除了LLC肿瘤引发的低热(癌症恶病质的常见临床表现)和能量消耗的增加。
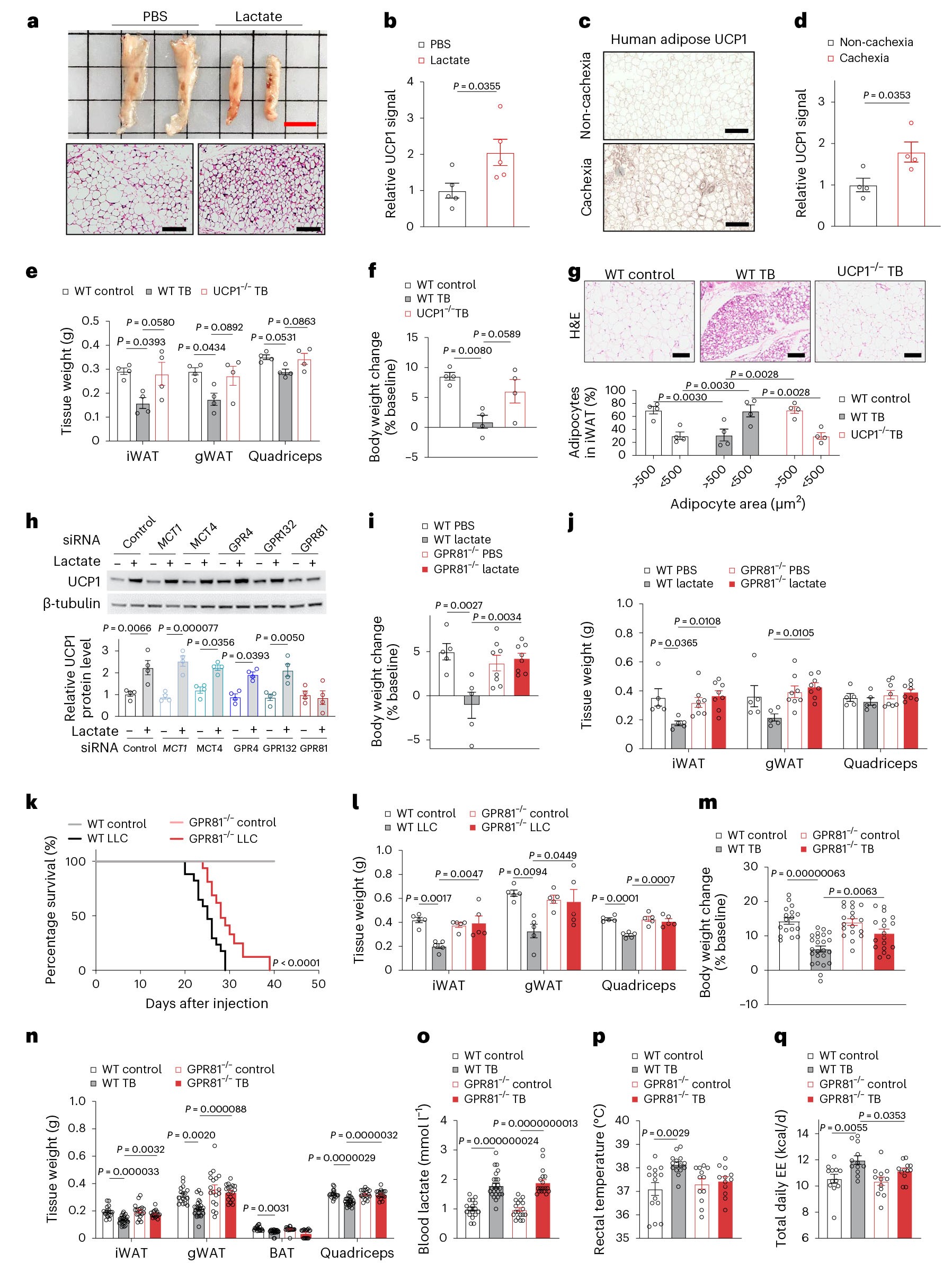
图2 GPR81缺陷小鼠对乳酸或肿瘤诱导的恶病质具有抵抗力
肌肉萎缩和肌无力是癌症恶病质的关键临床症状。因此,作者以WT小鼠和GPR81-/-小鼠建立LLC肿瘤异种移植模型,之后对骨骼肌和iWAT进行转录组测序(RNA-Seq)分析。骨骼肌RNA-seq结果显示:癌症模型中炎症反应相关的基因表达上调,与肌原纤维组装、肌肉细胞发育以及三羧酸循环和前体代谢物及能量生成相关的基因表达下调,并且这些变化在GPR81缺失的情况下表达变化差异明显减少,因此,在GPR81-/-小鼠中,骨骼肌结构得到了更好的保留,并且与WT小鼠比较,GPR81-/-小鼠的握力显著增强。另外,WT肿瘤小鼠表现出严重的脂肪组织消耗即iWAT和性腺白色脂肪组织(gWAT)中脂肪细胞变小以及BAT中的脂滴收缩,而GPR81-/-肿瘤小鼠的脂肪细胞大小和脂滴大小没有受到影响。对iWAT的RNA-seq数据进行分析,结果显示:与WT肿瘤小鼠相比,GPR81-/-肿瘤小鼠的iWAT中的产热基因、脂质和氨基酸代谢基因的表达增加,并且值得注意的是,GPR81缺失阻断了肿瘤诱导的UCP1表达,表明GPR81缺失可以抑制iWAT的褐变。此外,对iWAT的RNA-Seq数据进行基因富集分析(GSEA),结果显示:与WT肿瘤小鼠比较,GPR81-/-肿瘤小鼠iWAT中的糖酵解基因集和脂质代谢相关基因集的表达均下调;与对照组相比,WT肿瘤小鼠血清非酯化脂肪酸(NEFA)和甘油水平显著升高,而GPR81-/-小鼠和GPR81-/-肿瘤小鼠未发生变化。此外,研究结果还显示,除了对代谢重新编程进行调节外,GPR81敲除还可以通过降低TNF信号通路相关的基因(如TNF-α以及IFN-γ、IL-6和IL-1β等其他炎性细胞因子)的表达来抑制脂肪炎症。总之,GPR81能够介导乳酸的分解代谢,而GPR81的缺失显著减轻了由乳酸和肿瘤引起的恶病质表型。
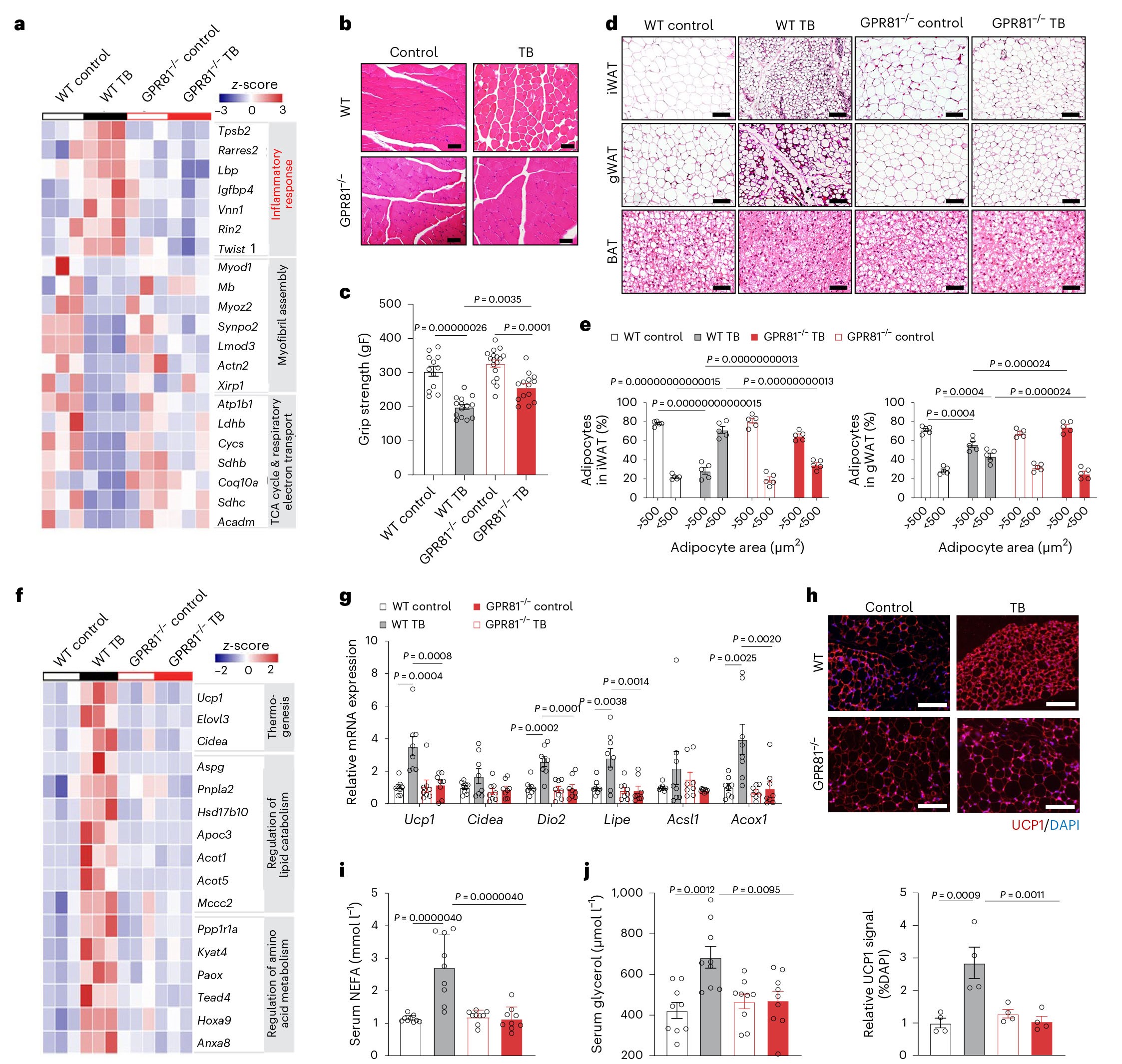
图3 GPR81缺陷减轻了肿瘤引起的肌肉和脂肪组织的消耗
4,脂肪GPR81对癌症恶病质的发展起重要作用
前期研究发现GPR81在脂肪组织中高度表达,并且在肿瘤模型中iWAT中的乳酸水平与iWAT的重量呈负相关,小鼠体脂比的下降可以被GPR81缺陷阻断,表明GPR81依赖性的脂肪组织适应不良是癌症恶病质发病机制的早期事件。为了确定脂肪GPR81在恶病质机制中的作用,作者构建了脂肪特异性GPR81基因敲除的小鼠(GPR81fl/flAdipoqcre),该小鼠脂肪细胞中GPR81蛋白和mRNA水平降低了70%。研究结果显示,无论脂肪GPR81的表达是否发生变化,LLC细胞异种移植均能提高血清乳酸的水平,但是脂肪GPR81的缺乏能减弱肿瘤诱导的体重减轻以及WAT和骨骼肌重塑。这些数据表明,脂肪GPR81对癌症恶病质的发展至关重要。
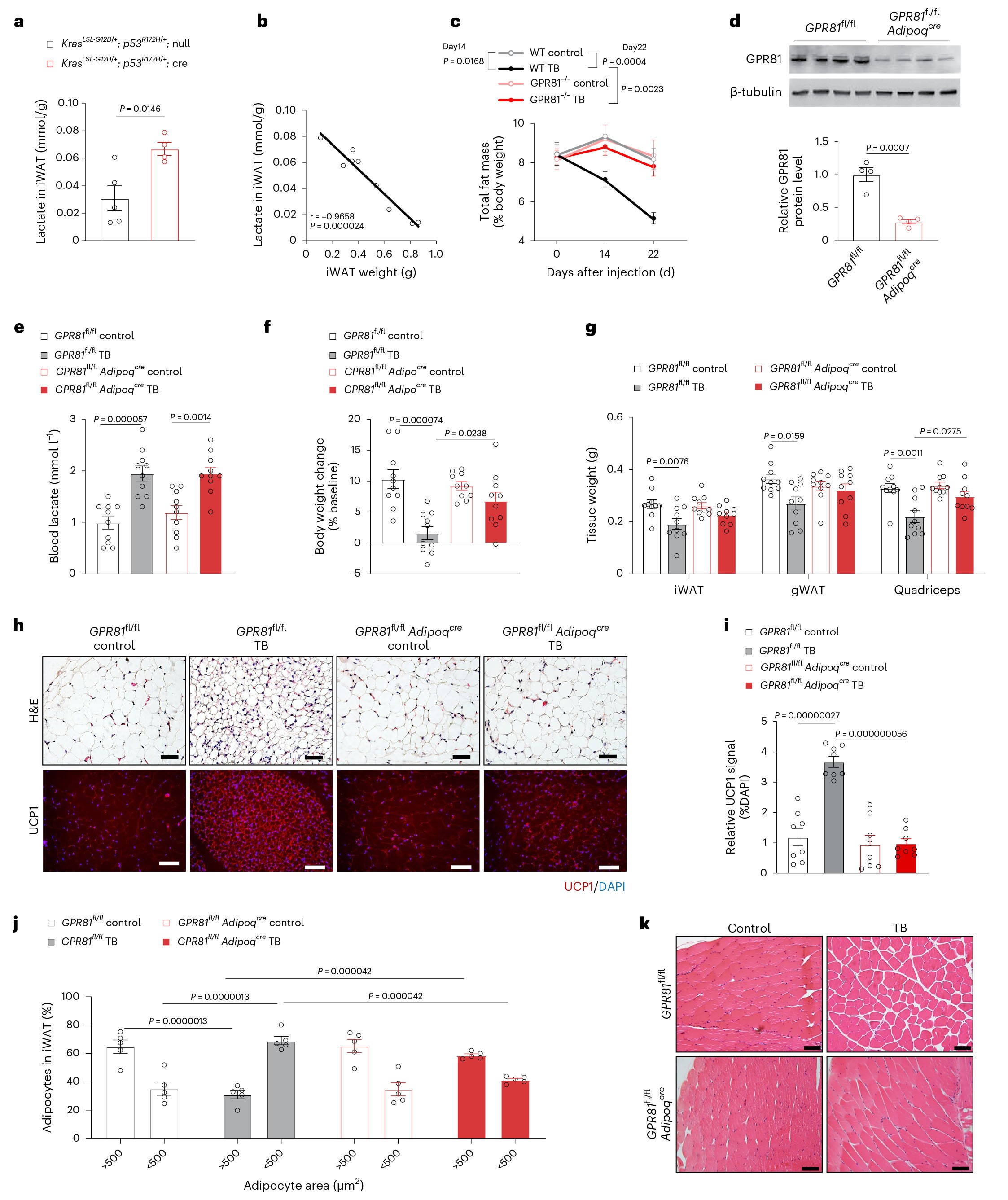
图4 脂肪 GPR81是乳酸促分解代谢作用的主要介质
5,乳酸通过GPR81-Gi-Gβγ-RhoA/ROCK1-p38级联诱导WAT褐变
为了研究乳酸/GPR81介导的脂肪组织代谢重塑的调控机制,作者对WT小鼠和GPR81-/-小鼠以及对应的LLC肿瘤异种移植小鼠(分组:WT control;WT TB;GPR81-/- control;GPR81-/- TB)的iWAT组织进行磷酸化蛋白组学分析。KEGG结果表明差异基因富集在与结构重塑、胰岛素、mTOR信号通路、激活的蛋白激酶(MAPK)以及Rho GTP酶相关的通路。与WT组比较,GPR81-/-组中MAPK3 (ERK1),MAPK1 (ERK2)和MAPK9 (JNK2)的磷酸化水平显著增强,而MAPK8 (JNK1)和MAPK11 (p38)磷酸化水平显著被抑制,这些结果表明,GPR81缺乏可能通过保留由ERK1/2介导的脂肪生成途径来阻断肿瘤引起的iWAT消耗,同时抑制由p38介导的棕色脂肪形成途径。与小鼠中观察的结果一致:肺腺癌引起的恶病质患者的iWAT中也观察到了p38的激活。用乳酸处理SVF衍生的脂肪细胞,结果显示p38磷酸化的增强会随乳酸作用的时间而变化,呈时间依赖性;而敲除GPR81则会阻断乳酸介导的p38和ATF2的活化(前期已有实验研究表明活化的p38通过磷酸化促进激活转录因子2(ATF2)进入细胞核,从而增加UCP1的表达),此外,干扰p38的表达会抑制乳酸介导的UCP1的上调,由此表明,乳酸/GPR81的功能是由p38介导的。
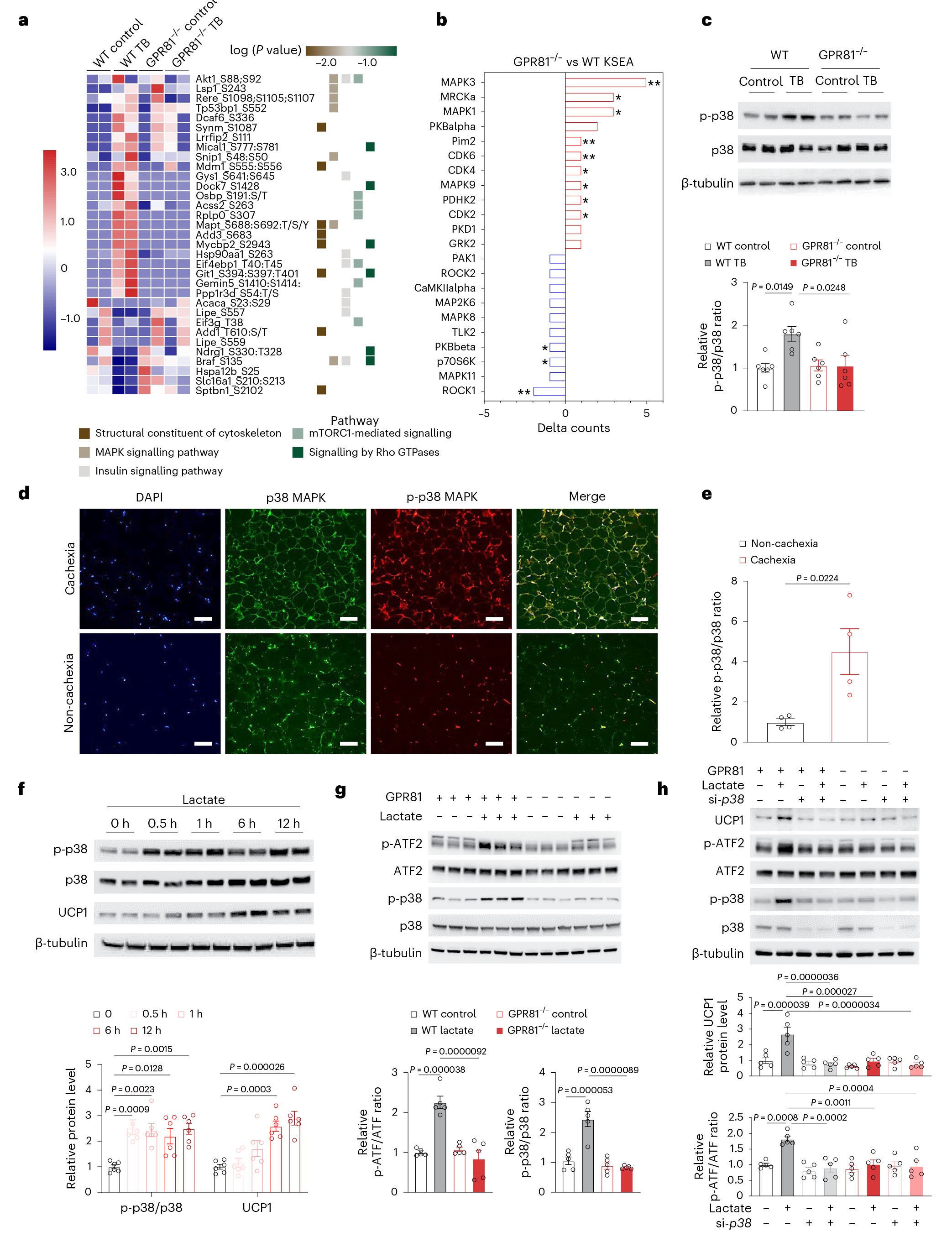
图5 GPR81通过激活 p38诱导 WAT 褐变
接着,研究结果显示增强p38磷酸化水平并激活下游信号通路的是L-乳酸,而不是D-乳酸,由此表明产热信号转导是由L-乳酸介导的GPR81活化引起的,而不是对渗透压或钠浓度变化的非特异性反应。由于多种刺激物会汇聚到蛋白激酶A(PKA)上以促进产热作用,因此,为了探究PKA活性是否参与乳酸/GPR81介导的消瘦信号传导,作者利用PKA抑制剂H89处理SVF衍生的脂肪细胞,实验结果显示H89不能抑制乳酸诱导的UCP1的上调表达,也不能抑制体内身体和脂肪质量的减轻,由此表明PKA对于乳酸介导的消瘦信号传导不是必需的。
GPR81是Gαi/o偶联受体,在SVF衍生的脂肪细胞中,乳酸诱导的p38激活和随后的脂肪褐变不仅被Gαi的抑制剂(PTX)所阻断,也能被Gαγ的抑制剂(gallein)或者干扰Gβ1或Gβ2的表达所阻断,这表明Gαi/o-Gβγ参与了乳酸诱导的p38激活的过程。此外,研究结果显示:乳酸以GPR81依赖的方式促进了RhoA与Rho GTP酶效应物Rhotekin 在SVF衍生的脂肪细胞中的共定位。之后,作者利用特异性siRNA抑制RhoA或ROCK1的表达,或使用ROCK1抑制剂Y-27632,结果显示:RhoA或ROCK1表达抑制后能显著减弱乳酸诱导的p38的激活,相反,抑制p38的表达并不影响乳酸诱导的RhoA的表达,由此表明RhoA/ROCK1的激活在p38的上游。为了进一步验证乳酸介导促恶病质的信号通路,作者在异种移植后第10天开始用gallein(抑制GPR81的G蛋白βγ亚基)、Y-27632(抑制RhoA/ROCK1)或SB203580(抑制p38)处理肿瘤负荷小鼠。研究结果显示,在腹股沟脂肪垫注射每种抑制剂并不影响肿瘤生长,但却有效地减轻了乳酸引起的体重和组织重量损失。总之,这些结果表明,乳酸诱导的GPR81活化主要通过Gβγ-RhoA/ROCK1-p38信号通路引起WAT褐变。
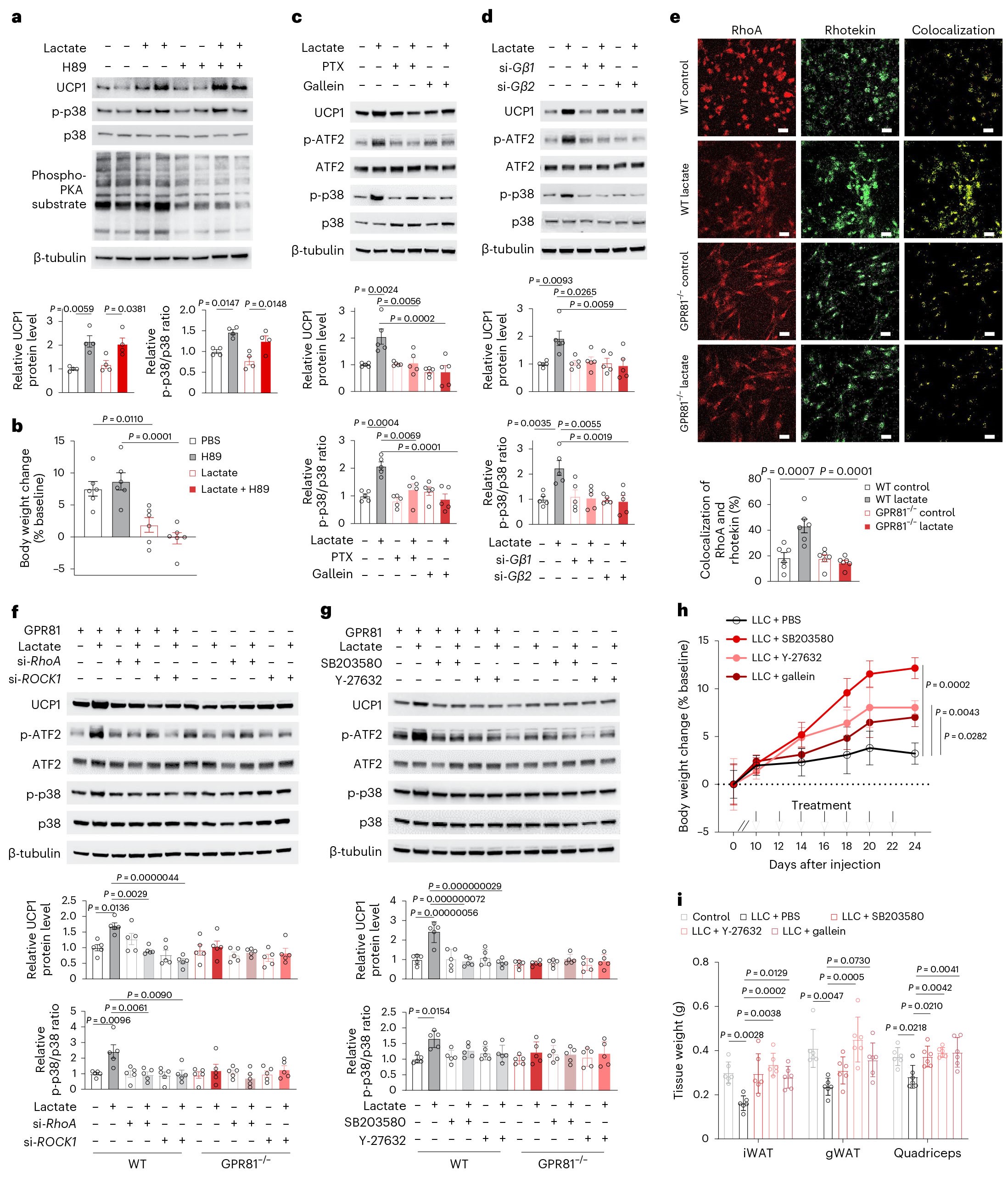
图6 活化的GPR81通过Gβγ-RhoA/ROCK1-p38级联反应诱导WAT褐变
综上所述,本研究揭示了乳酸对GPR81的慢性激活可以通过Gαi/o-Gβγ-RhoA / ROCK1-p38信号级联促进脂肪褐变和脂肪分解,从而促进肌肉营养不良和全身高分解代谢。这一新机制的发现,不仅加深了我们对癌症恶病质发生机理的理解,也为开发新的治疗策略提供了可能,即通过靶向GPR81和其下游信号通路来抑制恶病质的进展,进而改善癌症患者的生活质量和延长生存时间。

查看更多

查看更多

查看更多

联系我们

返回顶部