查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上期干货我们介绍了腺相关病毒在皮肤中的特异性基因调控策略,本期我们将系统介绍腺相关病毒在外周神经研究中的特异性调控策略,主要从组织特性及组成、嗜性AAV血清型、特异性启动子和病毒递送到外周神经的方法等四个方面展开分享。
外周神经系统又称周围神经系统(Peripheral Nervous System,PNS),是指中枢神经系统以外的神经成分,在解剖学上,PNS 由脑神经、脊神经和内脏神经组成。人的脑神经有12对,脑神经起源于大脑,连接头颈部的器官,包括皮肤、肌肉、眼、舌、耳、鼻、喉、咽和中枢神经系统,许多重要的特殊感觉方式,如视觉、嗅觉、味觉、听觉和平衡,都是由脑神经进行的[1]。人的脊神经有31对,脊神经沿脊髓有规律地出现,并通过椎间孔离开相邻椎体之间的脊柱,主要分布于躯干和四肢,脊神经将目标器官的感觉信息传递给中枢神经系统,并将中枢神经系统的运动指令传递给肌肉和目标器官[2]。内脏神经作为脑神经和脊神经的纤维成分,分布于内脏、心血管和腺体,内脏神经按性质可分为内脏运动神经和内脏感觉神经,内脏运动神经支配内脏、心血管的运动和腺体的分泌,在一定程度上不受人的意志控制,故又称为自主神经;内脏感觉神经接受内脏的各种刺激,并传至中枢,而中枢可通过内脏运动神经直接调节内脏的活动,也可通过神经体液间接调节其活动。
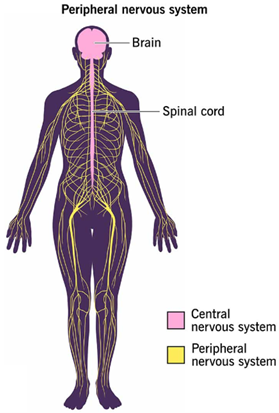
图1. 人体中枢神经系统和外周神经系统分布(图来源于Cleveland Clinic)
神经系统疾病,包括神经功能性和退行性疾病,可影响中枢和外周神经系统的所有细胞类型,在严重的情况下会导致患者残疾甚至死亡。腺相关病毒(adeno-associated virus, AAV)作为最常用的基因治疗载体之一,具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础科学研究和临床试验的基因治疗应用中。那么,如何用AAV去靶向外周神经呢?本文将从血清型的选择、启动子的选择以及注射方式的介绍等三个方面详细介绍利用AAV载体实现外周神经系统特异性基因调控的策略,希望能够为相关研究的老师提供帮助。
一、血清型的选择
重组AAV血清型的多样性是包装质粒中的cap基因决定的,通过改变cap基因可以使AAV具有不同的组织趋向性或易感细胞类型。常用的转导外周神经的AAV血清型包括AAV9、AAV-PHP.S、AAV-rh10。AAV9已被用于转导PNS神经元和外周器官[3]。Gombash SE等人发现新生或幼年小鼠全身注射AAV9可导致25-57%的肌肠神经元的转导(图2)[4]。AAV-PHP.S是由AAV9改进而来,Ken Y Chan等人发现静脉注射1×1012 vg/小鼠的AAV-PHP.S在外周神经系统中的转导效率比AAV9更高(图3),且可转导82%的背根神经节以及心脏和肠神经元[5]。AAV-rh10是从恒河猴中分离得到的血清型,和AAV9相比,AAV-rh10能更有效地转导脊髓背角和下运动神经元[6],但对于背根神经节和坐骨神经,AAV-rh10和AAV9感染效率均比较高(图4)。
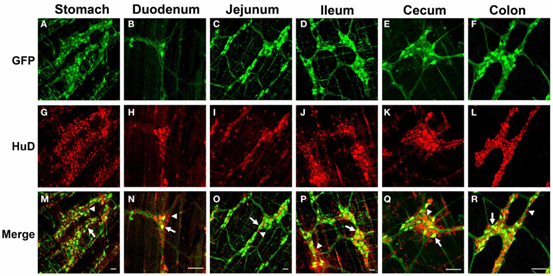
图2. 幼年小鼠静脉注射scAAV9-GFP后,GFP在肌间神经丛中的表达情况[4]
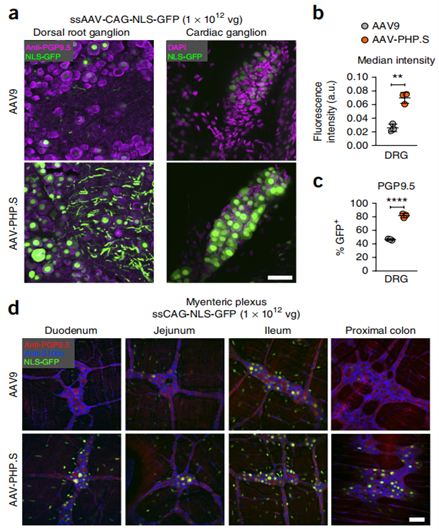
图3. AAV-PHP.S与AAV9转导外周神经元效率比较[5]
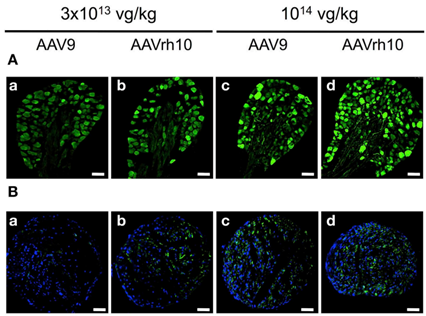
图4. AAV9和AAV-rh10转导小鼠背根神经节(A)和坐骨神经(B)比较[6]
二、启动子的选择
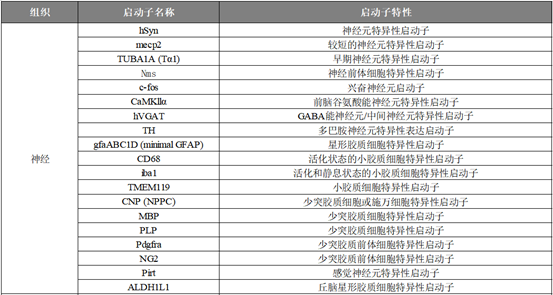
影响AAV递送效率和特异性的关键因素除了特异性的血清型,还有启动子。启动子是表达载体中的一个主要顺式作用元件,决定了目的基因表达的特异性。神经系统的组成极其复杂,神经的精密研究非常关键,要想实现某一类细胞的特异性感染,选择一种特异性相对更强的启动子尤为重要。汉恒生物推出了针对于神经元较全面的特异性启动子现货库,详情参考表1。本文我们介绍几种应用于外周神经的神经元特异性启动子,更多关于神经相关的特异性启动子的具体使用描述请参考《特异性调控之神经元》文章内容。
表1. 汉恒生物的神经系统特异性启动子
1. hSyn:神经元特异性启动子
hSyn启动子是人SYN1基因的启动子,SYN1基因表达产生特异表达在神经元内的Synapsin I蛋白,因此一般选择hSyn启动子作为神经元的特异性启动子。Synapsin I蛋白主要表达在轴突末端,特别是在突触小泡的膜上,在调节轴突生成和突触形成方面发挥重要作用。Wang等人将三种携带不同荧光的AAV-PHP.S-hsyn通过混合注射(注射方式:眼眶后注射,用量:60 μl/小鼠)成功转导了结肠中的神经元,并以3D方式对结肠丛中的单个神经元和神经纤维进行了追踪(图5)。
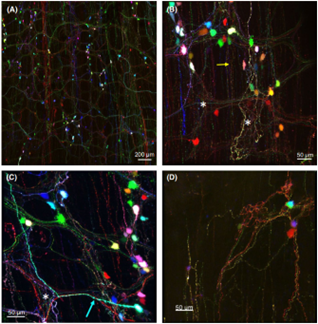
图5. 3种携带不同荧光(红、绿、青色)的AAV-PHP.S-hsyn同时眼眶后注射转导小鼠结肠神经元[7]
2. CNP(NPPC):少突胶质细胞或施旺细胞特异性启动子
2',3'-cyclic nucleotide 3' phosphodiesterase(2',3'-环核苷酸3'磷酸二酯酶,CNP)是一种髓磷脂特异性蛋白,CNP启动子被证明特异性地在少突胶质细胞和雪旺细胞中具有转录活性,并可维持转录至整个发育过程中[8]。Yuan等人构建了CNP启动子来启动表达绿色荧光蛋白EGFP的转基因小鼠,通过脑组织和坐骨神经的免疫组化分析表明,EGFP仅限于表达在少突胶质细胞和施旺细胞中[8]。
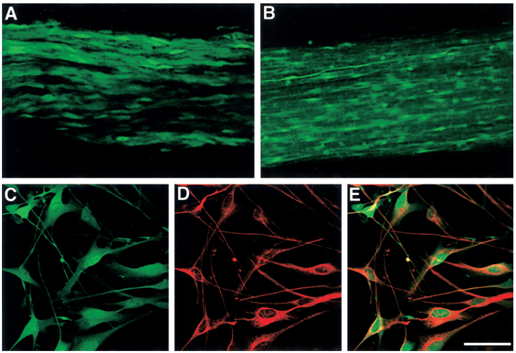
图6. CNP启动EGFP表达的转基因小鼠中,EGFP在坐骨神经和施旺细胞的表达情况[8]
3. TUBA1A:早期神经元特异性启动子
TUBA1A是α-微管蛋白基因,研究表明,TUBA1A主要在发育中的小鼠胚胎中枢神经系统和外周神经系统中高度表达[9],所以一般将TUBA1A作为早期神经元特异性启动子。Yumi等人用TUBA1A-Cre小鼠与Ikbkap-floxed小鼠杂交获得了Ikbkap基因条件性敲除小鼠,在胚胎期第17.5天时,在神经节细胞层和视神经的有丝分裂后细胞中检测到Cre表达[9]。
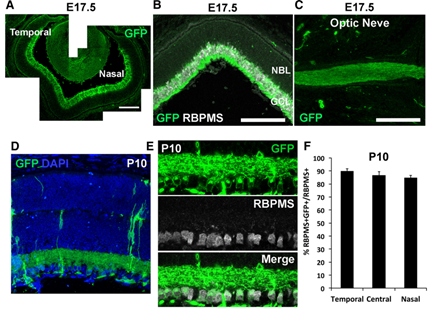
图7. Ikbkap基因敲除小鼠中,cre在有丝分裂后的神经元中表达[9]
三、注射方式
AAV感染外周神经系统的注射方式包括原位注射和系统性注射。
原位注射,即根据实验需要在特定的部位进行注射,更适合局部组织的研究。PNS缺乏很精确的坐标系,所以准确重复地靶向特定的神经节或周围神经中具有较强的挑战性,但目前已有研究人员将AAV定向注射到周围神经或神经节中并进行神经方向的研究。Williams等人通过AAV原位注射140 nl病毒到小鼠的淋巴结/颈静脉复合体中,将荧光报告基因引入到小鼠的迷走神经节,以追踪源自这些神经节的感觉神经元的外周投射,实验观察到神经元在肺部的分布情况,猜测它们可能参与调节呼吸[10]。Samad等人将AAV注射到大鼠的背根神经节(DRG)(注射方式:注射2个点,1 μL/点,注射速度 0.4 µl/min)中,以用于大鼠的慢性疼痛病的研究[11]。Francois等人将200 nL AAV以40 nl/min的速度注射到脊髓背角中,用于靶向研究疼痛调节相关的脑干-脊髓回路[12]。
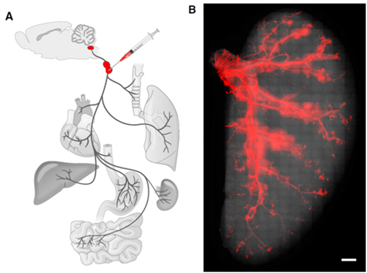
图8. AAV感染肺部迷走神经[10]
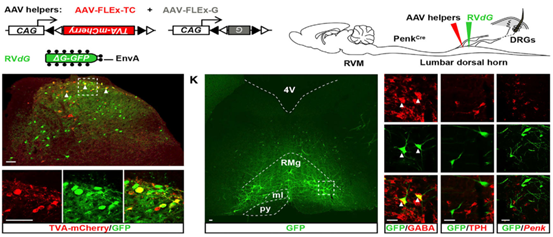
图9. AAV原位注射感染小鼠脊髓背角[12]
系统性注射,如静脉注射、腹腔注射,特点是侵入性小、操作简便,对于难以通过手术进入的外周神经元群(例如结节神经节、交感神经节等)或广泛分布的外周神经元(例如肠神经系统),系统性注射是一种有效的注射方法。但是系统性注射所需的病毒量较高(一般使用量为1×1011~1×1012vg/只小鼠),比局部注射要高1~2个数量级[3],且除了目的部位能被AAV转导外,系统性注射也会导致其他器官如肝脏、心脏等的转导,因此在考虑系统性注射时为了增强对目的部位的靶向性一般需要用到特异性启动子。
本期干货内容主要为大家介绍了使用AAV感染外周神经血清型和启动子的选择、病毒注射方法和汉恒生物客户的相关使用案例,希望对正在做相关实验的老师有所裨益。汉恒生物还研发了靶向肌肉、肾脏、肝脏、视网膜等组织器官的AAV特异性启动子和特异性血清型,欢迎各位老师同学与我们联系。下期我们将继续为大家介绍AAV在骨髓/关节的特异性表达调控,小伙伴们继续关注哦!
参考文献:
[1] Rui B. Chang. Optogenetic Control of the Peripheral Nervous System.Cold Spring Harb Perspect Med. 2019 Dec; 9(12):a034397.doi:10.1101/cshperspect.a034397.
[2] G Kayalioglu. The Spinal Cord, 2009.doi.org/10.1016/B978-0-12-374247-6.50008-0.
[3] Bedbrook CN, Deverman BE, Gradinaru V. Viral Strategies for Targeting the Central and Peripheral Nervous Systems. Annu. Rev. Neurosci. 2018;41:323–348.doi:10.1146/annurev-neuro-080317-062048.
[4] Gombash SE, Cowley CJ, Fitzgerald JA, Hall JC, Mueller C et al. Intravenous AAV9 efficiently transduces myenteric neurons in neonate and juvenile mice. Front Mol Neurosci. 7:81.doi:10.3389/fnmol.2014.00081
[5] Chan KY, Jang MJ, Yoo BB, Greenbaum A, Ravi N et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems.Nat Neurosci. 2017 Aug; 20(8):1172–1179.doi: 10.1038/nn.4593
[6] Yannick Tanguy, Maria G Biferi et al. Systemic AAVrh10 provides higher transgene expression than AAV9 in the brain and the spinal cord of neonatal mice.Front Mol Neurosci.2015 Jul 28:8:36.doi:10.3389/fnmol.2015.00036.
[7] Wang LX, Challis C, Li SL, Fowlkes CC et al.Multicolor sparse viral labeling and 3D digital tracing of enteric plexus in mouse proximal colon using a novel adeno-associated virus capsid. Neurogastroenterol Motil. 2021 Aug; 33(8): e14014. doi: 10.1111/nmo.14014.
[8] Yuan XQ, Chittajallu R, Belachew S, Anderson S, McBain JC, Gallo V.Expression of the green fluorescent protein in the oligodendrocyte lineage: a transgenic mouse for developmental and physiological studies.J Neurosci Res.2002 Nov 15;70(4):529-45.doi: 10.1002/jnr.10368.
[9]Jayne A, Georgia B, Emily AB,Jeffrey KM.The α-Tubulin gene TUBA1A in Brain Development: A Key Ingredient in the Neuronal Isotype Blend.Journal of Developmental Biology,2017 Sep;5(3):8. doi:10.3390/jdb5030008.
[10] Chang RB, Strochlic DE, Williams EK, Umans BD, Liberles SD. Vagal sensory neuron subtypes that differentially control breathing. Cell 161:622–633.doi:10.1016/j.cell.2015.03.022.
[11] Samad OA, Tan AM, Cheng X, Foster E, Dib-Hajj SD, Waxman SG. Virus-mediated shRNA knockdown of Nav1.3 in rat dorsal root ganglion attenuates nerve injury-induced neuropathic pain. Mol Ther. 21:49–56.doi:10.1038/mt.2012.169.
[12] Francois A, Low SA, Sypek EI, Christensen AJ, Sotoudeh C et al. A brainstem-spinal cord inhibitory circuit for mechanical pain modulation by GABA and enkephalins. Neuron 93:822–39.e6. doi:10.1016/j.neuron.2017.01.008.

查看更多

查看更多

查看更多

联系我们

返回顶部