查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
在上期内容中,我们介绍了细胞凋亡概念及细胞凋亡的主要途径细,其中讲到丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)基因家族作为细胞信号传导的重要组成部分,在细胞凋亡中扮演着重要角色,本期将继续为大家详细介绍丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)家族在细胞凋亡中的作用以及其调控细胞凋亡的作用机制。

一、MAPK基因家族的简介
MAPK基因家族是一类丝氨酸/苏氨酸蛋白激酶,由于其是在培养细胞过程中因细胞在受到生长因子等丝裂原刺激时被激活并被鉴定出来的而得名[1]。MAPK基因在所有真核细胞中都可以表达,其通路组成从酵母到人都是保守的三级激酶模式:通过三级激酶级联反应(MAPKKK→MAPKK→MAPK)传递信号,最终调控下游效应分子。MAPK级联反应是多种信号通路的中心,是接收信号并将其带入细胞核的一类重要分子,在许多细胞增殖凋亡相关信号通路中具有关键作用。在未受刺激的细胞中,MAPK处于静止状态。当细胞受到生长因子或其他因素刺激后,MAPK接收MKK和MKKK的活化信号而被激活,表现为逐级磷酸化。MAPK基因家族主要分为三个亚家族:ERK(extracellular-signal regulated protein kinase,细胞外信号调节激酶)、JNK(c-Jun N-terminal kinase,c-Jun氨基末端激酶)和p38 MAPK(p38 mitogen-activated protein kinase,p38丝裂原活化蛋白激酶)。哺乳动物中,ERK家族广泛存在于各种组织,参与细胞的增殖分化调控。多种生长因子受体、营养相关因子受体等都需要 ERK 的活化来完成信号转导过程。JNK 家族是细胞对各种应激原诱导的信号转导的关键分子,参与细胞对辐射、渗透压、温度变化等应激反应。p38家族介导炎症、凋亡等,是抗炎药物开发的靶点。
MAPK pathways
1.1 ERK家族
ERK家族包括经典成员ERK1(MAPK3)、ERK2(MAPK1)和非经典成员ERK3/4、ERK5(BMK1)、ERK7/8,主要调控细胞增殖、分化、凋亡信号通路。
ERK1是第一个被鉴定出来的MAPK[2]。到目前为止,已报道了人类、小鼠、大鼠和斑马鱼基因组中存在ERK1的同源物。ERK2存在于人类、小鼠、大鼠、青蛙、鸡和斑马鱼基因组中。值得注意的是,缺乏Erk2的小鼠无法形成胎盘锥和胚外外胚层,从而无法在胎儿中产生成熟的滋养层[3]。此外,根据E6.5和E7.5的组织学标准, Erk2−/− 胚胎也无法形成中胚层。
ERK3已被报道存在于人类、小鼠、大鼠、斑马鱼中。ERK3 主要受其蛋白质稳定性和自身磷酸化的调控。人类 ERK3 与 MAPK 活化蛋白 5 (MK5) 相互作用,ERK3 和 MK5 的时空表达表明两种激酶共同表达。在小鼠中,mk5的缺失导致 ERK3 蛋白水平大幅降低,并在 E11 左右致死,此时erk3的表达水平在野生型小鼠胚胎中达到最大值,这表明 MK5-ERK3 模块在发育过程中起着重要作用[4]。
ERK4与ERK3密切相关,最早在人类中发现,后相继在小鼠、大鼠和斑马鱼中报道,在鸡中也预测到了开放阅读框(ORF)。在斑马鱼发育过程中,其时空表达模式主要定位于大脑[5]。
ERK5,也称为BMK1,存在于人类、小鼠、大鼠、蛙和斑马鱼中。ERK5的激活由MEK5介导。氧化应激、高渗透压和生长因子可激活ERK5通路。ERK5具有独特的羧基末端结构域,可与转录因子肌细胞增强因子2 (MEF2)相互作用。使用 ERK5 或 MEK5 缺陷小鼠进行的基因研究表明,MEK5–ERK5 通路对血管发育和心血管发育至关重要。缺乏erk5或mek5的小鼠在E10 因胎盘发育、血管生成和心血管发育缺陷而死亡。使用诱导型启动子 Mx1 驱动 Cre 表达的条件性敲除研究表明,在诱导 Cre 表达后2-4 周内,成年小鼠因 ERK5 敲除致死。组织学和体外分析表明,内皮细胞失去完整性,变圆并最终凋亡,这些发现表明内皮细胞的存活依赖于 MEK5 和 ERK5[6]。
ERK7存在于大鼠、小鼠和斑马鱼中,基于基因组的分析表明,人类erk8和啮齿动物erk7是直系同源物。据推测,ERK7 通过其特征性的 C 末端维持其组成性活性构象。目前尚未见关于其在脊椎动物发育中功能的研究报道。ERK家族基因通过磷酸化多种下游靶标(如p90Rsk、CREB、c-Myc等),调控细胞核内的转录因子活性,从而影响基因表达[7]。
1.2 JNK家族
JNK家族包括三个基因:JNK1、JNK2和JNK3,其在细胞增殖、凋亡、应激反应等多种生理和病理过程中起着重要作用。它们分别表达 4 种 JNK1 剪接变体(α1、α2、β1、β2)、4 种 JNK2 剪接变体(α1、α2、β1、β2)和 8 种 JNK3 剪接变体。这些变体的分子量均为 46 KDa或 54 KDa,且带有 C 端延伸,此外,部分JNK3剪接变体还带有N端延伸。不同亚型在生物体中呈现特定的分布模式,例如,JNK1和JNK2在全身多个组织中普遍存在,而JNK3仅在心脏、睾丸和脑中表达。有研究表明,Jnk1−/−小鼠的 2 型辅助性 T 细胞应答受到影响,而jnk2−/− 小鼠的 T 细胞 1 型辅助性 T 细胞分化受损。两种基因敲除均表现出 T 细胞活化缺陷和胸腺细胞凋亡。携带单个jnk2等位基因(jnk1−/− jnk2−/+)的小鼠可以存活至出生,但无法关闭视裂(视网膜缺损)[8]。此外,Jnk1−/− /Jnk3−/−或Jnk2−/− /Jnk3−/−胚胎中缺乏致死性,加之这些双突变小鼠中缺乏凋亡改变,这表明 JNK1 和 JNK2(而非 JNK3)在脑胚胎发生过程中对特定脑区细胞凋亡的调控具有重要作用[9]。
1.3 p38 MAPK家族
p38 MAPK家族由四个同源异构体组成:p38α、p38β、p38γ和p38δ,主要响应应激和炎症信号。p38 MAPK家族的四个基因在氨基酸水平上具有高度的同源性(约60%),都具有一个Thr-Gly-Tyr(TGY)双磷酸化基序,这是其活性所必需的。
p38α和p38β都是广泛表达的亚型,参与调节细胞增殖、分化、发育和应激反应。p38α基因敲除小鼠因胎盘血管生成缺陷而致命,而在某些遗传背景下,p38α缺失会导致促红细胞生成素 (Epo) 生成减少,从而引发贫血。有研究通过用大鼠erk3基因筛选,从人类骨骼肌cDNA文库中分离出一个erk6克隆,该克隆似乎在成肌细胞分化为肌管的过程中起着信号转导的作用。根据磷酸化结构域和功能,ERK6现被归类为p38γ MAPK[10]。Eckert 及其同事将p38α描述为表面上皮细胞分化和细胞凋亡的调节因子[11]。迄今为止,已发现p38α在人类、小鼠和大鼠中表达,但在其他脊椎动物中尚未发现。
二、MAPK基因家族在细胞凋亡中的作用
MAPK基因家族在细胞凋亡中扮演着重要角色,其作用复杂且多样,主要通过调节下游信号通路和相关蛋白的表达来实现。以下将分别对MAPK基因三个亚家族在细胞凋亡中的作用进行阐述。
2.1 ERK家族
ERK信号通路在细胞凋亡中的作用较为复杂。ERK家族主要参与细胞增殖和生存信号的传递,但在某些情况下,ERK的持续活化可通过磷酸化调控细胞凋亡。蛋白磷酸酶通过在不同水平调控Ras/Raf/ERK信号通路发挥着重要的负调节作用,关于ERK通路具有促进细胞凋亡功能的早期报道出现在1996年[12]。研究表明,用格尔德霉素消耗Raf可保护MCF-7细胞免于抗肿瘤化合物紫杉醇诱导的细胞凋亡,而MEK反义cDNA表达可阻止蟾蜍灵诱导的 U937 白血病细胞凋亡。越来越多的研究使用 MEK 抑制剂(PD98059、U0126)以及显性负性或组成性活性形式的 Ras、Raf、MEK 或 ERK 的表达,证实了 Ras/Raf/ERK 通路在诱导细胞凋亡方面的作用[13]。
2.2 JNK家族
JNK在细胞增殖、凋亡和应激反应中发挥着重要作用,通过磷酸化激活c-Jun等转录因子,调控下游基因的表达,影响细胞命运。JNK的激活可以诱导Bax的活化,抑制Bad的活性,从而促进细胞凋亡。例如,在谷氨酸脱氢酶 1 (GLUD1)诱导凋亡的小鼠肝癌模型中,发现JNK 通路激活与 Bcl-2水平下调、Bax 水平的上调同步发生。此外,JNK还可以通过调控Bcl-2家族蛋白的表达,进一步影响细胞凋亡[14]。JNK的激活通常与氧化应激、紫外线照射等环境压力相关。JNK信号通路的失调与多种疾病相关,包括神经退行性疾病(如帕金森病)、糖尿病、癌症、心脏肥大和哮喘等。
2.3 p38 MAPK家族
p38 MAPK是MAPK家族的重要成员之一,其信号传导在细胞凋亡中起着关键作用,其激活通常与热休克、病毒感染等应激条件有关。p38 MAPK家族的激活依赖于上游激酶的双重磷酸化,磷酸化后的p38从胞浆转移到细胞核,调控转录因子的活性。p38α 在 Ras 过度活化下被磷酸化,通过抑制Ras依赖性基因表达和细胞生长发挥负调节作用。例如,有研究表明, p38α在致癌Ras 诱导的恶性转化中充当 ROS 感应剂。在致癌 Ras 表达下会增加 ROS生成,并增强肿瘤形成,p38激活会在这些细胞中氧化应激爆发时触发细胞凋亡[15]。p38 MAPK信号通路在细胞凋亡中具有复杂的调控作用,既可以通过激活下游效应分子促进凋亡,也可以通过适度激活维持细胞存活。一方面,p38 MAPK可以激活c-jun和c-fos,促进Fas/FasL介导的凋亡途径,同时通过磷酸化Bax诱导其转位,从而促进细胞凋亡。另一方面,p38 MAPK的适度激活可以抑制caspase-3的活性,从而阻止细胞凋亡。
三、MAPK基因家族在细胞凋亡中的作用机制
MAPK基因家族在细胞凋亡中具有重要作用,其作用机制涉及多个信号通路和分子机制。以下将详细解析MAPK基因三个亚家族在细胞凋亡中的作用机制。
3.1 ERK家族
许多研究表明ERK信号通路在调控细胞凋亡过程中严重依赖细胞状态和刺激因子,既可抑制也可促进细胞凋亡,具体机制如下:
1.抗凋亡作用
ERK信号通路可通过调控多种凋亡相关蛋白来影响细胞凋亡。例如,ERK通过催化促凋亡蛋白BAD(Ser112位点)磷酸化,阻止其与Bcl-2/Bcl-xL蛋白结合,同时上调抗凋亡蛋白Bcl-2、Bcl-xL和Mcl-1的表达,稳定线粒体膜电位,抑制细胞色素C(Cyt C)释放[16]。此外,ERK可激活转录因子NF-κB、诱导凋亡抑制蛋白(IAPs)如Survivin的表达,抑制Caspase-3/9的活化。ERK也可通过调节内质网Ca²⁺库稳定性,防止胞浆Ca²⁺超载诱导线粒体凋亡途径[17]。
2.促凋亡作用
在缺氧或氧化应激环境下,ERK持续激活可增加Bax表达,促进线粒体膜通透性改变,触发Caspase-9激活。此外,ERK激活增加细胞内活性氧(ROS)水平,触发DNA损伤和p53依赖的凋亡[18]。
3.2 JNK家族
JNK基因家族在细胞凋亡中的具体作用机制主要通过以下途径实现:
1.转录依赖的促凋亡调控
激活的JNK转移至细胞核,磷酸化多种转录因子,调控促凋亡基因表达。比如,JNK磷酸化c-Jun的Ser63/73位点,增强其转录活性,促进FasL、TNF-α、Bax等促凋亡基因表达。JNK磷酸化p53(Ser6)和p73,抑制其泛素化降解,稳定蛋白水平,诱导PUMA、Bax等线粒体凋亡相关基因转录[19]。以及其他转录因子ATF2、Elk-1、c-Myc等,进一步扩大促凋亡信号。
2.非转录依赖的线粒体通路调控
JNK通过直接调控Bcl-2家族蛋白,诱导线粒体膜通透性改变,促进细胞凋亡。JNK磷酸化Bcl-2的Ser70位点,抑制其抗凋亡功能,释放促凋亡蛋白Bax/Bak。磷酸化Bim和Bmf,促使其从细胞骨架释放,结合并激活Bax/Bak,导致线粒体释放细胞色素C。细胞色素C与Apaf-1结合,激活caspase-9,进而激活下游caspase-3/7,执行凋亡程序[20]。
3.死亡受体通路的协同作用
JNK通过上调FasL和TRAIL等死亡配体,激活死亡受体(如Fas、TNFR),受体激活后募集FADD和caspase-8,形成死亡诱导信号复合体(DISC),直接激活caspase级联反应,进而引起细胞凋亡[21]。
3.3 p38 MAPK家族
p38 MAPK信号通路在细胞凋亡中的双重机制:
1.促凋亡作用
p38α可直接磷酸化抗凋亡蛋白Bcl-2的Ser87和Thr56位点,抑制其与促凋亡蛋白(如Bax)的结合能力,促进线粒体膜通透性改变和细胞色素C释放。在神经元中,p38 MAPK通过激活一氧化氮信号,刺激Bax向线粒体转位,引发caspase级联反应。有研究发现,在胰腺癌细胞中,p38 MAPK的激活可调控Fas/FasL信号通路介导的细胞凋亡[22]。此外,p38 MAPK通过磷酸化p53和ATF2,上调促凋亡基因(如Bax、PUMA)表达。例如,在肝癌细胞中,p38活性降低导致p53功能抑制,促进肿瘤生长。
2.抗凋亡作用
p38 MAPK在某些情境下表现出促细胞生存效应,研究发现在嗜中性粒细胞中,p38磷酸化caspase-8(Ser364)和caspase-3(Ser150),直接抑制其酶活性,延缓凋亡进程。短期激活p38可诱导热休克蛋白(如HSP27),增强细胞对氧化应激的耐受性[23]。
总之,MAPK基因家族通过多层级信号网络精细调控细胞凋亡,其在细胞凋亡过程中具有重要作用。 目前,MAPK基因家族的研究热点主要包含癌症预后、进化机制,疾病治疗等多个领域。这些研究不仅揭示了MAPK基因家族在生物学过程中的重要性,也为未来的基础研究和临床应用提供新的方向。
汉恒生物专营病毒包装十余载,建立了庞大的基因研究现货工具库,可为广大研究人员提供MAPK家族相关基因的过表达病毒现货。若有其他病毒包装需求或疑问,也欢迎随时咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。下一期是关于Caspase基因家族在细胞凋亡中的作用的干货,也欢迎大家前来学习交流。
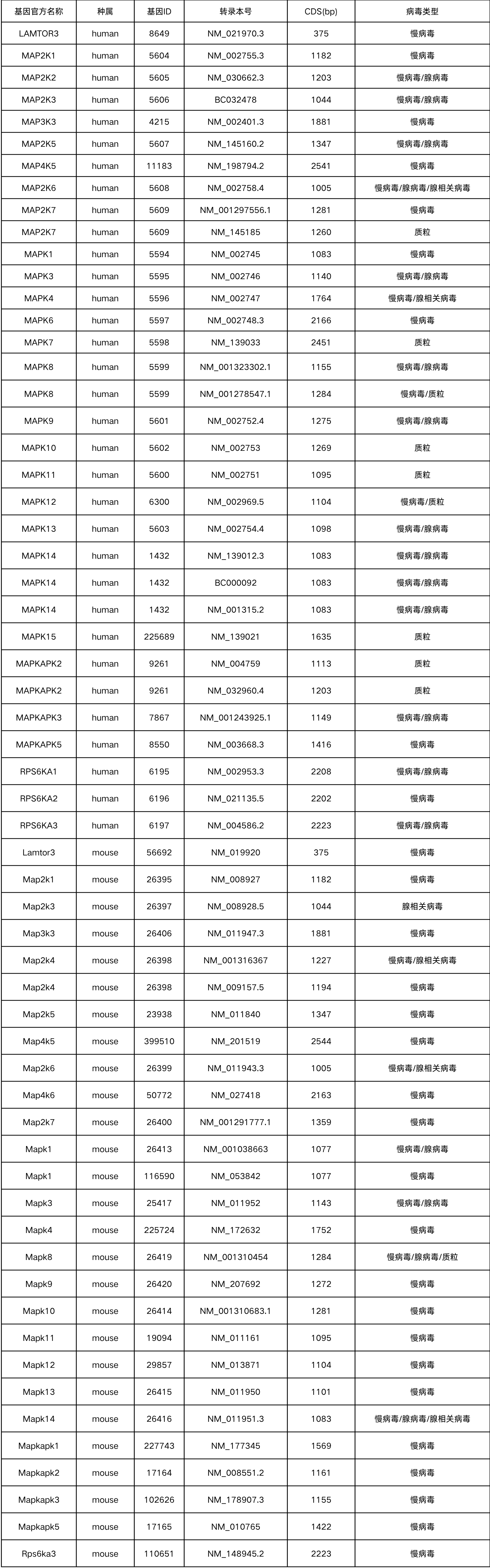
部分MAPK家族基因现货
参考文献
[1] Cuschieri J, Maier R V. Mitogen-activated protein kinase (MAPK)[J]. Critical care medicine, 2005, 33(12): S417-S419.
[2] Boulton T G, Yancopoulos G D, Gregory J S, et al. An insulin-stimulated protein kinase similar to yeast kinases involved in cell cycle control[J]. Science, 1990, 249(4964): 64-67.
[3] Saba-El-Leil M K. Vella FD Vernay B Voisin L Chen L 2003 An essential function of the mitogen-activated protein kinase Erk2 in mouse trophoblast development[J]. EMBO Rep, 4: 964968.
[4] Seternes O M, Mikalsen T, Johansen B, et al. Activation of MK5/PRAK by the atypical MAP kinase ERK3 defines a novel signal transduction pathway[J]. The EMBO journal, 2004, 23(24): 4780-4791.
[5] Krens S F G, He S, Spaink H P, et al. Characterization and expression patterns of the MAPK family in zebrafish[J]. Gene expression patterns, 2006, 6(8): 1019-1026.
[6] Hayashi M, Kim S W, Imanaka-Yoshida K, et al. Targeted deletion of BMK1/ERK5 in adult mice perturbs vascular integrity and leads to endothelial failure[J]. The Journal of clinical investigation, 2004, 113(8): 1138-1148.
[7] Abe M K, Kuo W L, Hershenson M B, et al. Extracellular signal-regulated kinase 7 (ERK7), a novel ERK with a C-terminal domain that regulates its activity, its cellular localization, and cell growth[J]. Molecular and Cellular biology, 1999, 19(2): 1301-1312.
[8] Sabapathy K, Kallunki T, David J P, et al. c-Jun NH2-terminal kinase (JNK) 1 and JNK2 have similar and stage-dependent roles in regulating T cell apoptosis and proliferation[J]. Journal of Experimental Medicine, 2001, 193(3): 317-328.
[9] Kuan C Y, Yang D D, Roy D R S, et al. The Jnk1 and Jnk2 protein kinases are required for regional specific apoptosis during early brain development[J]. Neuron, 1999, 22(4): 667-676.
[10] Lechner C, Zahalka M A, Giot J F, et al. ERK6, a mitogen-activated protein kinase involved in C2C12 myoblast differentiation[J]. Proceedings of the National Academy of Sciences, 1996, 93(9): 4355-4359.
[11] Eckert R L, Efimova T, Balasubramanian S, et al. p38 mitogen-activated protein kinases on the body surface–a function for p38δ[J]. Journal of Investigative Dermatology, 2003, 120(5): 823-828.
[12] Blagosklonny, M. V., Schulte, T., Nguyen, P., Trepel, J., & Neckers, L. M. (1996). Taxol-induced apoptosis and phosphorylation of Bcl-2 protein involves c-Raf-1 and represents a novel c-Raf-1 signal transduction pathway. Cancer research, 56(8), 1851-1854.
[13] Watabe, M., Masuda, Y., Nakajo, S., Yoshida, T., Kuroiwa, Y., & Nakaya, K. (1996). The cooperative interaction of two different signaling pathways in response to bufalin induces apoptosis in human leukemia U937 cells. Journal of Biological Chemistry, 271(24), 14067-14073.
[14] El Dakkak B, Taneera J, El-Huneidi W, et al. Unlocking the therapeutic potential of BCL-2 associated protein family: Exploring BCL-2 inhibitors in cancer therapy[J]. Biomolecules & Therapeutics, 2024, 32(3): 267.
[15] Dolado I, Swat A, Ajenjo N, et al. p38α MAP kinase as a sensor of reactive oxygen species in tumorigenesis[J]. Cancer cell, 2007, 11(2): 191-205.
[16] Scheid M P, Schubert K M, Duronio V. Regulation of Bad phosphorylation and association with Bcl-xL by the MAPK/Erk kinase[J]. Journal of Biological Chemistry, 1999, 274(43): 31108-31113.
[17] Gong T, Si K, Liu H, et al. Research advances in the role of MAPK cascade in regulation of cell growth, immunity, inflammation, and cancer[J]. Zhong nan da xue xue bao. Yi xue ban= Journal of Central South University. Medical Sciences, 2022, 47(12): 1721-1728.
[18] Rozpedek W, Pytel D, Mucha B, et al. The role of the PERK/eIF2α/ATF4/CHOP signaling pathway in tumor progression during endoplasmic reticulum stress[J]. Current molecular medicine, 2016, 16(6): 533-544.
[19] Wolf E R, McAtarsney C P, Bredhold K E, et al. Mutant and wild-type p53 complex with p73 in response to JNK phosphorylation[J]. Science signaling, 2018, 11(524): eaao4170.
[20] Wang Y, Qiu L, Xu H, et al. Inhibition of JNK transcription via the Nrf2/Keap1a pathway to resist microcystin-induced oxidative stress and apoptosis in freshwater mussels Cristaria plicata[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2024, 285: 109982.
[21] Cell death signaling in cancer biology and treatment[M]. Springer New York, 2013.
[22] Singh S P. Targeting p38 MAPK Signaling to Suppress Inflammatory Tumor-Stroma-Immune Crosstalk in Pancreatic Cancer[D]. University of Miami, 2024.
[23] Alvarado-Kristensson M, Melander F, Leandersson K, et al. p38-MAPK signals survival by phosphorylation of caspase-8 and caspase-3 in human neutrophils[J]. The Journal of experimental medicine, 2004, 199(4): 449-458.

查看更多

查看更多

查看更多

联系我们

返回顶部