查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
在细胞凋亡系列干货的前期内容中我们介绍了细胞凋亡的概况及相关的MAPK家族基因,今天我们继续介绍细胞凋亡相关的Caspase家族基因。本期内容我们主要从Caspase家族基因成员及结构、Caspase家族基因的组装与活化和Caspase家族基因与细胞凋亡的关系等三大方面分享Caspase家族基因的故事。

一、Caspase家族成员及结构
半胱天冬酶是一个进化保守的半胱氨酸依赖性内切蛋白酶家族,半胱天冬酶对底物具有高度的特异性,在特定的天冬氨酸残基后水解其底物,积极参与细胞凋亡的执行[1]。迄今为止,已鉴定出14种哺乳动物半胱天冬酶,通常根据其在细胞凋亡和炎症中的功能进行分类,或者根据它们对底物的切割识别序列进行分类[2]。根据功能和结构域结构,Caspase家族的成员主要被分为炎症型或凋亡型。
1. Caspase -1、-4、-5和-11被归类为炎性Caspase,在结构上,包含一个大小可变的氨基末端结构域,在N端共享一个Caspase激活和募集结构域(CARD),随后是分别约20 kDa和10 kDa大小的催化亚基(α大亚基和β小亚基),它们共同形成蛋白酶结构域。
2. 凋亡型Caspase可进一步分为启动型Caspase和执行型Caspase。凋亡启动型Caspase在长前结构域前还含有CARD或死亡效应结构域(DED),Caspase -8、-9和-10被归类为启动型Caspase。与凋亡启动型Caspase不同,凋亡执行型Caspase是缺乏CARD或DED结构域的短的长前结构域和短催化结构域组成,Caspase -3、-6和-7被归类为执行型Caspase。
3. 此外,Caspase-2、-12与炎性Caspase具有相同的结构域结构,Caspase-2功能被描述为与细胞周期相关。而小鼠Caspase-12的功能仍然不明确,对于人类Caspase-12,普遍认为75%的Caspase-12基因被敲除,而其余25%的Caspase-12基因携带一种不具有蛋白水解活性的假蛋白酶。Caspase-14的结构只有大小催化亚基,它的功能与细胞分化有关。
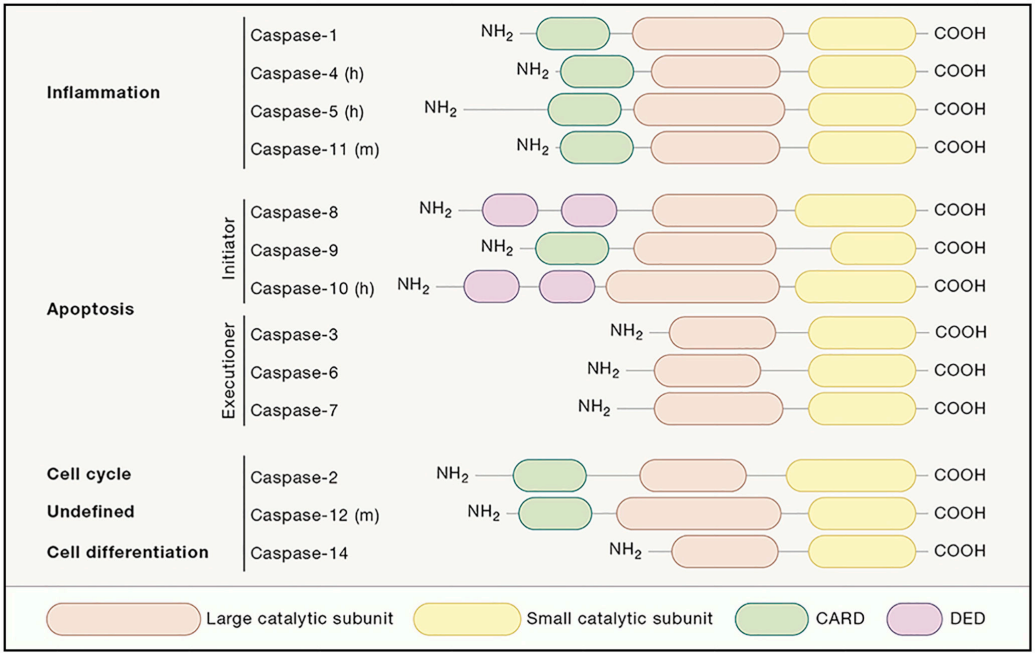
图1. Caspase家族成员及结构域示意图[1]
二、Caspase的组装与活化
Caspase活化是一个有序的多步骤水解过程,主要分为两种方式:同源活化和异源活化。同源活化通常是通过适配器的募集,促使启动Caspase形成同源二聚体并被激活,进而启动细胞死亡程序,因此,同源活化是细胞凋亡早期的关键事件。而异源活化相对复杂,需要一种Caspase激活另一种Caspase。如执行Caspase不具备募集能力,必须依赖于启动Caspase的活化才能被激活,通过这种方式放大凋亡信号并完成细胞凋亡过程的执行[3]。
Caspase的组装与活化过程:
1.前体形式存在:Caspase通常以非活性酶原的形式存在,即前体形式。N端前肽在Caspase前体的N端与大亚基之间的特定部位被水解去除,接着切割大小亚基释放,这些前体由两个大亚基和两个小亚基组成,形成异源四聚体。Caspase家族基因的切割和催化位点见图3[4]。
2.剪切激活:许多Caspase以非活性的前体形式存在,需要特定的刺激或与其他分子相互作用进行剪切才能激活。在细胞凋亡过程中,启动Caspase可以通过与适配器蛋白等相互作用,形成多蛋白复合物,进而激活启动Caspase。Caspase酶原自动激活为活性蛋白酶的过程是由二聚化诱导的构象变化驱动的,这些构象变化导致分离前结构域和大小催化亚基的柔性接头区域被蛋白水解切除。
Caspase-8可以直接被死亡受体(如Fas或TNF-R1)激活,死亡受体与它们的配体(如Fas配体或TNF)结合时,Caspase-8会被招募到细胞膜上形成复合物,称为死亡诱导信号复合物(DISC,Death-Inducing Signaling Complex)。在这个复合物的形成过程中,Caspase-8会发生聚集和激活[5]。
Caspase-9的活化可以由多种信号通路介导,其中最为典型的是线粒体途径。在该途径中,细胞色素C与Apaf-1(apoptotic protease activating factor-1)和ATP结合,形成复合物,进而活化Caspase-9[5]。
3.级联反应:在细胞凋亡途径中,Caspase-3、-6和-7的激活通常是通过级联反应而实现的,启动Caspase(如Caspase-9)或信号转导路径的其他分子被激活后,它们会活化Caspase-3和Caspase-7,形成一个放大信号的级联反应,这种机制确保了细胞凋亡是一个不可逆的过程。
Caspase-3的功能形式(即四聚体结构)具有两个相同的活性位点。每个活性位点都包含一个保守的催化组氨酸-半胱氨酸基序,该基序可以在天冬氨酸-谷氨酸-缬氨酸-天冬氨酸(D - e - v - D)四肽基序中特异性地切割天冬氨酸残基后的底物[3]。
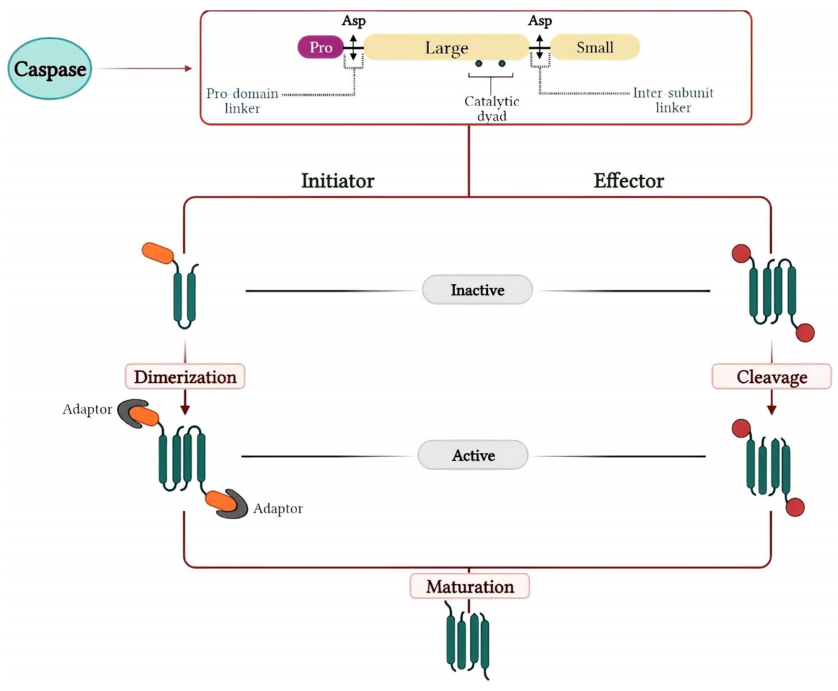
图2. Caspase的活化与成熟[3]
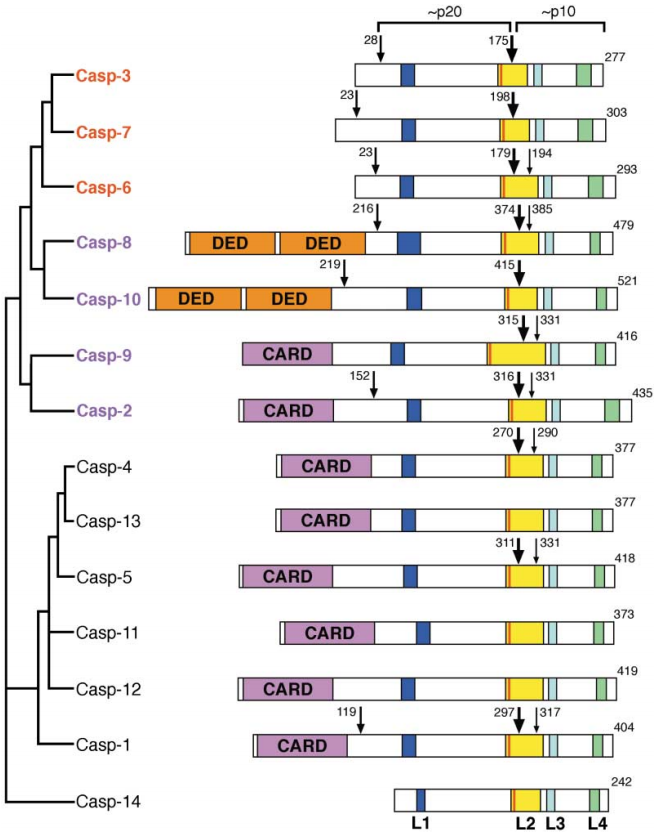
图3. Caspase的催化和激活裂解位点示意图[4](突出大箭头:激活裂解的位点,中、小箭头:其他裂解的位点,L1-L4:形成催化槽的四个表面环,催化残基Cys在L2的起始处用红线表示。)
三、Caspase家族基因与细胞凋亡的关系
在生理环境中,内在的遗传程序允许真核细胞以一种受调节的方式经历细胞死亡,通常被称为细胞程序性死亡。细胞凋亡是细胞程序性死亡的经典形式,被认为是一个稳态的非炎症过程,它在不惊动免疫系统的情况下清除受损、感染和老化的细胞[1]。
Caspase作为高度保守的细胞内蛋白酶,能够在天冬氨酸残基后的肽键处切割目标蛋白,从而促进程序性细胞死亡。促凋亡刺激诱导细胞启动Caspase级联,导致启动Caspase的邻近诱导激活。这反过来又通过蛋白水解激活效应Caspase,促进细胞组分的系统性分解,导致特征性的细胞内变化,包括DNA降解、核收缩和断裂、膜泡和凋亡小体的释放,并最终导致细胞凋亡和吞噬作用清除死细胞。不同的上游信号事件,如死亡受体DR参与(外源性)或细胞应激(内在),会导致不同的死亡诱导凋亡机制。因此,基于启动模式和参与该过程的特定适配器和启动Caspase,凋亡途径通常可分为外源性或内源性细胞凋亡途径[6]。
1、外源性凋亡途径
外源性凋亡途径是细胞外配体诱导的DR信号传导的核心,该途径通过死亡配体与死亡受体的结合而被激活。表征良好的DR家族成员包括肿瘤坏死因子超家族成员TNF受体1 (TNFR1)、凋亡抗原1 (APO-1、Fas)、TNF相关凋亡诱导配体受体1(TRAIL-R1)和TNF相关凋亡诱导配体受体2(TRAIL-R2)。Fas、TRAIL-R1和TRAIL-R2与它们的同源配体结合导致受体寡聚化并募集靶细胞中的下游接头Fas相关死亡结构域(FADD)或TNFR1相关死亡结构域(TRADD)蛋白、Caspase-8酶原等蛋白质形成复合物DISC。随后在细胞膜上组装的复合物DISC中的Caspase-8酶原的寡聚化和激活,引起执行细胞凋亡的关键酶Caspase-3的蛋白质水解酶级联反应,最终导致细胞死亡[6]。
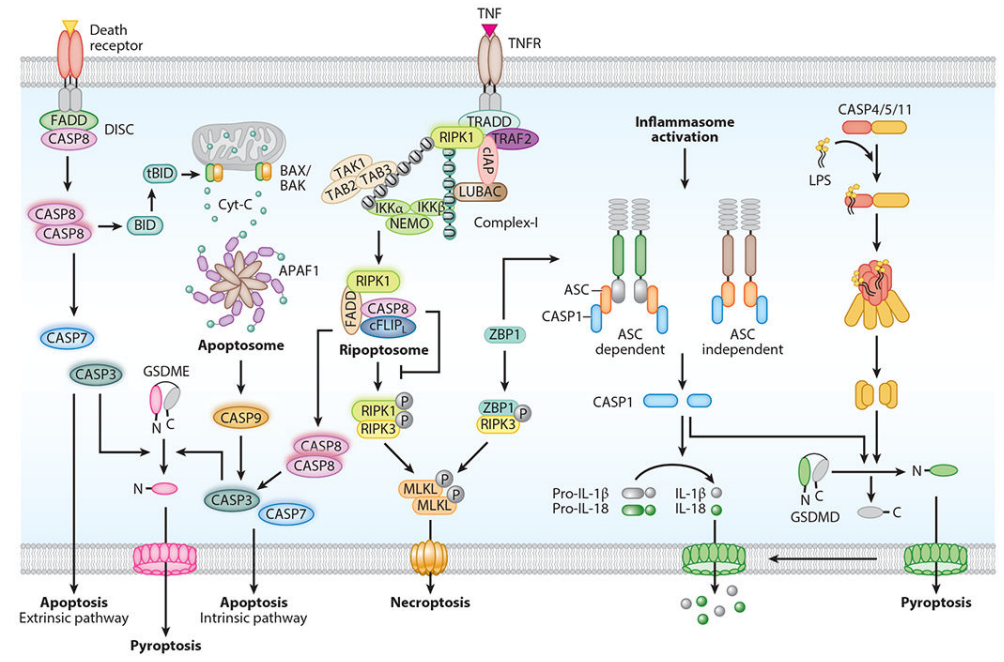
图4. 细胞凋亡过程中的Caspase家族基因功能[6]
2、内源性凋亡途径
当线粒体完整性在应激反应中受损时,就会触发内在凋亡途径。在生长因子剥夺、DNA损伤或癌基因激活的反应中,仅含Bcl-2同源区3(BH3)结构域的蛋白被转录或转录后诱导,BH3-only蛋白结合并抑制抗凋亡Bcl-2蛋白,这导致细胞死亡效应器BAX和BAK(Bcl-2家族促凋亡蛋白成员)的释放和激活,然后寡聚并促进线粒体外膜通透性(MOMP),从而释放包括细胞色素C和Smac/Diablo蛋白在内的凋亡因子到细胞质中,细胞色素C结合Apaf-1的WD结构域,Apaf-1同时与ATP发生结合,这导致Apaf-1的寡聚化(多为7聚化)和构象改变暴露出N端的Caspase募集结构域,Apaf-1又与Caspase-9酶原发生结合,将其装配到凋亡体蛋白复合物中。在凋亡体中,Caspase-9酶原发生寡聚化和自我激活启动Caspase级联反应,驱动Caspase-3/-6/-7导致细胞凋亡的稳健执行[6-7]。
凋亡执行Caspase-3/-6/-7的酶原是无活性的同型二聚体,当被激活时,会切割和活化数百种细胞蛋白,包括结构蛋白和DNA修复蛋白等,最终导致特征性形态变化。其中底物多聚腺苷二磷酸核糖聚合酶(PARP)、DNA 依赖性蛋白激酶(DNA-PK)参与DNA修复,一旦被Caspase裂解而失活,DNA降解就会随之而来。Caspase激活脱氧核糖核酸酶(CAD)是一种可被Caspase激活的镁依赖性内切酶。在细胞凋亡中,Caspase-9破坏核孔,使Caspase-3能够进入细胞核切割CAD特异性抑制剂(ICAD),将CAD从CAD-ICAD复合物中释放出来,从而导致DNA降解。核纤层蛋白A(Lamin A)和胞衬蛋白(Fodrin)分别是核骨架和细胞质骨架的重要组成部分。细胞凋亡过程中Caspase对Lamin的裂解可导致染色质的凝聚和核膜的分解,对Fodrin的裂解可导致凋亡小体的形成。当各种Caspase底物被激活时,可引发多个细胞凋亡的典型特征,例如DNA损伤修复能力下降、细胞骨架解体、染色质断裂、细胞核碎裂、细胞质收缩和细胞膜破裂等细胞凋亡现象[8]。
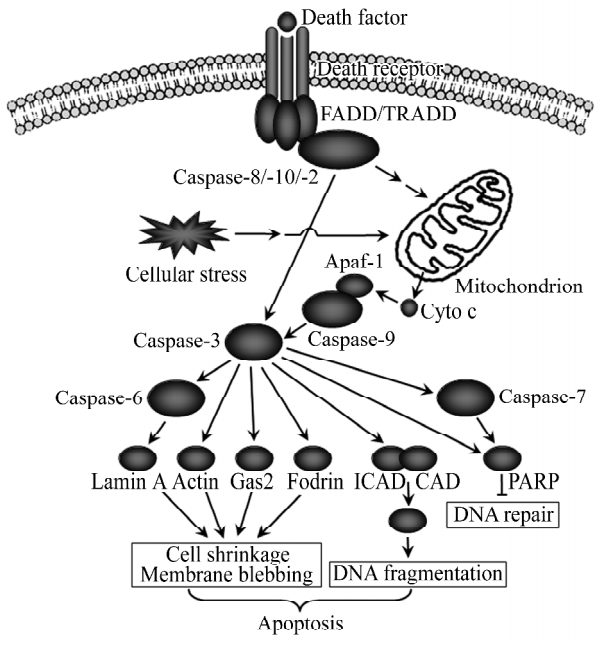
图5. 凋亡执行子半胱天冬酶的下游底物[8]
3、外源性和内源性凋亡途径之间存在密切联系
死亡受体诱导的凋亡途径可以通过蛋白水解与内在凋亡途径连接,主要通过Caspase-8激活的BCL-2同源3相互作用结构域死亡激动剂(BID)蛋白切割,产生tBID,tBID进入线粒体作用于促凋亡BAX-BAK分子开关,促进细胞色素C的释放,进而激活MOMP和内源性凋亡途径[6-7]。
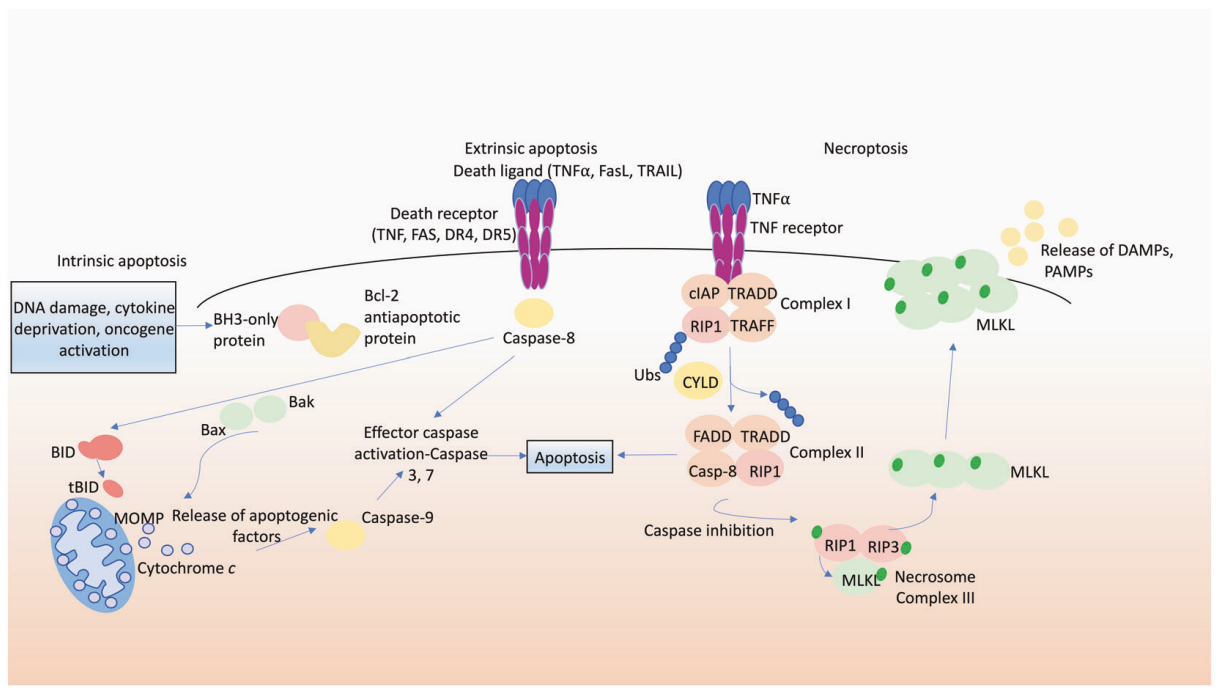
图6. 细胞凋亡和坏死下垂的分子途径[7]
汉恒生物专营病毒包装十余载,建立了庞大的基因研究现货工具库,现可提供Caspase家族基因研究相关产品,也可定制靶向特异性组织或细胞的基因调控工具,包括慢病毒(Lentivirus, LV)、腺病毒(Adenovirus, AD)、腺相关病毒(Adeno-associated-virus, AAV)以及质粒等,如有技术或产品需求,欢迎随时咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。本期内容到这里就结束了,下期我们将会继续分享细胞凋亡相关的基因家族,敬请关注。
表1. 汉恒生物Caspase相关现货

参考文献:
[1]Van Opdenbosch N, Lamkanfi M. Caspases in Cell Death, Inflammation, and Disease. Immunity. 2019 Jun 18;50(6):1352-1364. doi: 10.1016/j.immuni.2019.05.020. PMID: 31216460; PMCID: PMC6611727.
[2]Dhani S, Zhao Y, Zhivotovsky B. A long way to go: caspase inhibitors in clinical use. Cell Death Dis. 2021 Oct 15;12(10):949. doi: 10.1038/s41419-021-04240-3. PMID: 34654807; PMCID: PMC8519909.
[3]Asadi M, Taghizadeh S, Kaviani E, Vakili O, Taheri-Anganeh M, Tahamtan M, Savardashtaki A. Caspase-3: Structure, function, and biotechnological aspects. Biotechnol Appl Biochem. 2022 Aug;69(4):1633-1645. doi: 10.1002/bab.2233. Epub 2021 Aug 22. PMID: 34342377.
[4]Shi Y. Mechanisms of caspase activation and inhibition during apoptosis. Mol Cell. 2002 Mar;9(3):459-70. doi: 10.1016/s1097-2765(02)00482-3. PMID: 11931755.
[5]McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease. Cold Spring Harb Perspect Biol. 2015 Apr 1;7(4):a026716. doi: 10.1101/cshperspect.a026716. Erratum for: Cold Spring Harb Perspect Biol. 2013 Apr 01;5(4):a008656. doi: 10.1101/cshperspect.a008656. PMID: 25833847; PMCID: PMC4382736.
[6]Kesavardhana S, Malireddi RKS, Kanneganti TD. Caspases in Cell Death, Inflammation, and Pyroptosis. Annu Rev Immunol. 2020 Apr 26;38:567-595. doi: 10.1146/annurev-immunol-073119-095439. Epub 2020 Feb 4. PMID: 32017655; PMCID: PMC7190443.
[7]Moujalled D, Strasser A, Liddell JR. Molecular mechanisms of cell death in neurological diseases. Cell Death Differ. 2021 Jul;28(7):2029-2044. doi: 10.1038/s41418-021-00814-y. Epub 2021 Jun 7. PMID: 34099897; PMCID: PMC8257776.
[8]Fan TJ, Han LH, Cong RS, Liang J. Caspase family proteases and apoptosis. Acta Biochim Biophys Sin (Shanghai). 2005 Nov;37(11):719-27. doi: 10.1111/j.1745-7270.2005.00108.x. PMID: 16270150.

查看更多

查看更多

查看更多

联系我们

返回顶部