查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上期为大家介绍了T细胞的基因表达调控策略,本期我们将系统介绍内皮细胞的基因调控策略。体外细胞实验,我们一般不需要特异性,只需要选择适合感染内皮细胞的病毒载体作为基因递送工具即可。对于体内内皮细胞的基因调控策略,将从靶向内皮细胞的AAV血清型、内皮细胞特异性启动子、注射方式等方面展开分享。

内皮细胞,也称为血管内皮细胞(Vascular Endothelial cells,VECs),是位于血液与血管组织之间的一种单层扁平上皮细胞,细胞形态呈多边形,衬贴在心脏、血管和淋巴管等血管内表面[1]。
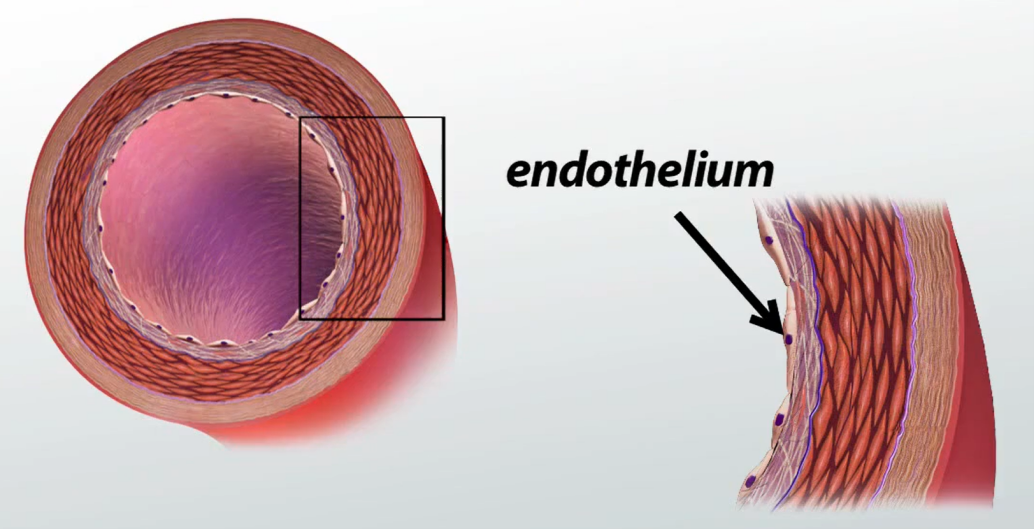
图1. 内皮细胞在血管的位置分布
在脊椎动物中,原始内皮细胞起源于中胚层,在随后的发育中可以转化为动脉、静脉、淋巴血管等组织特异性内皮细胞,其在血管发育中功能具有较大差异[2]。
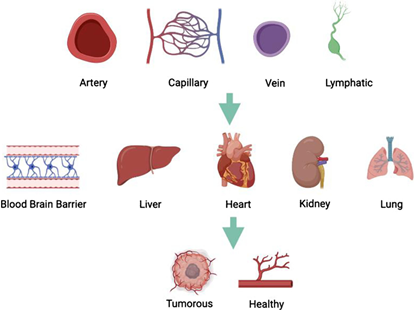
图2. 内皮细胞类型
内皮细胞由于所处位置不同的关系,其在血管与周围组织之间建立了至关重要的物理屏障。通过调节通透性,内皮细胞充当“筛子”的角色,精确控制物质和流体在血管与组织之间的运输,这对于调节组织稳态至关重要。
目前,心血管疾病仍然位居全球死因首位,内皮细胞(Endothelial cells,ECs)在这些疾病中扮演着重要角色,尤其在冠状动脉疾病和脑卒中疾病中。此外,由于内皮细胞参与血管的生成,其对肿瘤的生长也至关重要。因此,在体外、体内实现内皮细胞的高效与特异性基因表达调控、开发高效靶向内皮细胞疗法就显得尤为重要。那么,如何实现将目的基因高效导入特定的内皮细胞以及在特定的内皮细胞内表达成了关键[3]。
慢病毒、腺病毒介导体外内皮细胞基因表达调控
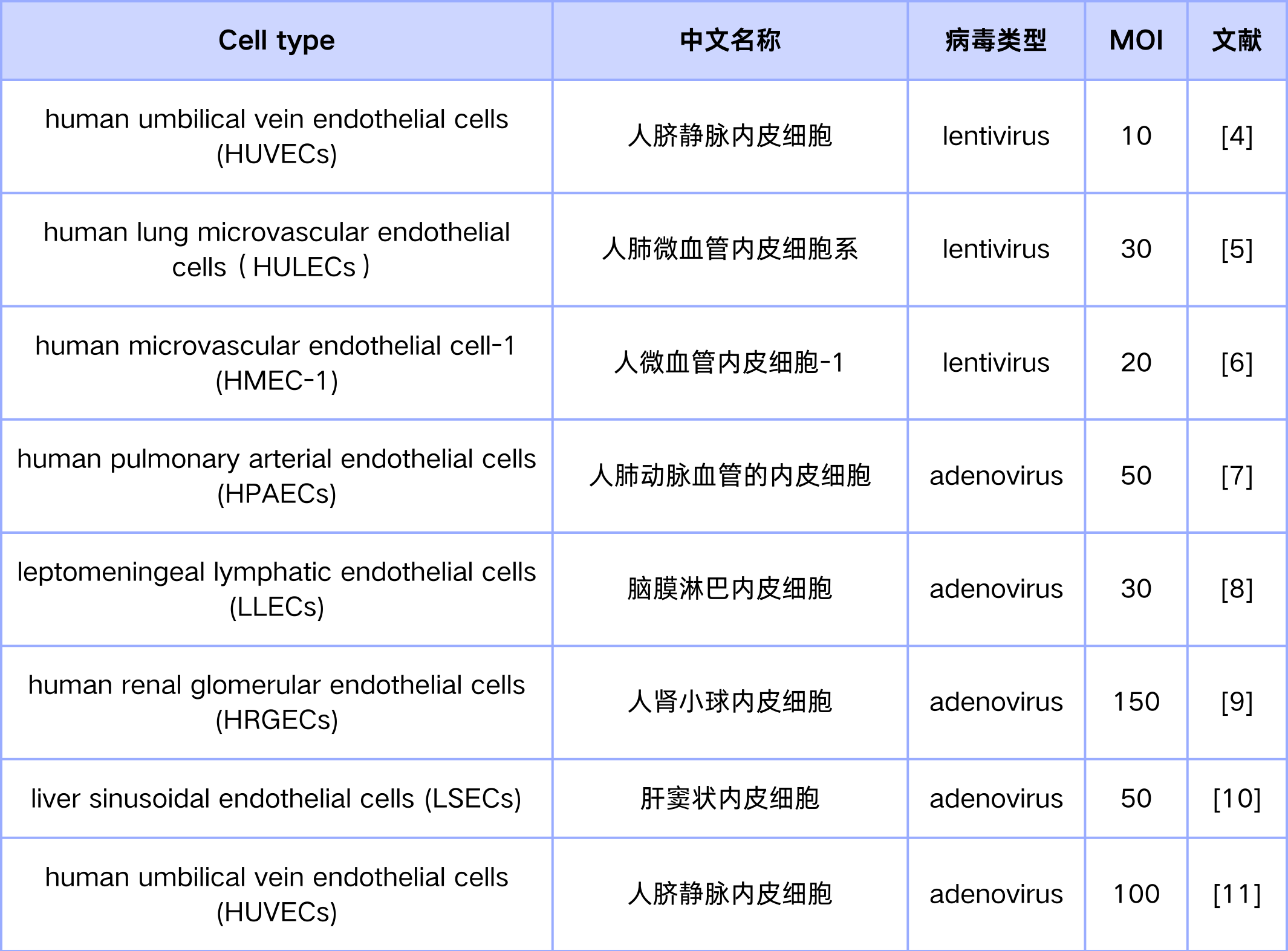
体外实验中常用到原代内皮细胞和永生化的内皮细胞系,一般都是单一细胞,感染过程中不需要考虑表达特异性的问题,更多的是考虑后续实验的需求。作为常用的基因表达调控工具,慢病毒(LV)、腺病毒(ADV)对于各种内皮细胞均有较好的感染效率。慢病毒感染细胞后目的序列会整合到宿主基因组上,可以稳定传递,因此,若需要构建稳定表达细胞株时,推荐使用慢病毒。慢病毒对于原代细胞的感染效率不佳,并且容量有限,因此对于很多原代细胞或编码序列较长的基因,慢病毒常难满足需求,而腺病毒的特点则完美互补了这一缺陷。对于大多数原代细胞而言,腺病毒有更好的感染效率,并且腺病毒基因组较大,通过改造后的重组腺病毒能容纳更大的外源插入序列。因此只要选择恰当的病毒工具,并配合适当的感染条件,在细胞水平上实现内皮细胞的基因表达调控不是难事。这里,我们也根据汉恒生物客户发表的文章整理了部分内皮细胞感染所选择的病毒种类与采用的最佳感染复数(MOI)供大家参考(表1)。
表1. 慢病毒、腺病毒感染不同内皮细胞MOI值
对于直接分离的原代内皮细胞,由于分离条件等原因,其他类型细胞混杂的情况无法完全避免,此时使用常规广谱启动子的慢病毒和腺病毒难以实现内皮细胞中目的基因的特异性调控。通过在载体中引入内皮特异性启动子可以解决这一难题,如后文将要介绍到的TIE启动子可以使目的基因只在内皮细胞中被调控,而混杂的其他细胞不受影响。
AAV介导体内内皮细胞基因表达调控
而对于体内的内皮细胞,情况则要复杂得多,通常会采用腺相关病毒(AAV)来实现在体的内皮细胞基因调控。接下来将从血清型、特异性启动子以及注射方式几个方面详细介绍利用AAV载体实现特异性基因调控的策略。
一、血清型选择
目前已发现AAV有12种血清型、100多种变体,其区别主要在于Cap基因(编码衣壳蛋白)的不同。不同的血清型对组织或器官有着不同的亲和性,从而导致对不同的组织和细胞感染效率不同。
通过对AAV2 RC质粒进行改造,获得不同血清型的RC质粒。在包装病毒时,将RC质粒、腺病毒辅助质粒以及含有目的基因的AAV表达质粒一起转染293细胞,获得不同血清型的重组AAV病毒颗粒(rAAV),如图3所示。
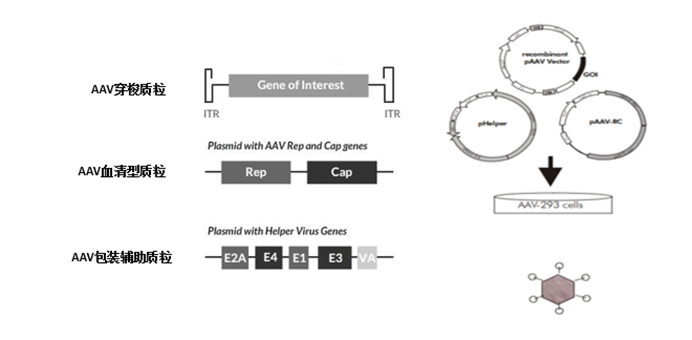
图3. AAV病毒载体的包装示意图
为实现特异性靶向内皮细胞,汉恒生物公司有多种血清型可供选择(表2)。
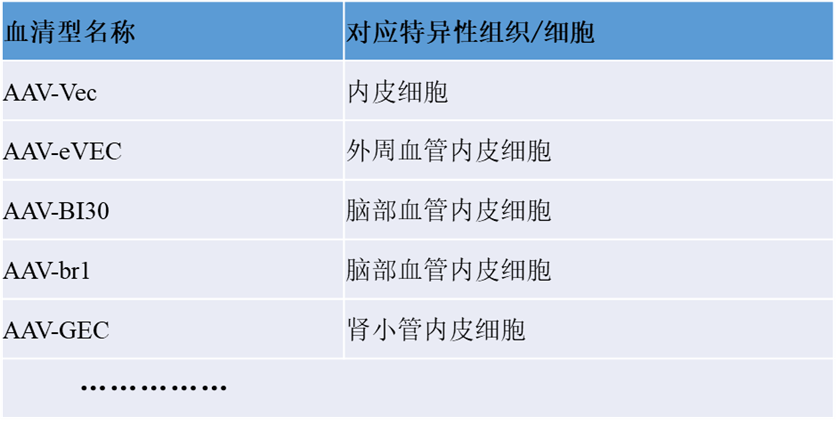
在内皮细胞靶向的早期研究中,体外实验发现,AAV1 和 AAV5 血清型相对于 AAV2 具有更高的内皮细胞转导效率。AAV1在转导后7天表现出最高的转导效率,AAV5 载体在第14天和第21天表现出更强且更稳定的表达水平,甚至超过了AAV1。因此,AAV5血清型被认为是对血管内皮细胞具有较好的嗜性[12]。
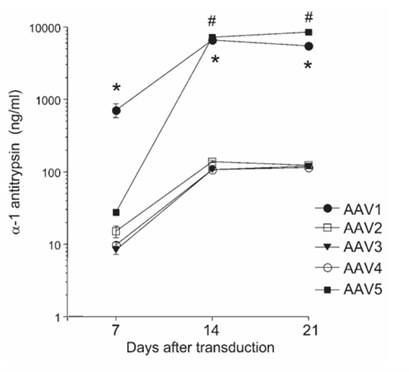
图4. AAV1,AAV5血清型体外感染内皮细胞效率比较
图5是客户使用汉恒生物提供的跨血脑屏障血清型AAV-BR1血清型过表达TIMP1或者AlaTIMP1基因。尾静脉注射小鼠AAV-BR1-TIMP1-Flag或AAV-BR1-AlaTIMP1-Flag两周后,通过Flag(绿色)和内皮细胞标记物CD31(红色)的免疫荧光染色分析目的基因在脊髓皮层中的表达情况[13]。
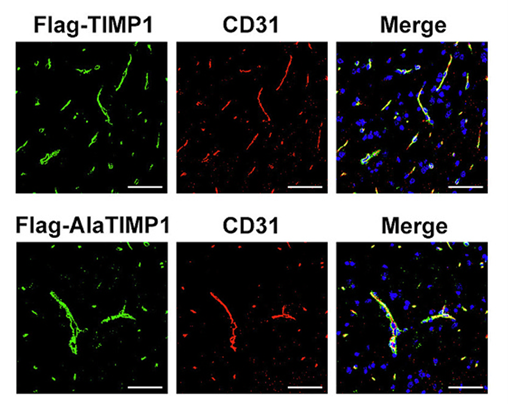
图5. BR1血清型感染脊髓内皮细胞
AAV-BR1更倾向于感染脑微血管内皮细胞,即毛细血管内皮细胞,对于动脉和静脉内皮的感染效率相对不足。为了解决这一问题,科研人员在AAV9血清型的基础上进行改造,并命名为AAV-BI30血清型。经实验验证,AAV-BI30能够有效感染脑部动脉、静脉和毛细血管的内皮,而AAV-BR1主要局限于毛细血管内皮,如图6所示。因此,相比于AAV-BR1血清型,AAV-BI30感染脑血管内皮细胞的效率更高、用途更广。除大脑外,对整个中枢神经系统和视网膜血管的内皮细胞也有很好的嗜性[14]。
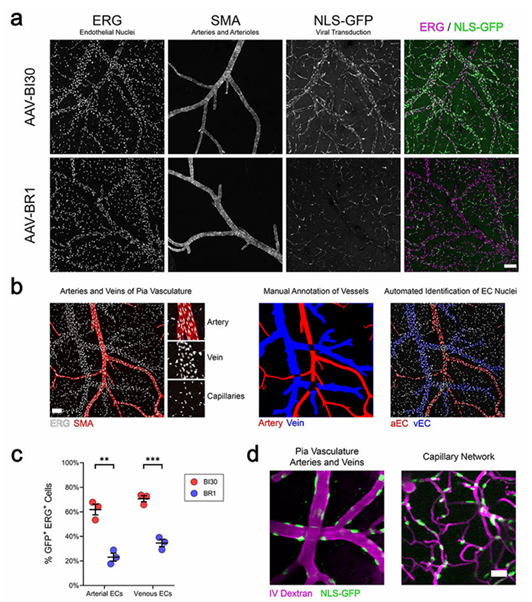
图6. AAV-BI30高效转导大脑动、静脉内皮细胞
图7展示的结果是研究人员开发的AAV-GEC血清型在静脉注射小鼠后,可以特异且高效地靶向肾小球内皮细胞,这为肾小球炎症的肾病治疗提供了可能[15]。
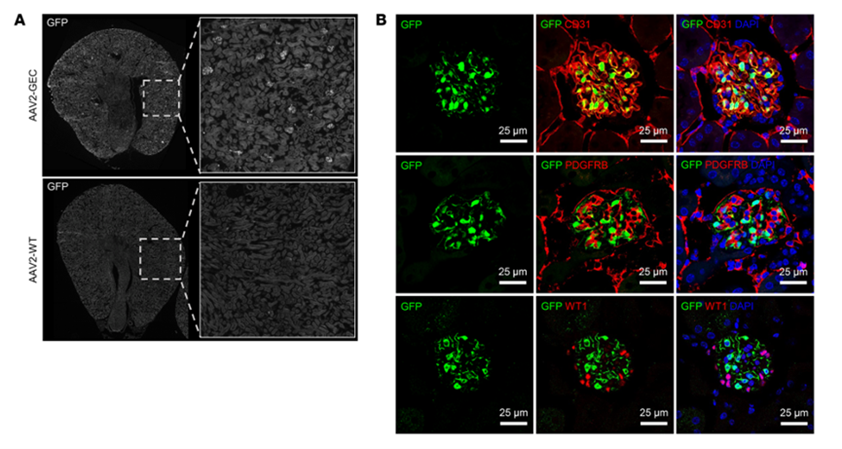
图7. AAV2-GEC特异性转导肾小球内皮细胞
为了高效特异性靶向血管内皮细胞,研究人员构建了带内皮靶向肽VSSSTPR(“Vec”)突变型衣壳,以及之前报道的内皮靶向肽NNPLPQR(“Nec”)突变型衣壳以及野生型AAV2衣壳的腺相关病毒,分别体外感染人脐静脉内皮细胞(HUVEC),观察其对HUVEC细胞的感染效率。结果在不同梯度的GOL(genome-per-cell ratio)条件下,AAV-Vec感染HUVEC细胞的效率均明显高于AAV-Nec以及AAV2,显示了AAV-Vec具有良好的血管内皮细胞的特异性[16]。
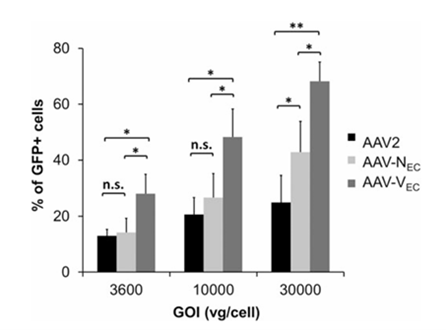
图8. AAV-Vec高效感染血管内皮细胞
二、组织特异性启动子
特异性血清型AAV可以实现组织或细胞特异性感染,然而利用特异性血清型所靶向的范围仍然较宽,如果要在某种特定内皮细胞上实现基因表达调控,仅使用不同的特异性血清型是难以实现的,而特异性启动子就可以提供更多选择(如表2所示)。因此,除了使用特异性血清型外,还可以利用特异性启动子来实现目的基因特异性表达的目的。
表2. 内皮细胞特异性启动子
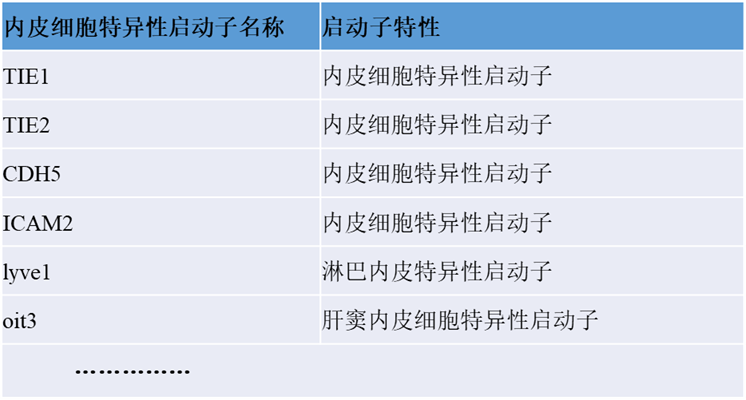
图9是作者使用汉恒生物公司构建的AAV-Tie2-circGNAQ病毒载体,通过尾静脉注射小鼠((1.6 X 10^11 vector genomes [vg]/mice),载体携带Tie2启动子,使得circGNAQ的表达仅限于内皮细胞。最终在小鼠主动脉内膜中检测到circGNAQ的表达量显著高于对照组[17]。
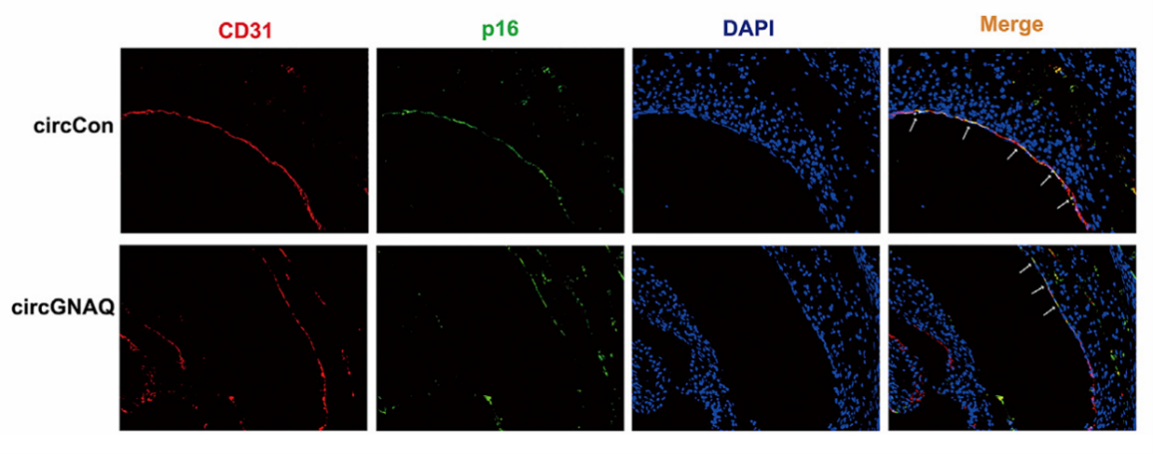
图9. 主动脉内皮细胞特异性过表达circGNAQ
图10作者使用汉恒生物公司构建的腺相关病毒AAV-Vec-Tie1-Pfkfb3和AAV-Vec-Tie1-mir30-Pfkfb3,通过尾静脉注射小鼠(100ul/每只小鼠),特异性地在小鼠心脏内皮细胞中实现Pfkfb3的过表达和敲低,并证明了心脏内皮细胞中Pfkfb3的异常表达参与了内皮细胞向肌细胞转化相关的心脏纤维化[18]。
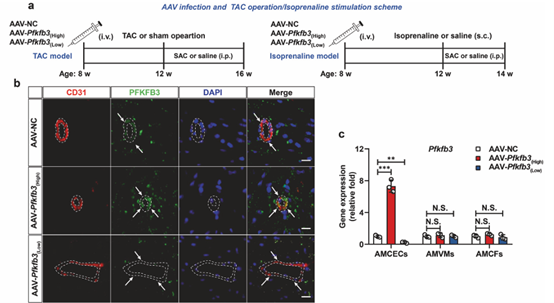
图10. 心脏内皮细胞特异性过表达或敲低Pfkfb3
图11是汉恒生物构建的NHLRC2过表达和干扰腺相关病毒,通过淋巴血管内皮细胞特异性启动子LYVE-1启动子调控NHLRC2的表达。通过侧脑室注射aav病毒(5μL/每只小鼠,注射速度0.2μL/min,病毒滴度1x10^12 vg/ml),实现了在小鼠软脑膜淋巴血管内皮细胞(leptomeningeal Lymphatic Endothelial Cells, LLECs)特异性操控基因表达的目的[19]。

图11. 携带LYVE-1启动子的AAV病毒注射侧脑室注射小鼠
肝窦内皮细胞(Liver sinusoidal endothelial cells,LSECs)是位于肝窦内的高分化内皮细胞,占肝脏细胞20%左右,在调控肝再生、纤维化、脂肪变性等肝脏内各种病理生理过程中起着关键作用。人们已经意识到LSECs的重要作用,但特异性标识LSECs的Marker基因的缺乏,限制了对其分子特性和功能特征的研究。2023年,空军军医大学研究团队通过多种单细胞RNA测序分析发现Oit3是LSECs最特异的Marker,并且构建了Oit3驱动的CreERT2转基因小鼠,并与Rosa26-tdTomato报告小鼠杂交,获得了Oit3-CreERT2-tdTomato小鼠,当Cre酶被激活表达后,Oit3驱动的细胞就会标记为tdTomato,这为探索LSECs在生理和病理状态下的复杂功能和机制提供了可靠的方法[20]。
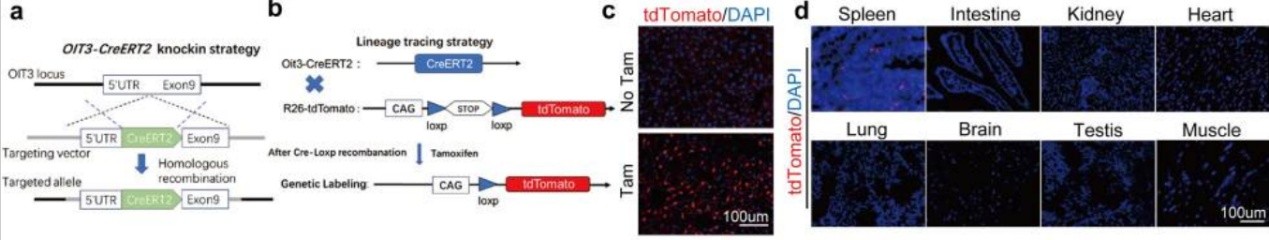
图12. Oit3是肝窦内皮细胞特异性Marker
三、AAV注射方式
在靶向血管内皮细胞过程中,常常可以采用系统性注射(尾静脉注射)、原位注射、脑立体定位注射(针对脑血管内皮细胞)等不同的注射方法。尾静脉注射感染范围较广,操作简单,搭配内皮细胞特异性血清型和特异性启动子,是实验中使用比较多的一种注射方法。
图13是来自于汉恒生物的客户发表的一篇文章,作者是想靶向肺内皮细胞,用到了AAV-Vec血清型病毒,同时载体携带Tie启动子,通过气道递送AAV至靶细胞(50μL/每只小鼠,1*10^12 VG/ml)。注射AAV病毒4周后,在靶细胞中检测到基因的表达。
图13中,者利用气道给药方式将汉恒生物提供的腺相关病毒AAV-Vec-Tie,递送至肺内皮细胞(50μL/每只小鼠,1*10^12 VG/ml)。并在AAV病毒给药4周后,在靶细胞中检测到目的基因的表达[21]。
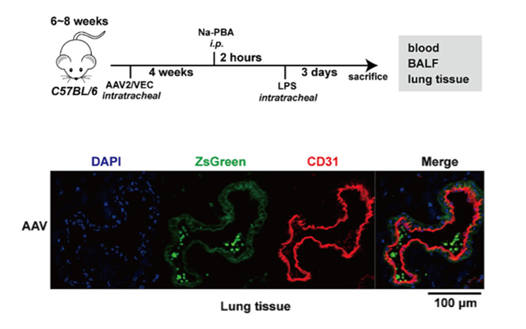
图13. AAV经气道注射至肺脏内皮细胞
此外,还可采用Cre依赖性基因开关(Cre-loxp系统)实现内皮细胞特异性基因表达调控,如用特异性启动子启动cre酶的AAV病毒载体注射至Loxp小鼠、向特异性启动子启动cre酶的小鼠注射Loxp控制靶序列的AAV来实现特异性基因表达调控的目的。
本期内容到这里就结束了,下期我们将会分享自噬相关基因的干货文章,敬请关注。
参考文献:
[1]. https://study.com/academy/lesson/endothelial-cells-function-lesson-quiz.html
[2]. Przysinda A, Feng W, Li G. Diversity of organism-wide and organ-specific endothelial cells[J]. Current cardiology reports, 2020, 22(4): 19.
[3]. Naveed A, Atique R, Saeed H A, et al. Cardiovascular Diseases: Understanding the Leading Cause of Death Worldwide[J]. Global Journal of Multidisciplinary Sciences and Arts, 1(1): 100-110.
[4]. Weng Z, Ren X, Lin W, et al. RCN1 downregulation-driven endoplasmic reticulum stress impairs endothelial function and diabetic foot ulcer healing[J]. Cellular and Molecular Life Sciences, 2025, 82(1): 318.
[5]. He X, Shi J, Bu L, et al. Ursodeoxycholic acid alleviates fat embolism syndrome-induced acute lung injury by inhibiting the p38 MAPK/NF-κB signalling pathway through FXR[J]. Biochemical Pharmacology, 2024, 230: 116574.
[6]. Zhang P, Fu G, Xu W, et al. Up-regulation of miR-126 via DNA methylation in hypoxia-preconditioned endothelial cells may contribute to hypoxic tolerance of neuronal cells[J]. Molecular Biology Reports, 2024, 51(1): 808.
[7]. Meng Y, Zheng C, Zhang X, et al. xCT/Slc7a11 promotes pulmonary arterial hypertension by disrupting AMPKα suppression of mTOR activation[J]. Biochemical Pharmacology, 2025, 236: 116897.
[8]. Deng H J, Xu Y H, Wu K, et al. The sentinel against brain injury post-subarachnoid hemorrhage: efferocytosis of erythrocytes by leptomeningeal lymphatic endothelial cells[J]. Theranostics, 2025, 15(6): 2487.
[9]. Wang D, Zhang L, Nan J, et al. High glucose elevates intracellular calcium level and induces ferroptosis in glomerular endothelial cells through the miR-223-3p/ITPR3 pathway[J]. Molecular and Cellular Endocrinology, 2024, 594: 112384.
[10]. Li H Y, Gao Y X, Wu J C, et al. Single-cell transcriptome reveals a novel mechanism of C-Kit+-liver sinusoidal endothelial cells in NASH[J]. Cell & Bioscience, 2024, 14(1): 31.
[11]. Zhang X, Sun J, Zhang P, et al. miR-342-5p downstream to Notch enhances arterialization of endothelial cells in response to shear stress by repressing MYC[J]. Molecular Therapy Nucleic Acids, 2023, 32: 343-358.
[12]. Chen S, Kapturczak M, Loiler S A, et al. Efficient transduction of vascular endothelial cells with recombinant adeno-associated virus serotype 1 and 5 vectors[J]. Human gene therapy, 2005, 16(2): 235-247.
[13]. Tang J, Kang Y, Chen Q, et al. TIMP1 inhibits Rac1-mediated ROS production to ameliorate blood–spinal cord barrier disruption in amyotrophic lateral sclerosis[J]. Neurobiology of Disease, 2025: 106987.
[14]. Krolak T, Chan K Y, Kaplan L, et al. A high-efficiency AAV for endothelial cell transduction throughout the central nervous system[J]. Nature cardiovascular research, 2022, 1(4): 389-400.
[15]. Wu G, Liu S, Hagenstein J, et al. Adeno-associated virus–based gene therapy treats inflammatory kidney disease in mice[J]. The Journal of clinical investigation, 2024, 134(17).
[16]. Zhang L, Rossi A, Lange L, et al. Capsid engineering overcomes barriers toward Adeno-associated viral (AAV) vector-mediated transduction of endothelial cells[C]//HUMAN GENE THERAPY. 140 HUGUENOT STREET, 3RD FL, NEW ROCHELLE, NY 10801 USA: MARY ANN LIEBERT, INC, 2019, 30(11): A25-A25.
[17]. Wu W, Zhou M, Liu D, et al. circGNAQ, a circular RNA enriched in vascular endothelium, inhibits endothelial cell senescence and atherosclerosis progression[J]. Molecular Therapy Nucleic Acids, 2021, 26: 374-387.
[18]. Zeng H, Pan T, Zhan M, et al. Suppression of PFKFB3-driven glycolysis restrains endothelial-to-mesenchymal transition and fibrotic response[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 303.
[19]. Deng H J, Xu Y H, Wu K, et al. The sentinel against brain injury post-subarachnoid hemorrhage: efferocytosis of erythrocytes by leptomeningeal lymphatic endothelial cells[J]. Theranostics, 2025, 15(6): 2487.
[20]. Li Z W, Ruan B, Yang P J, et al. Oit3, a promising hallmark gene for targeting liver sinusoidal endothelial cells[J]. Signal transduction and targeted therapy, 2023, 8(1): 344.
[21]. Xu J, Wei T, Wang Y, et al. Targeting PARK7: Sodium 4-Phenylbutyrate shields endothelial cells from oxidative stress and GSDME-mediated Pyroptosis in acute lung injury[J]. International Immunopharmacology, 2025, 164: 115386.

查看更多

查看更多

查看更多

联系我们

返回顶部