查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
上期为大家介绍了组织特异性干货分享系列之心肌细胞特异性表达调控,那么本期将继续进行“组织特异性干货分享”,大家一起来了解下脂肪组织特异性表达调控。

脂肪组织是机体中重要的能量储存器官,承担着维持体温、保证代谢的正常运转和保护身体及内脏器官免受机械冲击伤害的功能,还是机体重要的内分泌器官,通过分泌激素和细胞因子发挥作用。
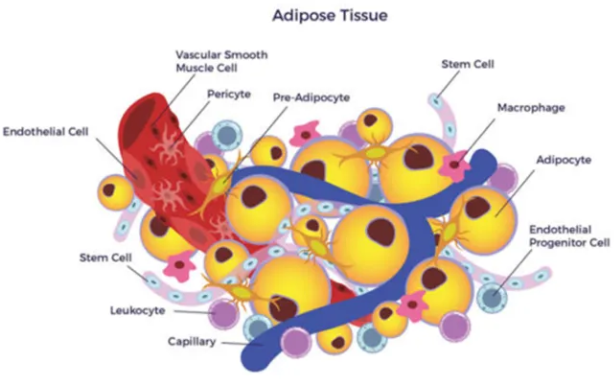
图1 脂肪组织的细胞群构成模式图
脂肪组织的三分之一是成熟的脂肪细胞,其余细胞有成纤维细胞、内皮细胞、巨噬细胞、基质细胞、免疫细胞和前脂肪细胞等,统称为SVF。成熟脂肪细胞根据形态和功能可以分为白色脂肪细胞,棕色脂肪细胞和米色脂肪细胞三种。
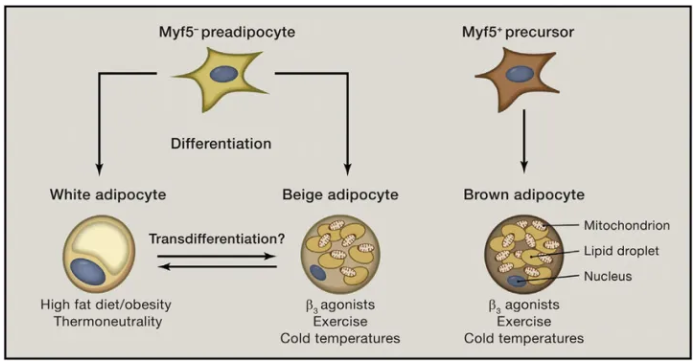
图2 脂肪细胞的分化过程[1]
腺相关病毒(AAV)是基因治疗的重要载体之一,安全性非常高。那么如果用AAV去靶向脂肪细胞呢?本文将详细介绍针对脂肪不同细胞,所用的不同的血清型以及组织特异性的启动子,并结合相关案例进行注射方式的介绍。希望能够为做相关研究的老师们提供一些帮助。
一、血清型
AAV有很多血清型,AAV1、AAV6、AAV7、AAV8、AAV9等血清型被报道常用于感染脂肪组织。西班牙巴塞罗那大学的研究者把AAV1、2、4、5、6、7、8、9血清型分别注射到小鼠的脂肪组织,比较其在脂肪组织中的转导效率,发现AAV8和AAV9血清型在小鼠脂肪组织的转导效率更高[2]。
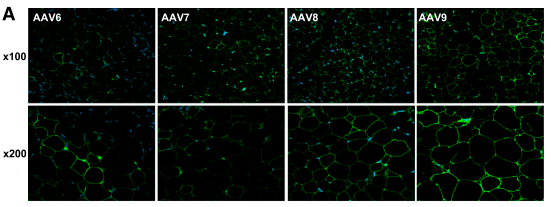
图3 不同血清型在脂肪组织中的转导情况
二、特异性启动子

表1 脂肪细胞特异性启动子
脂肪组织主要由脂肪细胞组成,包括白色、棕色和米色脂肪细胞。除脂肪细胞外,脂肪组织中还含有前脂肪细胞、成纤维细胞、血管内皮细胞及多种免疫细胞等。因此,不同脂肪细胞的感染可以借助不同特异性启动子来实现。汉恒推出了4种脂肪特异性启动子,帮助您构建高效、特异性靶向不同脂肪组织的rAAV载体。
1. FABP4(aP2)脂肪细胞特异性启动子
脂肪酸结合蛋白-4(FABP4),又称脂肪细胞蛋白2(aP2),是一种在巨噬细胞和脂肪细胞中高表达的脂质结合伴侣蛋白。
南京大学蒋晓红教授发现白色脂肪组织来源的外泌体MiR-222可以促进肥胖相关胰岛素抵抗。文章使用了HBAAV2/9-FABP4-3xflag-CD63-EGFP-T2AmCherry(汉恒提供)来分析gWAT的外泌体miR-222的定位。研究结果表明,mCherry仅在注射了AAV的小鼠的gWAT中表达[3]。
注射参数
病毒类型:HBAAV2/9-FABP4-3xflag-CD63-EGFP-T2AmCherry
部位:小鼠腹腔脂肪组织
注射方法:打开腹腔,在脂肪垫内多处注射5ul。
病毒滴度2.0x1012 viral genomes / mL
8周之后取材检测
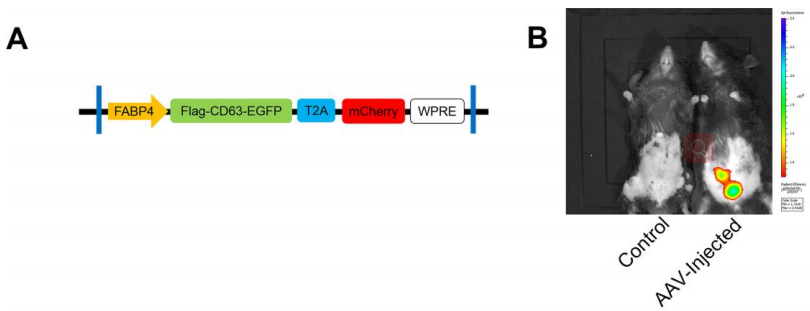
图4 活体成像检测了mCherry的分布
2. adiponectin脂肪细胞特异性启动子
人脂联素启动子adiponectin是成熟脂肪细胞特异性启动子。
美国索尔克生物研究所研究者发现FGF1和胰岛素可以控制脂肪分解[4]。研究者利用免疫印迹证实验验证了用AAV-adiponectin转导小鼠之后的表达情况,GFP仅在成熟脂肪细胞中表达,而在前体脂肪细胞、肝脏、肾等部位没有表达。证明了adiponectin启动子对成熟脂肪细胞的特异性转导作用。
注射参数
病毒类型:AAV-adiponectin,
AAV-adiponectin-PDE4D-GFP
部位:小鼠性腺脂肪组织
注射方法:尾静脉或者眼眶后注射,5x10E+11 genomic copies/只
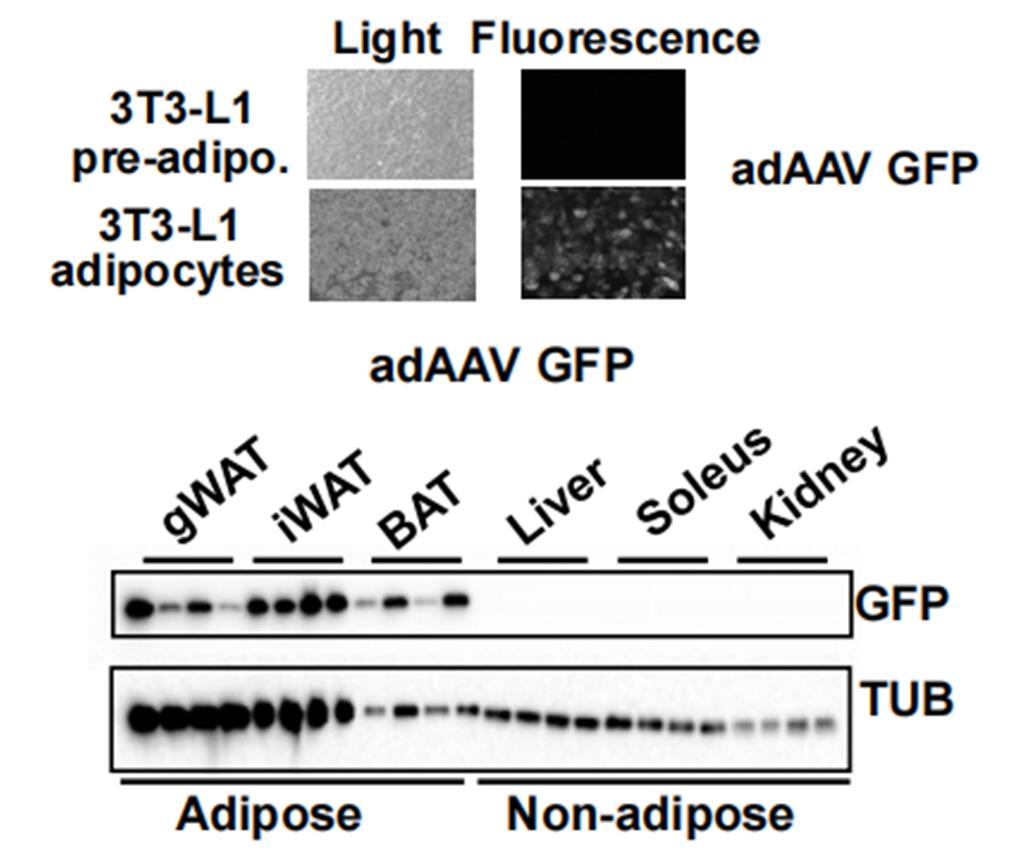
图5 荧光显微镜及免疫印记验证AAV的组织特异性
3. UCP1棕色脂肪细胞特异性启动子
甲状腺激素的两种形式,甲状腺素(T4)及其活性代谢物3,5,3ʹ-三碘甲状腺原氨酸(T3),调节控制能量利用的代谢过程。长期以来,T3一直参与刺激各种组织中的强制性和适应性生热作用。在棕色脂肪组织(BAT),T3通过诱导线粒体解偶联蛋白(UCP1)诱导代谢效率低下来刺激产热。
新加坡国立大学研究者发现甲状腺激素(T3)通过线粒体自噬刺激棕色脂肪组织激活。研究者通过将UCP1启动子驱动的cre表达腺病毒注射到Atg5Flox/Flox小鼠中,生成了Atg5条件敲除小鼠模型(Atg5 cKO),以检测BAT特异性自噬对体内产热的影响。结果表明Atg5 cKO小鼠的体温低于正常小鼠,并且跟正常小鼠相比存在蛋白碳基的积累和线粒体变形[5]。
注射参数
病毒类型:AAV8-UCP1-eGFP,
AAV8-UCP1-iCre
部位:棕色脂肪细胞(Atg5Flox/ Flox mice)
注射方法:尾静脉注射;5x10E+11 genomic copies/只
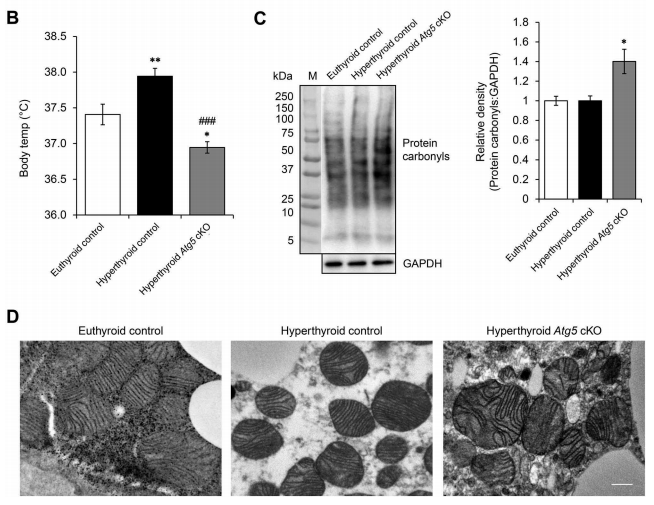
图6 BAT特异性自噬抑制
4. Myf5前体脂肪细胞特异性启动子
肌原性因子5(Myf5),Myf5 Cre细胞系已被用于生成早期缺失相关基因的模型,以用于研究棕色脂肪的发育和功能[6]。
乔治亚州立大学的研究者脂肪前体细胞中Dnmt3b缺乏会促进小鼠肥胖。为了确定棕色脂肪Dnmt3b在饮食诱导的肥胖调节中的作用,研究者通过将Dnmt3b-floxed (fl/fl)小鼠与Myf5-cre小鼠杂交,建立了棕色脂肪骨骼肌系前体细胞(3bKO)中Dnmt3b缺失的遗传模型。3bKO小鼠在棕色脂肪中Dnmt3b mRNA的表达减少(B)。3bKO的iBAT蛋白水平显著降低(C),但iWAT、gWAT(E、F)和肝脏(G)中DNMT3b蛋白水平没有显著降低。这些数据表明,Myf5+特异性靶向的棕色脂肪前体细胞中Dnmt3b的缺失促进了饮食诱导的肥胖和胰岛素抵抗。
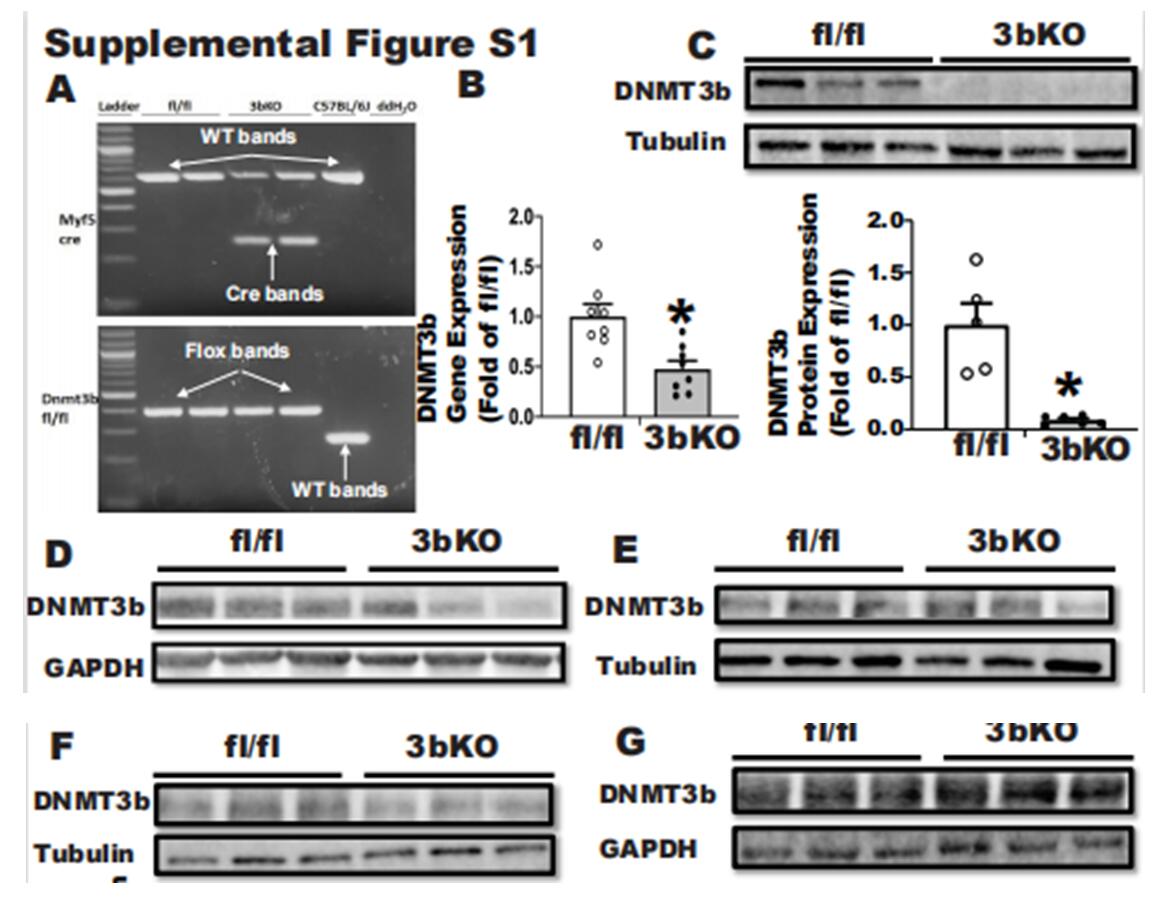
图7 Myf5启动子特异性验证
三、注射方法
针对脂肪组织感染,常采用定点多点注射,其优势在于降低rAAV载体脱靶效应、且病毒用量较少;此外,对于难感染的内脏脂肪或大范围脂肪感染亦可采用腹腔注射AAV来实现。大家可以关注汉恒生物公众号获取动物注射视频资料。
参考文献:
1. Ref: Brestoff, Jonathan & Artis, David. (2015). Immune Regulation of Metabolic Homeostasis in Health and Disease. Cell. 161. 146-160. 10.1016/j.cell.2015.02.022.
2. Jimenez, V., Muñoz, S., Casana, E., Mallol, C., Elias, I., Jambrina, C., Ribera, A., Ferre, T., Franckhauser, S., and Bosch, F. (2013). In vivo adeno-associated viral vector-mediated genetic engineering of white and brown adipose tissue in adult mice. Diabetes 62, 4012–4022.
3. Yujing Zhang, Jing Li, Xiaohong Jiang et al. Gonadal white adipose tissue-derived exosomal MiR-222 promotes obesity-associated insulin resistance. AGING 2020, Vol. 12, No. 22.
4. Gencer Sancar, Sihao Liu, Emanuel Gasser et al. FGF1 and insulin control lipolysis by convergent Pathways.2022, Cell Metabolism 34, 171–183.doi.org/10.1016/j.cmet.2021.12.004.
5. Paul M. Yen, Lei Sun et al. Thyroid hormone (T3) stimulates brown adipose tissue activation via mitochondrial biogenesis and MTOR-mediated mitophagy. RESEARCH PAPER - BASIC SCIENCE. 2019, VOL. 15, NO. 1, 131–150. doi.org/10.1080/15548627.2018.1511263.
6. Wang, S.; Cao, Q.; Cui, X.; Jing, J.; Li, F.; Shi, H.; Xue, B.; Shi, H. Dnmt3b Defificiency in Myf5+ -Brown Fat Precursor Cells Promotes Obesity in Female Mice. Biomolecules 2021, 11, 1087. doi.org/10.3390 /biom11081087.

查看更多

查看更多

查看更多

联系我们

返回顶部