查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
血管系统是人体内的一大循环系统,按广义可分为心脏和全身的血管系统,按部位又可分为心血管(心脏周围的供血系统)、脑血管(脑部供血系统)和外周血管(躯干、四肢和内脏的血管),它们共同维持着机体内环境的稳态、新陈代谢和各组织器官的正常生理机能。

动脉和静脉的管壁主要是由血管内皮细胞和血管平滑肌细胞等组成(图1左)[1],毛细血管则主要是单层的内皮细胞和基膜组成,血管壁细胞在调节血管稳态中起着非常重要的作用。另外,血脑屏障是中枢神经系统的微血管系统,由内皮细胞和周细胞组成(图1右)[2],是血液与大脑进行物质交换、保护神经组织免受毒素和病原体侵害至关重要的屏障。更重要的是,内皮功能障碍或中膜血管平滑肌受损都会导致一系列心血管疾病的发生,例如动脉粥样硬化、主动脉瘤、脑卒中、高血压等等。目前大部分心血管疾病都没有很好的治疗策略,主要以预防和外科手术介入为主,因此研究人员都在积极寻找有效的药物治疗靶点。与此同时,基因治疗的兴起和迅速发展为心血管疾病的治疗拓宽了道路。在往期《AAV在心血管疾病研究中的靶向策略》中通过心脏疾病的 研究,已经为大家介绍了腺相关病毒在靶向心脏中的应用,接下来我们再来看下其在体内靶向感染血管的策略吧。
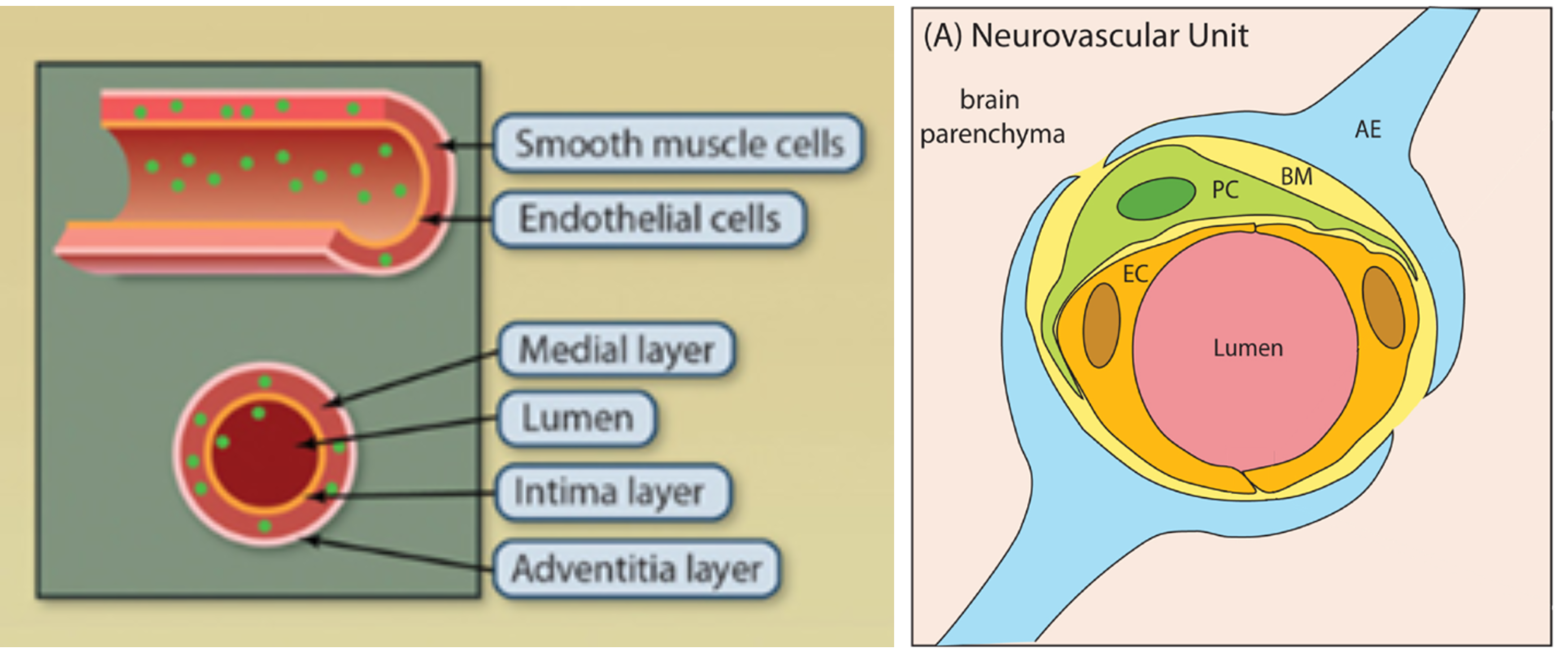
图1 血管解剖结构[1, 2]。左:动、静脉主要结构;右:中枢神经系统微血管结构(EC:内皮细胞;PC:周细胞;BM:基底膜;AE:星形胶质细胞末端)
腺相关病毒载体(adeno-associated virus,AAV)具有安全性好、宿主范围广、免疫源性低、以及长期转基因表达能力等优点,已成为一种有吸引力的基因治疗工具。AAV可以通过携带不同的血清型和组织/细胞特异性启动子去感染相应的组织或细胞,那么目前有哪些血清型和启动子可以靶向心血管呢?除此之外,对于脑血管和外周血管的感染可不可以做到呢?下面将为您一一介绍。
一、血清型选择
AAV血清型是由Cap基因编码的衣壳蛋白决定的,通过识别细胞表面受体来靶向不同的组织器官,从而达到感染特定组织的目的。目前已有研究报道,AAV1、AAV5和AAV9血清型均可感染主动脉(图2,3)[3,4]。
图2 AAV1、AAV2、AAV5感染大鼠主动脉效率比较[3]
图3 AAV9感染小鼠颈动脉[4]
事实上,AAV1、5、9在体内感染的组织具有一定的广泛性。汉恒生物可提供更具靶向性的AAV血清型:AAV-Vec、AAV-eVEC、AAV-BR1和AAV-BI30(表1)。
表1 特异性感染内皮细胞的AAV血清型

(1)AAV-Vec高效感染血管内皮细胞[5]
Vec血清型是在AAV2血清型的基础上改造而来的,它可以与内皮细胞表面的肝素/HSPG结合,尽管与AAV2的结合能力相似,但AAV-Vec的细胞内化率更高。据文献报道,作者将AAV2、AAV-Nec(先前报道过靶向内皮细胞的血清型)、AAV-Vec分别感染人脐静脉内皮细胞(HUVECs),在不同GOI(载体基因组与细胞的比)下,AAV-Vec的感染效率都是最高且具有统计学意义的(图4)[5]。因此,提示AAV-Vec更适合用于体内外转导血管内皮细胞。
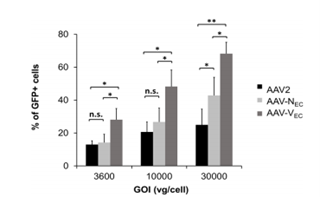
图4 与AAV2相比,AAV-Nec、AAV-Vec转导HUVECs的效率
(2)AAV-BR1高效感染脑微血管内皮细胞
BR1血清型也是通过在AAV2血清型中插入相应多肽筛选出来的,具有非常好的脑血管内皮特异性。据文献报道[6],作者将野生型AAV2、AAV-PPS(先前报道过的脑靶向血清型)、AAV-BR1通过尾静脉注射感染小鼠,2周后经活体成像显示,与AAV2和AAV-PPS相比,AAV-BR1仅在大脑中聚集(图5 左);随后来自小脑、嗅球、纹状体和大脑皮层的免疫荧光结果显示,AAV-BR1所携带的eGFP与内皮细胞标志物CD31在这些部位中共定位(图5 右),表明AAV-BR1能高效感染脑血管内皮细胞。
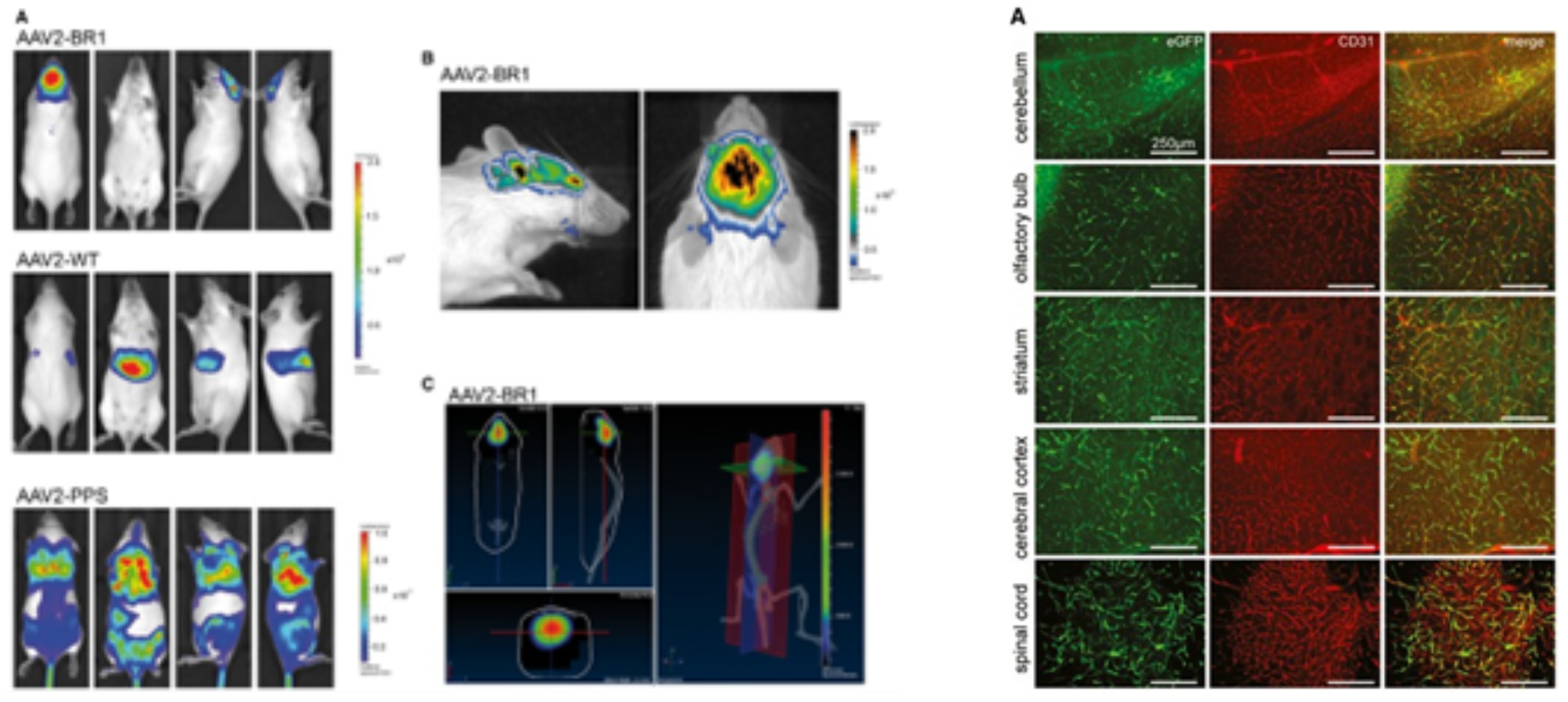
图5 左:AAV-BR1经尾静脉注射靶向感染大脑;右:AAV-BRA1感染脑内皮细胞
(3)AAV-BI30高效感染脑血管内皮细胞
AAV-BR1更倾向于感染脑微血管内皮细胞,即毛细血管内皮细胞,对于动脉和静脉内皮的感染效率相对不足。为了解决这一问题,科研人员在AAV9血清型的基础上进行改造,并命名为AAV-BI30血清型。经实验验证,AAV-BI30能够有效感染脑部动脉、静脉和毛细血管的内皮,而AAV-BR1主要局限于毛细血管内皮(图6)[7]。因此,相比于AAV-BR1,AAV-BI30感染脑血管内皮细胞的效率更高、用途更广;除大脑外,对整个中枢神经系统和视网膜血管的内皮细胞也有很好的嗜性[7]。
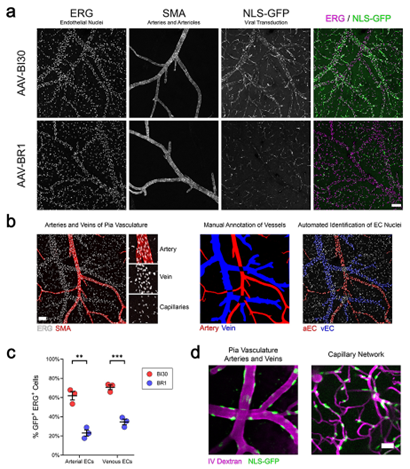
图6 AAV-BI30有效转导大脑动、静脉内皮细胞
二、 组织(细胞)特异性启动子
表2 汉恒生物提供靶向血管细胞的特异性启动子

(1)TIE1内皮细胞特异性启动子
TIE1是一种受体酪氨酸激酶,在血管内皮细胞中特异性表达,因此TIE1启动子可以作为靶向血管内皮细胞的特异性启动子。有文献报道,将AAV-CMV-eGFP和AAV-TIE-eGFP通过颈动脉结扎法注射到家兔动脉腔中,3周后的冰冻切片结果显示,TIE启动子使eGFP在颈动脉内皮细胞中高表达(图7)[8],证实了TIE启动子的血管内皮细胞特异性。
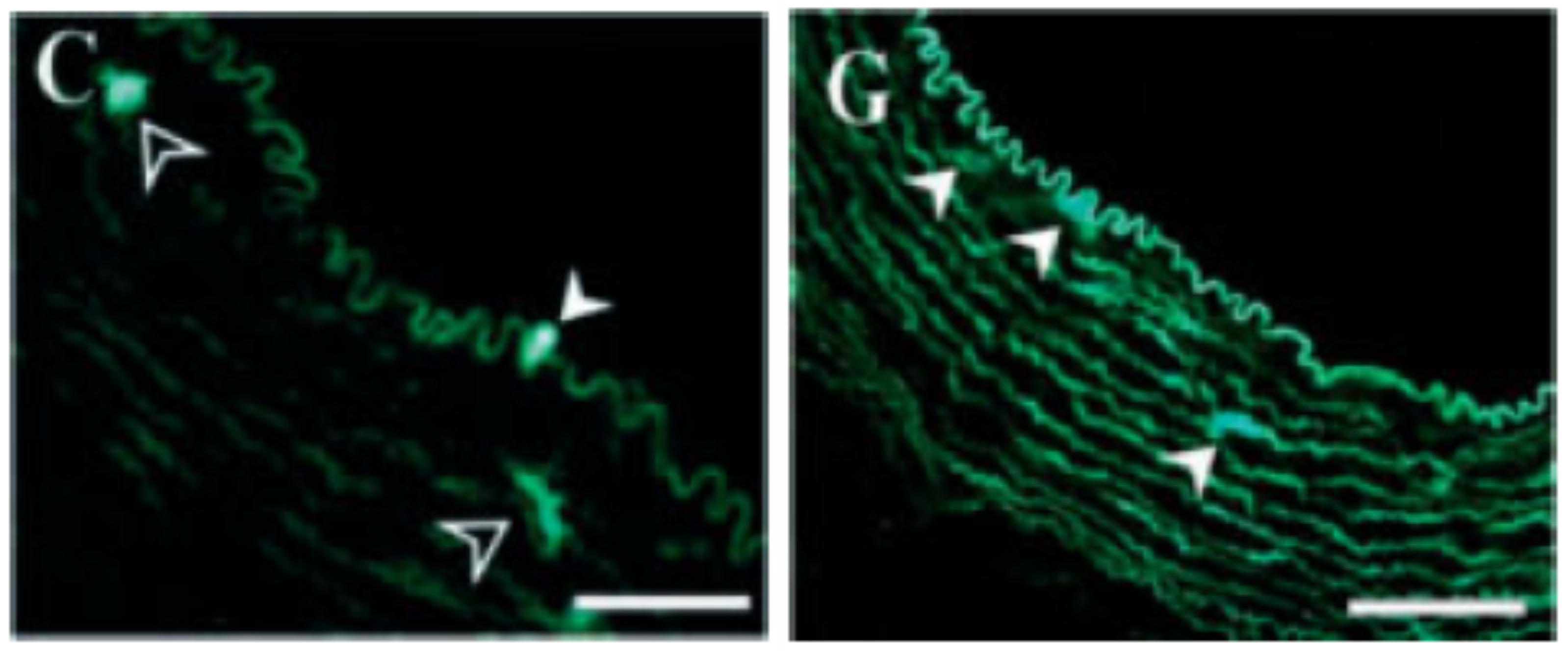
图7 AAV-TIE-eGFP高效感染血管内皮细胞
如图8所示[9],是汉恒生物客户发表在《Antioxidants》杂志上题为“Hydroxysafflor Yellow A Blocks HIF-1α Induction of NOX2 and Protects ZO-1 Protein in Cerebral Microvascular Endothelium”的文章,作者将汉恒生物提供的AAV2/BR1-TIE-miR30-m-Tjp1经小鼠尾静脉注射,成功感染脑微血管内皮细胞,并实现对目的基因ZO-1的敲低。
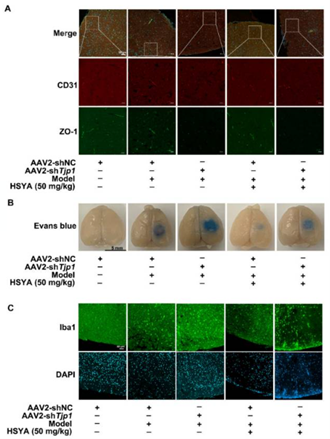
图8 AAV2/BR1-TIE-miR30-m-Tjp1感染小鼠脑微血管内皮细胞并敲低ZO-1
(2)SM22α平滑肌细胞特异性启动子
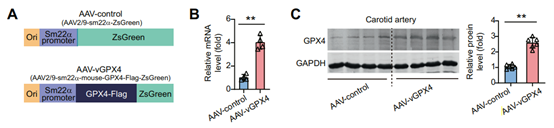
图9 AAV2/9-SM22α-mGPX4-Flag-ZsGreen感染小鼠颈动脉血管平滑肌细胞并过表达GPX4
三、注射方式和剂量
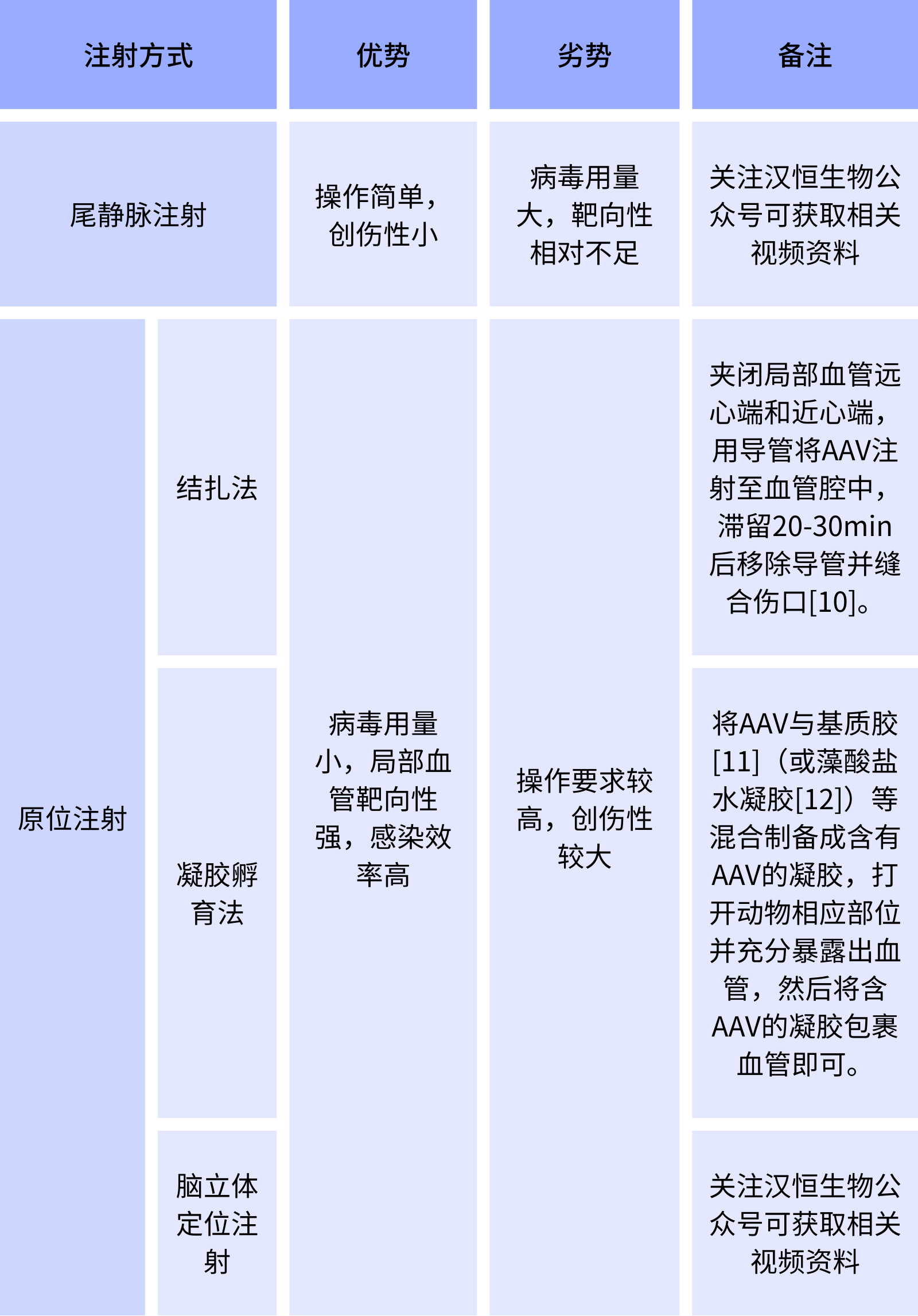
向血管递送AAV的方式主要有系统性注射(尾静脉注射)、原位注射(结扎法和凝胶孵育),对于脑血管感染还可以采用脑立体定位注射(表3)。
表3 血管递送AAV的方式
心血管系统的血管部分就介绍到此,大家可以查阅往期内容《AAV在心血管疾病研究中的靶向策略》,进一步了解AAV在心脏中的应用策略吧。后续我们将会给大家带来更多体内不同组织/细胞特异性调控的干货,敬请关注。
参考文献:
[1] North BJ, Sinclair DA. The intersection between aging and cardiovascular disease. Circ Res. 2012 Apr 13;110(8):1097-108. doi: 10.1161/CIRCRESAHA.111.246876.
[2] Langen UH, Ayloo S, Gu C. Development and Cell Biology of the Blood-Brain Barrier. Annu Rev Cell Dev Biol. 2019 Oct 6;35:591-613. doi: 10.1146/annurev-cellbio-100617-062608.
[3] Chen S, Kapturczak M, Loiler SA, Zolotukhin S, Glushakova OY, Madsen KM, Samulski RJ, Hauswirth WW, Campbell-Thompson M, Berns KI, Flotte TR, Atkinson MA, Tisher CC, Agarwal A. Efficient transduction of vascular endothelial cells with recombinant adeno-associated virus serotype 1 and 5 vectors. Hum Gene Ther. 2005 Feb;16(2):235-47. doi: 10.1089/hum.2005.16.235.
[4] Chen Q, Zhai H, Li X, Ma Y, Chen B, Liu F, Lai H, Xie J, He C, Luo J, Gao J, Yang Y. Recombinant adeno-associated virus serotype 9 in a mouse model of atherosclerosis: Determination of the optimal expression time in vivo. Mol Med Rep. 2017 Apr;15(4):2090-2096. doi: 10.3892/mmr.2017.6235.
[5] L. Zhang, A. Rossi, L. Lange, N. Meumann, U. Koitzsch, K. Christie, M.A. Nesbit, C.B.T. Moore, U.T. Hacker, M. Morgan, D. Hoffmann, J. Zengel, J.E. Carette, A. Schambach, A. Salvetti, M. Odenthal, and H. Büning. Capsid Engineering Overcomes Barriers Toward Adeno-Associated Virus Vector-Mediated Transduction of Endothelial Cells. Hum Gene Ther. 2019 Sep;30(10):1-46. doi: 10.1089/hum.2019.027.
[6] Körbelin J, Dogbevia G, Michelfelder S, Ridder DA, Hunger A, Wenzel J, Seismann H, Lampe M, Bannach J, Pasparakis M, Kleinschmidt JA, Schwaninger M, Trepel M. A brain microvasculature endothelial cell-specific viral vector with the potential to treat neurovascular and neurological diseases. EMBO Mol Med. 2016 Jun 1;8(6):609-25. doi: 10.15252/emmm.201506078.
[7] Krolak T, Chan KY, Kaplan L, Huang Q, Wu J, Zheng Q, Kozareva V, Beddow T, Tobey IG, Pacouret S, Chen AT, Chan YA, Ryvkin D, Gu C, Deverman BE. A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System. Nat Cardiovasc Res. 2022 Apr;1(4):389-400. doi: 10.1038/s44161-022-00046-4.
[8] Gruchała M, Bhardwaj S, Pajusola K, Roy H, Rissanen TT, Kokina I, Kholová I, Markkanen JE, Rutanen J, Heikura T, Alitalo K, Büeler H, Ylä-Herttuala S. Gene transfer into rabbit arteries with adeno-associated virus and adenovirus vectors. J Gene Med. 2004 May;6(5):545-54. doi: 10.1002/jgm.535.
[9] Li Y, Liu XT, Zhang PL, Li YC, Sun MR, Wang YT, Wang SP, Yang H, Liu BL, Wang M, Gao W, Li P. Hydroxysafflor Yellow A Blocks HIF-1α Induction of NOX2 and Protects ZO-1 Protein in Cerebral Microvascular Endothelium. Antioxidants (Basel). 2022 Apr 7;11(4):728. doi: 10.3390/antiox11040728.
[10] Ji QX, Zeng FY, Zhou J, Wu WB, Wang XJ, Zhang Z, Zhang GY, Tong J, Sun DY, Zhang JB, Cao WX, Shen FM, Lu JJ, Li DJ, Wang P. Ferroptotic stress facilitates smooth muscle cell dedifferentiation in arterial remodelling by disrupting mitochondrial homeostasis. Cell Death Differ. 2023 Feb;30(2):457-474. doi: 10.1038/s41418-022-01099-5.
[11] Zhao Y, Xia A, Li C, Long X, Bai Z, Qiu Z, Xiong W, Gu N, Shen Y, Zhao R, Shi B. Methyltransferase like 3-mediated N6-methylatidin methylation inhibits vascular smooth muscle cells phenotype switching via promoting phosphatidylinositol 3-kinase mRNA decay. Front Cardiovasc Med. 2022 Oct 28;9:913039. doi: 10.3389/fcvm.2022.913039.
[12] Remes A, Basha DI, Puehler T, Borowski C, Hille S, Kummer L, Wagner AH, Hecker M, Soethoff J, Lutter G, Frank D, Arif R, Frey N, Zaradzki M, Müller OJ. Alginate hydrogel polymers enable efficient delivery of a vascular-targeted AAV vector into aortic tissue. Mol Ther Methods Clin Dev. 2021 Feb 24;21:83-93. doi: 10.1016/j.omtm.2021.02.017.

查看更多

查看更多

查看更多

联系我们

返回顶部