查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
作为泌尿系统中最重要的器官,肾脏在血液循环系统中承担着滤过排出代谢物并重吸收水和营养物质的重要责任。肾脏也具有内分泌功能,可生成肾素、促红细胞生成素、激肽等。肾单位是组成肾脏的结构和功能的基本单位,包括肾小体和肾小管。肾小体内有一个肾小球,它由肾动脉分支形成。肾小球外有肾小囊包绕。肾小囊分两层,两层之间有囊腔与肾小管的管腔相通。肾小管汇成集合管,若干集合管汇合成乳头管,尿液由此流入肾小盏。
肾脏中有20多种不同的细胞类型,肾小体的主要细胞包括由构成球内毛细血管的内皮细胞、构成肾小囊的上皮细胞、囊壁反折包裹毛细血管形成的足细胞、及连接毛细血管的球内系膜细胞等;肾小管主要由肾小管上皮细胞构成。多种细胞类型和复杂的结构是阻碍肾脏基因治疗的阻碍,因此,有效的基因传导是该器官分子治疗成功的关键。
AAV作为基因递送的重要载体之一,具有高安全性和物种兼容性。针对不同组织和不同细胞选择合适的血清型、特异性启动子和注射方式有效提高AAV的感染效率,接下来,就一起学习AAV在肾脏疾病研究中的靶向递送策略吧!

一、血清型的选择
重组AAV通过改变包装质粒中的cap基因来改变血清型,使其具有不同的组织趋向性或易感细胞类型。已有的研究表明AAV2、AAV6、AAV8、AAV9等血清型可有效感染肾脏内某类或大部分细胞,而AAV8和AAV9型对肾脏不同细胞都具有较好的感染效果,使用最为广泛的为AAV9血清型。
图一所示通过左肾静脉逆行注射将不同血清型AAV-Luc输送至小鼠肾脏,1周至6个月不同时间点体内荧光素酶表达量的变化显示AAV8和AAV9型具有较强的表达。6个月后AAV6、AAV8和AAV9在肾脏如有较好表达。AAV9型可同时在髓质和皮质中保持较好的转导效率。[1]
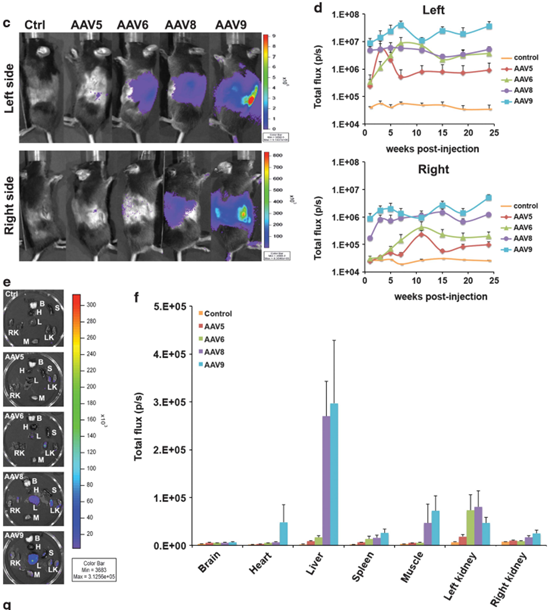
图1. 不同血清型的AAV-Luc通过肾静脉逆行注射感染肾脏
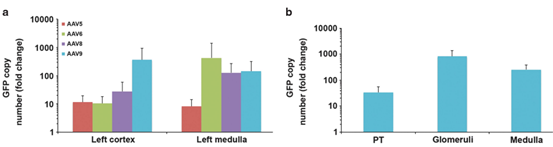
图2. 不同血清型的AAV-GFP通过肾静脉逆行注射感染肾脏
二、组织(细胞)特异性启动子
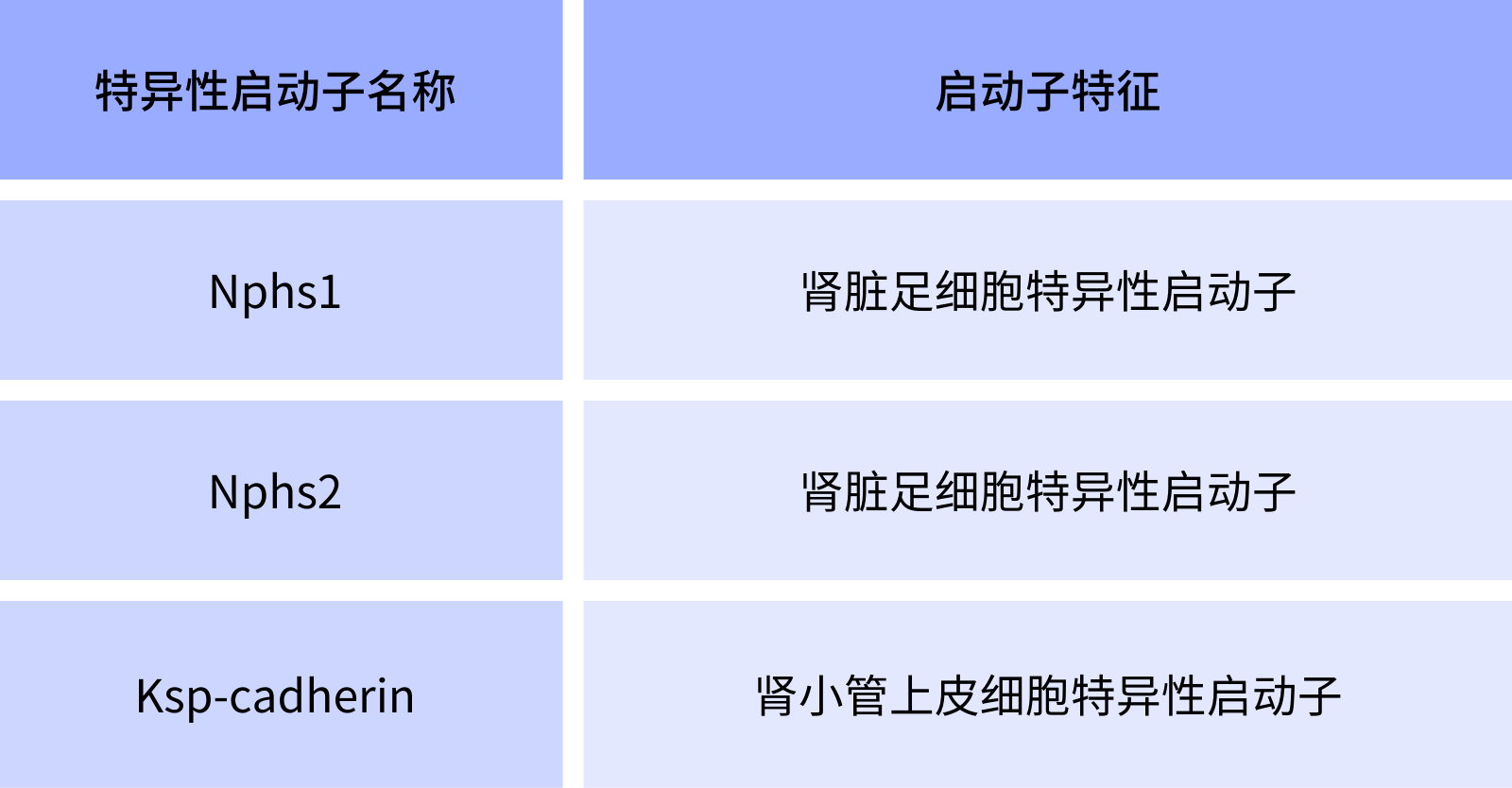
肾脏中细胞构成复杂,尽管血清型在研究中可以选择广谱性启动子CMV,也可以针对不同细胞选择相应的特异性启动子以获得最佳感染效果,如感染肾脏足细胞可选择Nphs1、Nphs2,感染肾小管上皮细胞可使用Ksp-cadherin、SGLT2等。
表一所列为汉恒生物提供的用于肾脏特异性表达调控的启动子,并有试用装可供试用,欢迎咨询。
表1. 汉恒生物肾脏特异性启动子
1.Nphs1足细胞特异性启动子
Nphs1基因表达的正常分子为nephrin前体,在体内通过蛋白分子糖,基化修饰等转变为nephrin。NPHS1在广泛的获得性肾小球疾病中发现了肾单位表达水平的改变,研究学者分离出一个1.25kB的最小启动子区域,该区域可限制基因表达到肾小球基底膜和足细胞。【PMID: 26015958】汉恒生物客户在《Nature Communications》上发表的题为“Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease”的文章通过使用AAV9-Nphs1-Wif1原位注射肾脏,在足细胞上特异性过表达Wif1。[2]
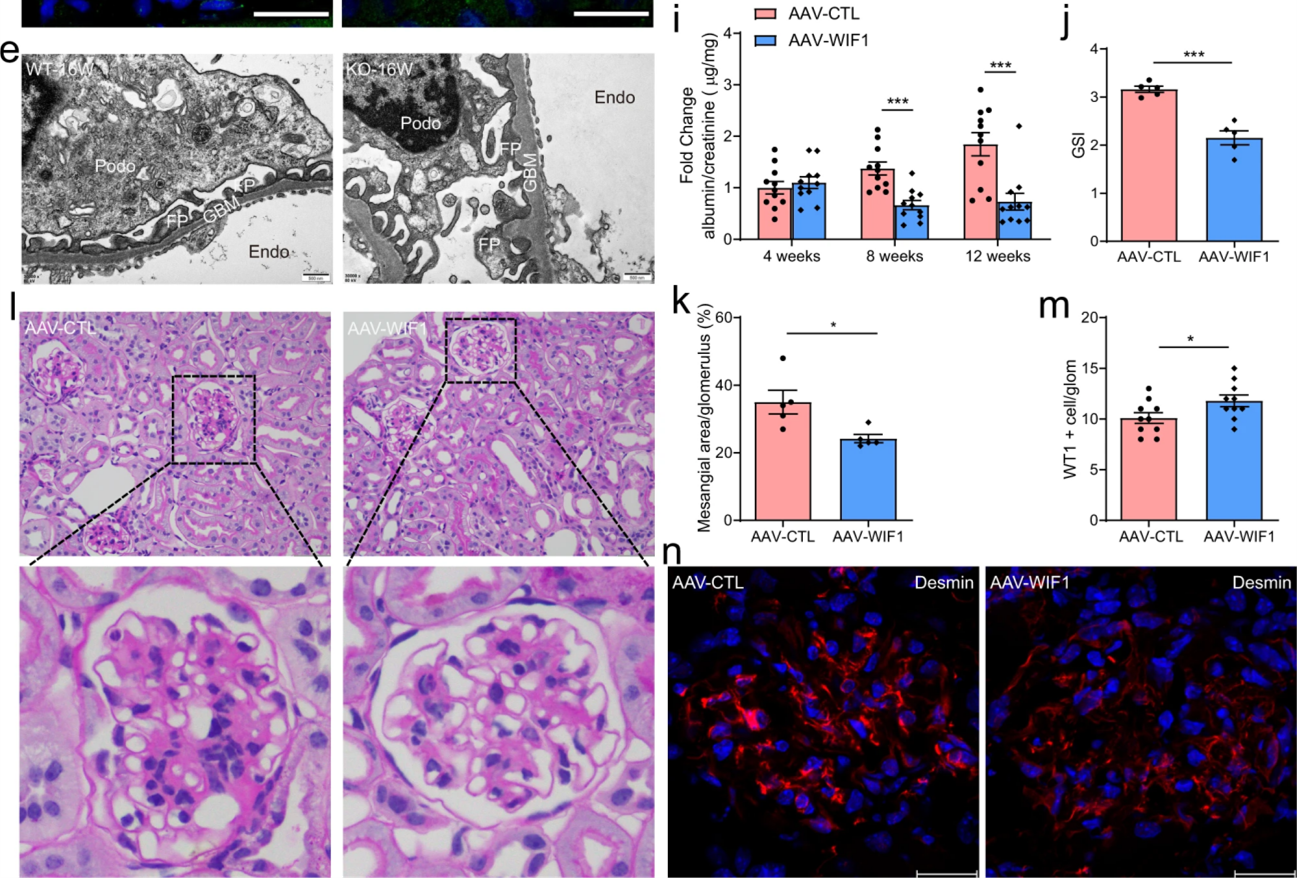
图3. 肾脏多点注射Nphs1启动Wif1表达的AAV9
2.Nphs2足细胞特异性启动子
NPHS2的编码产物肾小球蛋白(podocin)仅在足细胞中表达,其突变导致类固醇抵抗性肾病综合征。基于NPHS2的基因表达特异性,Nphs2启动子载体被设计并成功驱动外源基因在小鼠肾脏足细胞的特异性表达。研究者对小鼠尾静脉注射携带Nphs2启动子的AAV9,12周后的免疫染色结果显示转导效率约为60%。[3]
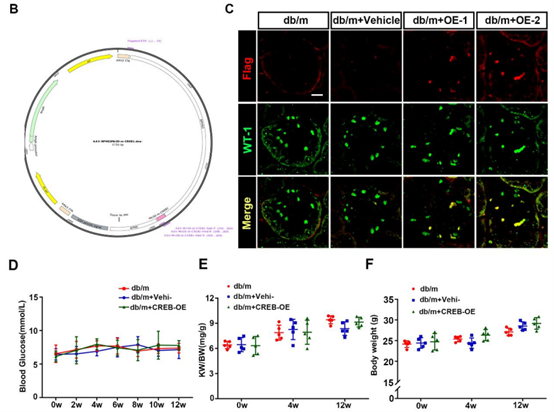
图4. Nphs2驱动GFP在足细胞表达
3.Ksp-cadherin肾小管上皮细胞特异性启动子
肾特异性钙粘蛋白(Ksp-cadherin,Kspc)是钙粘蛋白超家族的一种组织特异性成员,仅在肾小管上皮细胞的基底外膜中表达。研究者将Kspc启动子应用于AAV上,小鼠尾静脉注射两周后GFP主要表达在肾小管。[4]
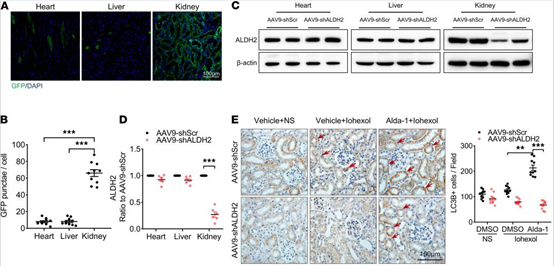
图5. AAV9-Kspc-shALDH2特异性感染肾小管上皮
三、注射方式
肾小球的选择渗透性阻止大多数分子从血液进入肾脏,使用有效的注射方式是使病毒进入肾小球下游肾细胞的关键。尾静脉注射AAV可感染部分肾小球细胞,而对下游肾小管细胞感染效率不佳。近年来,包括肾动脉注射、肾静脉注射、经输尿管逆行给药、肾实质多点注射和肾盂注射等的局部给药途径被陆续开发,并广泛应用于实验动物肾脏组织的感染。[5]下表总结了相关的注射方式以及病毒用量,老师们可以根据需要进行选择。
表2.AAV9注射部位及计量参考
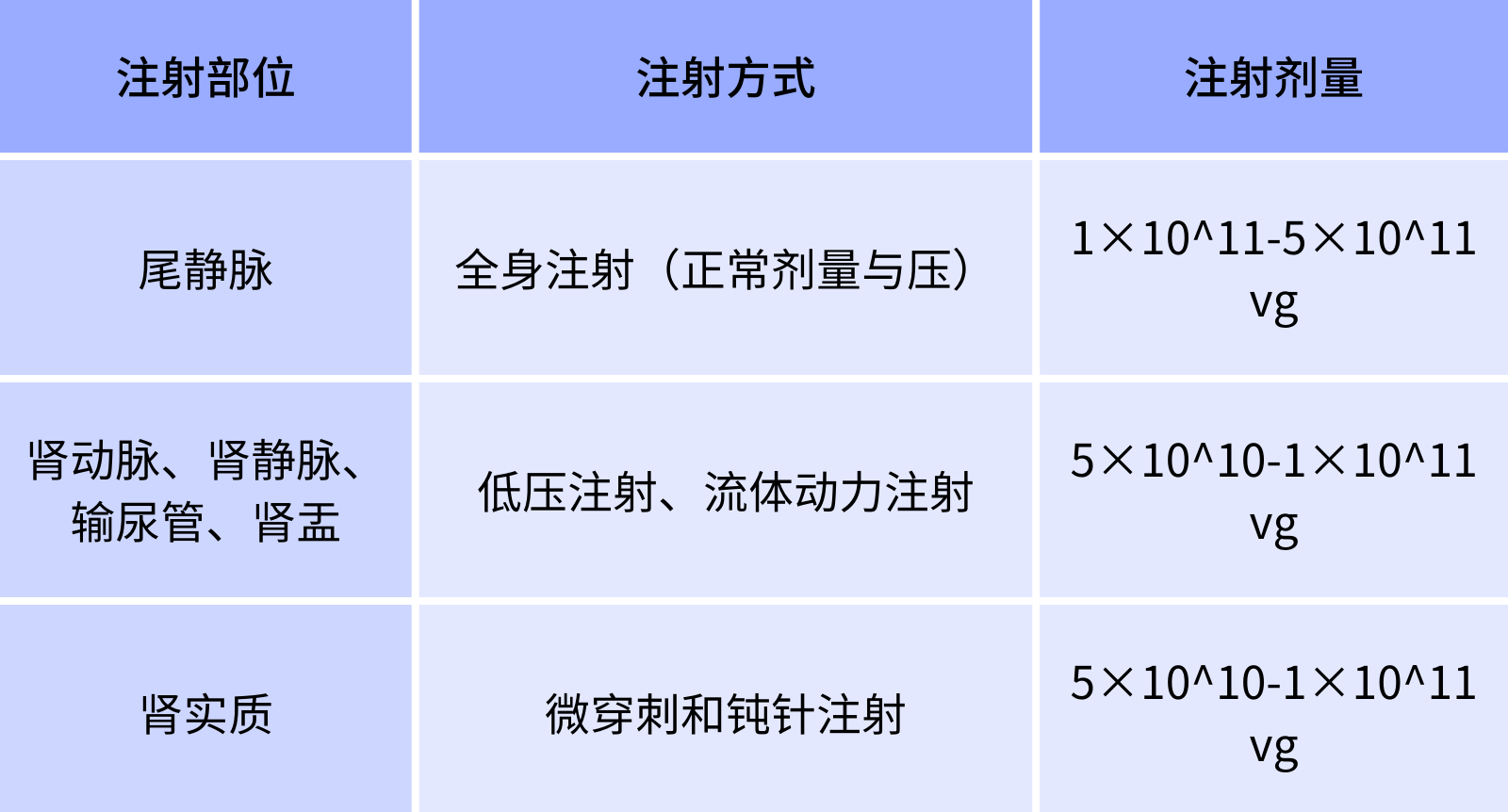
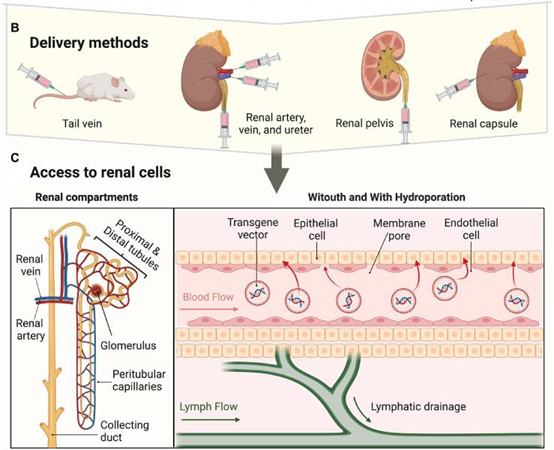
图6. 肾脏的局部载体递送方式
其中,肾实质多点注射和肾盂注射为目前最常使用的一种注射方式。图七所示为汉恒生物客户发表于《Nature Communications》杂志上的题为“Neuraminidase 1 promotes renal fibrosis development in male mice”的一篇文章,作者通过肾实质多点注射(载体为HBAAV9-CMV-Neu1-3xflag-ZsGreen,病毒滴度1.5 × 10^12 vg/mL,注射5个点,10uL/点),成功感染小鼠肾实质。[6]
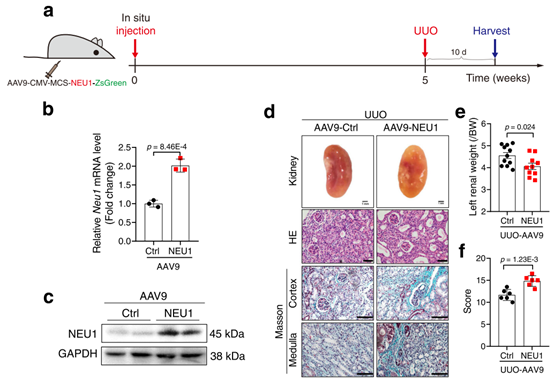
图7. NEU1在肾脏中过表达加重uuo诱导的肾纤维
图八所示为汉恒生物客户在《Acta Pharmacologica Sinica》杂志上发表的题为“Dihydroartemisinin suppresses renal fibrosis in mice by inhibiting DNA-methyltransferase 1 and increasing Klotho”的文章,使用AAV9通过肾盂注射法将shRNA输送至肾脏组织,实现肾脏局部特异性敲低Klotho的目的(注射参数:载体为AAV9,病毒滴度2 × 10^12vg/mL,注射剂量为50uL)。[7]
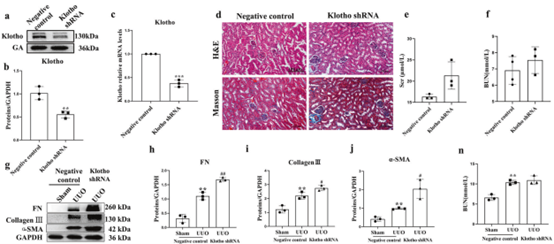
图8. Klotho基因在肾脏中敲低显著加重UUO小鼠的肾纤维化
在相继跟大家分享了神经系统、脂肪、心血管系统与肾脏的组织细胞特异性基因表达调控干货知识后,我们的组织(细胞)特异性表达调控AAV干货系列知识就要暂告一段落了,下期开始,将为大家推送荧光素酶相关的干货知识。
参考文献:
[1] Rocca CJ, Ur SN, Harrison F, Cherqui S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 2014 Jun;21(6):618-28. doi: 10.1038/gt.2014.35
[2] Sun H, Li H, Yan J, Wang X, Xu M, Wang M, Fan B, Liu J, Lin N, Wang X, Li L, Zhao S, Gong Y. Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease. Nat Commun. 2022 Mar 24;13(1):1600. doi: 10.1038/s41467-022-29277-6
[3] Zheng W, Guo J, Lu X, Qiao Y, Liu D, Pan S, Liang L, Liu C, Zhu H, Liu Z, Liu Z. cAMP-response element binding protein mediates podocyte injury in diabetic nephropathy by targeting lncRNA DLX6-AS1. Metabolism. 2022 Apr;129:155155. doi: 10.1016/j.metabol.2022.155155
[4] Xu T, Guo J, Wei M, Wang J, Yang K, Pan C, Pang J, Xue L, Yuan Q, Xue M, Zhang J, Sang W, Jiang T, Chen Y, Xu F. Aldehyde dehydrogenase 2 protects against acute kidney injury by regulating autophagy via the Beclin-1 pathway. JCI Insight. 2021 Aug 9;6(15):e138183. doi: 10.1172/jci.insight.138183
[5] Corridon PR. Still finding ways to augment the existing management of acute and chronic kidney diseases with targeted gene and cell therapies: Opportunities and hurdles. Front Med (Lausanne). 2023 Mar 7;10:1143028. doi: 10.3389/fmed.2023.1143028
[6] Chen QQ, Liu K, Shi N, Ma G, Wang P, Xie HM, Jin SJ, Wei TT, Yu XY, Wang Y, Zhang JY, Li P, Qi LW, Zhang L. Neuraminidase 1 promotes renal fibrosis development in male mice. Nat Commun. 2023 Mar 27;14(1):1713. doi: 10.1038/s41467-023-37450-8
[7] Zhou W, Chen MM, Liu HL, Si ZL, Wu WH, Jiang H, Wang LX, Vaziri ND, An XF, Su K, Chen C, Tan NH, Zhang ZH. Dihydroartemisinin suppresses renal fibrosis in mice by inhibiting DNA-methyltransferase 1 and increasing Klotho. Acta Pharmacol Sin. 2022 Oct;43(10):2609-2623. doi: 10.1038/s41401-022-00898-3

查看更多

查看更多

查看更多

联系我们

返回顶部