查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
阿尔茨海默病(Alzheimer's disease, AD)是一种慢性进行性神经系统疾病,常见于老年人,特别是65岁以上的人群。最初,阿尔茨海默病的症状可能是轻微的记忆问题,例如难以记住最近发生的事件或容易迷失。随着病情进展,患者的记忆和思维能力受到了严重影响,可能会忘记熟悉的人和事物,变得困惑和易怒,甚至可能失去自理能力。阿尔茨海默病的治疗难题在于我们尚未完全了解其发病机制。目前,普遍认为的机制是,β淀粉样蛋白的生成和清除失衡是导致神经元变性和痴呆的始动因素。异常水平的β淀粉样蛋白在大脑神经元之间形成斑块,产生神经毒性,导致神经元退化。研究阿尔茨海默病有助于我们深入了解该疾病的发生机制和诊断方法,进而提供更为有效的治疗方法和支持策略,从而提高患者的生活质量。
2023年7月12日,福建医科大学陈晓春教授课题组在《Molecular Neurodegeneration》(IF=15.1/Q1)杂志上发表了名为《ACSS2-dependent histone acetylation improves cognition in mouse model of Alzheimer’s disease》的研究论文。乙酰辅酶A池对组蛋白乙酰化起关键作用,而组蛋白乙酰化则控制着突触的可塑性。突触可塑性的损害是导致阿尔茨海默病(Alzheimer’s Disease, AD)患者认知损害的重要机制之一。该研究提示了ACSS2作为调节神经元组蛋白乙酰化的代谢酶,是认知障碍的关键分子开关,靶向ACSS2或给予乙酸盐补充剂可能是治疗中晚期AD的新策略。文中使用了来自汉恒生物的腺相关病毒AAV,对海马ACSS2进行了沉默,推动了相关实验研究进展。
在这项研究中,通过检测2、5和8月龄的5×FAD小鼠(阿尔茨海默病模型小鼠)海马中组蛋白乙酰化相关基因的mRNA表达水平,发现大多数基因的表达水平没有明显变化。但是,在8月龄时, ACSS2基因mRNA和蛋白表达水平显著下降。为了进一步验证这一结果,作者检测了10月龄的5×FAD小鼠海马和脑前额叶中ACSS2蛋白的表达水平,并与同年龄段的野生型小鼠相比,发现5×FAD小鼠海马和前额叶皮层中的ACSS2表达水平显著降低(图1A)。免疫荧光共染色结果还显示,在5×FAD小鼠的CA1锥体神经元中,ACSS2的表达明显降低(图1B)。此外,AD患者死后颞叶皮层中ACSS2蛋白水平也呈下降趋势(图1C)。进一步的研究发现,5×FAD小鼠海马细胞核中的ACSS2明显减弱(图1D)。由于ACSS2可催化乙酸盐生成乙酰辅酶A,接下来,研究人员检测了海马中乙酰辅酶A的水平,并发现10月龄的5×FAD小鼠的全细胞、细胞质和细胞核中乙酰辅酶A的水平均显著低于同年龄段的的野生型小鼠(图1E)。由于乙酰辅酶A对组蛋白乙酰化和神经元基因表达密切相关,作者对5×FAD小鼠海马中与空间学习和记忆相关的组蛋白乙酰化(ac-H3K9、ac-H3K27和ac-H4K12)进行检测。结果显示,10月龄的5×FAD小鼠中ac-H3K9和ac-H4K12水平降低(图1F-G)。综上所述,在5×FAD小鼠中,ACSS2的降低伴随着乙酰辅酶A和组蛋白乙酰化水平的下调。
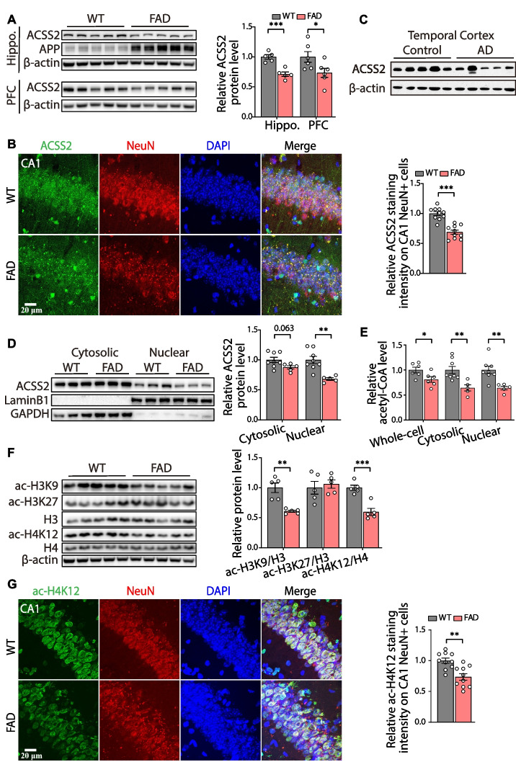
图1 5×FAD小鼠和AD患者认知相关脑区中ACSS2的表达
作者进一步检测了衰老过程中海马ACSS2表达水平,8月龄的5×FAD小鼠中ACSS2蛋白水平显著降低,而10月龄时这种趋势更为明显(图2A)。为了评估8月龄的5×FAD小鼠空间学习和记忆能力,采用了Morris水迷宫(MWM)测试。结果显示,在训练期(1-5天)和实验期(第6天),与同年龄段的野生型小鼠相比,8月龄的5×FAD小鼠表现出更长的逃避潜伏期(指实验动物每次入水后第一次成功找到站台所需的时间)(图2 B)。此外,在测试期间,5×FAD小鼠穿越平台的次数减少(指在撤去站台后,在一定的时间内,实验动物穿越原站台位置的次数),在目标象限的时间也减少(在站台所在象限活动的时间越长,反映了动物的空间记忆能力比较好)(图2 C-D)。进一步的分析表明,ACSS2蛋白水平与在目标象限的时间和穿越平台的次数呈正相关(图2F)。
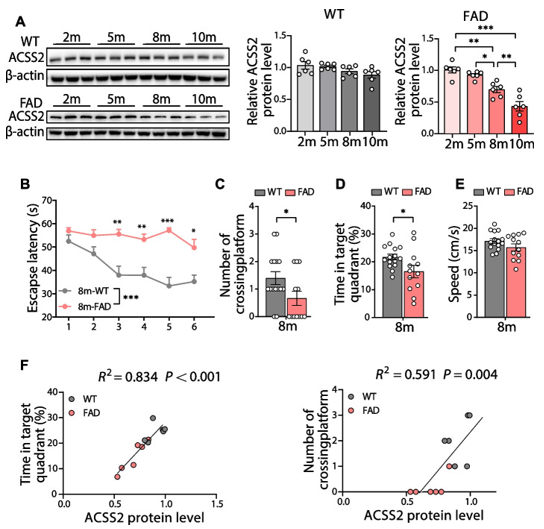
图2 下调ACSS2与5×FAD小鼠的认知损害相关
为了验证ACSS2对5×FAD小鼠认知的影响,作者通过在小鼠背侧海马注射过表达ACSS2的腺相关病毒来弥补这种表达的衰弱(图3A)。Western Blot和免疫荧光分析结果显示,无论是5×FAD小鼠还是野生型小鼠,ACSS2的表达均显著上调(图3B-C)。与FAD-GFP小鼠相比,FAD-ACSS2小鼠在训练期(1-5天)和实验期(第6天)表现出更短的逃避潜伏期(图3D)。同样,在测试期间,上调ACSS2显著增加了穿越平台次数(图3E)和在目标象限的时间(图3F),但并未影响游泳速度(图3G)。综上所述,这些结果表明,上调ACSS2可以在一定程度上减轻5×FAD小鼠的认知功能障碍。
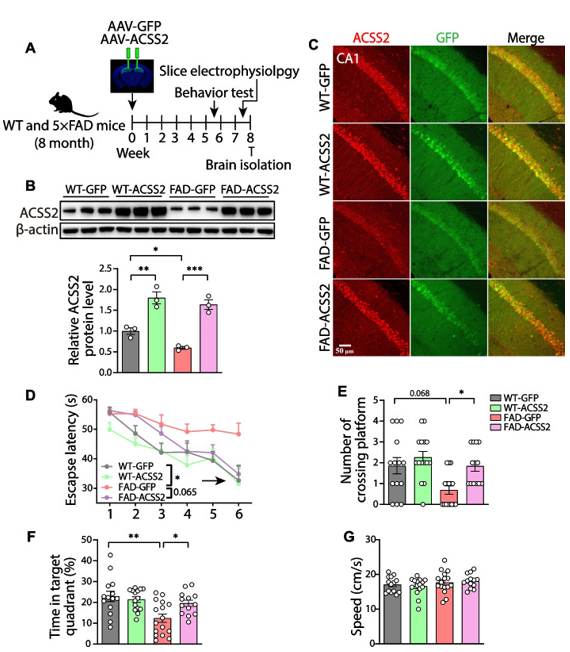
图3 上调ACSS2改善了5×FAD小鼠的认知表现
为了评估上调ACSS2对5×FAD小鼠海马整体信号通路的影响,作者进行了转录组学分析,差异表达基因(DEGs)的筛选标准为FDR<0.05和|fold change|≥1.2。在FAD-GFP小鼠与WT-GFP小鼠之间,有824个差异基因(635个上调基因和189个下调基因);而在FAD-ACSS2小鼠与FAD-GFP小鼠之间,有824个差异基因(548个上调基因和274个下调基因)(图4A)。进一步的KEGG富集分析显示,突触可塑性相关的信号通路(如谷氨酸能突触、轴突导向等)在FAD-GFP小鼠中显著改变 (图4C)。作者进行了加权基因共表达网络分析(WGCNA),鉴定出34个模块,其中Brown模块与FAD-ACSS2小鼠呈正相关(0.94),并与“谷氨酸能突触”、“神经元之间突触”、“不对称突触”、“突触后密度”和“突触后特化”等通路密切相关(图4E)。综上所述,上调ACSS2促进了5×FAD小鼠中与突触可塑性相关的信号通路。
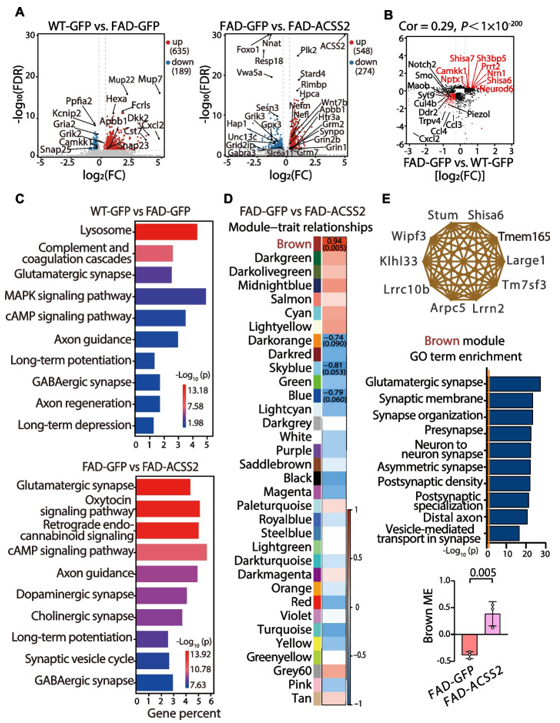
图4 FAD-ACSS2小鼠的转录组学分析
根据之前的研究,NMDA受体和AMPA受体对突触效能的长时程增强(LTP)和抑制(LTD)至关重要。在这里,作者使用RT-qPCR技术检测了小鼠海马中NMDA受体亚基(Grin1/2a/2b)和AMPA受体亚基(Gria1/2/3)的mRNA水平,与FAD-GFP小鼠相比,FAD-ACSS2小鼠显示了较高的谷氨酸受体mRNA水平(图5A)。Western Blot结果也显示FAD-ACSS2小鼠谷氨酸受体蛋白水平升高。通过ChIP-qPCR分析发现,FAD-ACSS2小鼠Grin1及Gria1等基因启动子区组蛋白乙酰化(acH3K9和acH4K12)水平呈上升趋势,但各组间乙酰辅酶A水平无差异(图5B-D)。作者对WT-GFP、FAD-GFP和FAD-ACSS2小鼠CA1锥体神经元进行了全细胞记录,各组间mIPSC频率和幅度均无差异(图5E),但上调ACSS2明显增加了mEPSC振幅(图5F)。进一步对CA1区进行LTP记录,发现5×FAD小鼠的场兴奋性突触后电位(fEPSC)明显受损,而上调ACSS2可以改善这种情况(图5G)。综上所述,上调ACSS2通过组蛋白乙酰化途径调节了NMDA受体和AMPA受体的表达,增强了突触的可塑性。
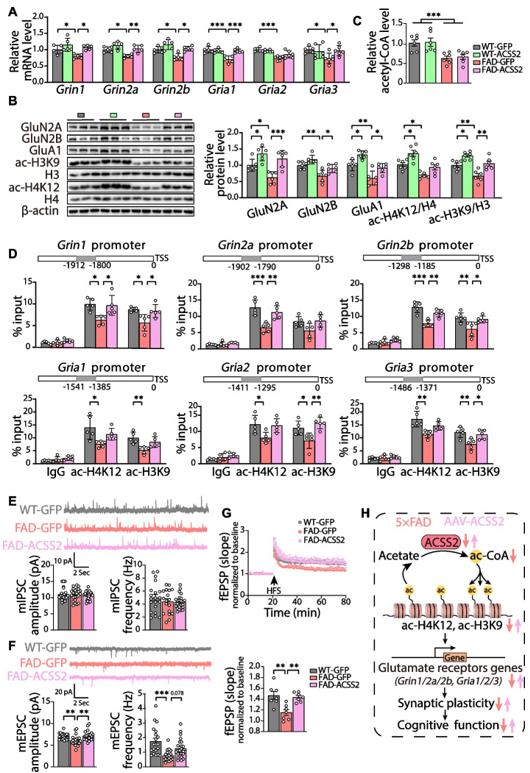
图5 上调ACSS2通过组蛋白乙酰化介导谷氨酸受体表达
为了验证补充ACSS2底物(乙酸盐)是否具有类似的抗AD作用,作者对8月龄的5×FAD小鼠和野生型小鼠进行了为期1个月的GTA(三乙酸甘油酯)灌胃补充实验(2g/kg/d)。与FAD-Veh小鼠相比,FAD-GTA小鼠组蛋白乙酰化(ac-H3K9/H3和ac-H4K12/H4)水平显著升高(图6A)。然而,ACSS2蛋白水平并无明显差异(图6A)。与上调ACSS2不同的是,补充GTA显著增加了小鼠海马中乙酰辅酶A(CoA)的含量(图6B)。进一步研究发现,FAD-GTA小鼠显示出较高水平的NMDA受体亚基(Grin2a)和AMPA受体亚基(Gria1/2/3)的mRNA水平,而NMDA受体亚基(Grin1/2b)的mRNA水平差异不明显(图6C)。同时,Western Blot结果也显示类似差异(图6D)。通过ChIP-qPCR分析发现,与FAD-Veh小鼠相比,FAD-GTA小鼠Grin1及Gria1等基因启动子区组蛋白乙酰化(acH3K9和acH4K12)水平增加(图6E)。进一步的电生理显示补充乙酸盐显著提高了5×FAD小鼠的LTP(图6F)。最后,在水迷宫测试中,与FAD-Veh小鼠相比,FAD-GTA小鼠达到平台的时间更短,穿越平台次数和在目标象限的时间也更多(图6G-J)。综上所述,补充ACSS2底物可以通过增加组蛋白乙酰化水平来上调谷氨酸受体的表达,最终改善5×FAD小鼠的认知功能。
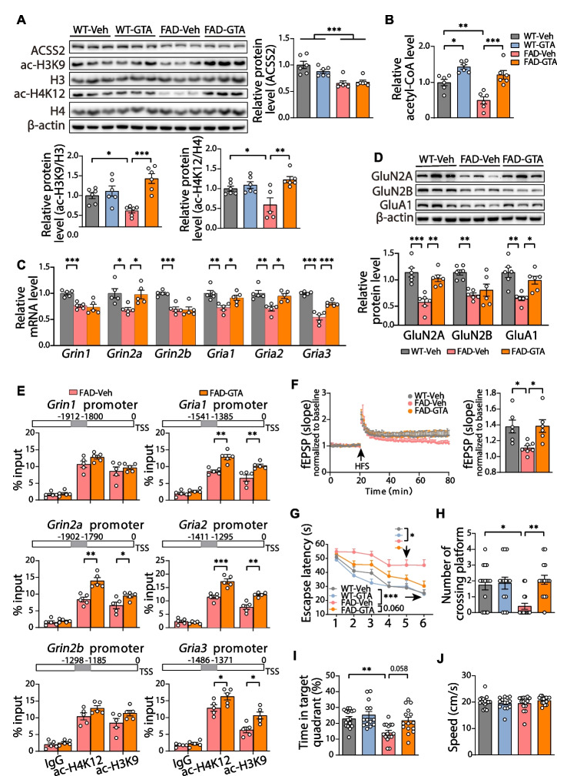
图6 乙酸盐补充剂通过组蛋白乙酰化介导谷氨酸受体表达
为了探索ACSS2在乙酸盐介导的5×FAD小鼠认知保护中的作用,研究者将携带shACSS2的腺相关病毒(汉恒生物)注射到7月龄的5×FAD小鼠背侧海马,以减少ACSS2的表达。小鼠接受病毒感染一个月后,进行为期4周的GTA(2g/kg/d)治疗(图7A)。与FAD-GFP-GTA小鼠相比,FAD-shACSS2-GTA小鼠在水迷宫实验中显示出更长的逃避潜伏期,在目标象限内的时间较短(图7B-E)。此外,ACSS2基因沉默抑制了GTA引起的乙酰辅酶A含量的增加,并抑制了GTA治疗引起的组蛋白乙酰化水平上调(图7F-G)。最后,ACSS2基因沉默还抑制了GTA介导的NMDA受体和AMPA受体表达的促进作用(图7H和I)。这些结果表明,在5×FAD小鼠中,GTA补充通过组蛋白乙酰化调节谷氨酸受体表达,增强突触可塑性和认知功能,而ACSS2基因沉默可以阻碍这种效应(图7J)。
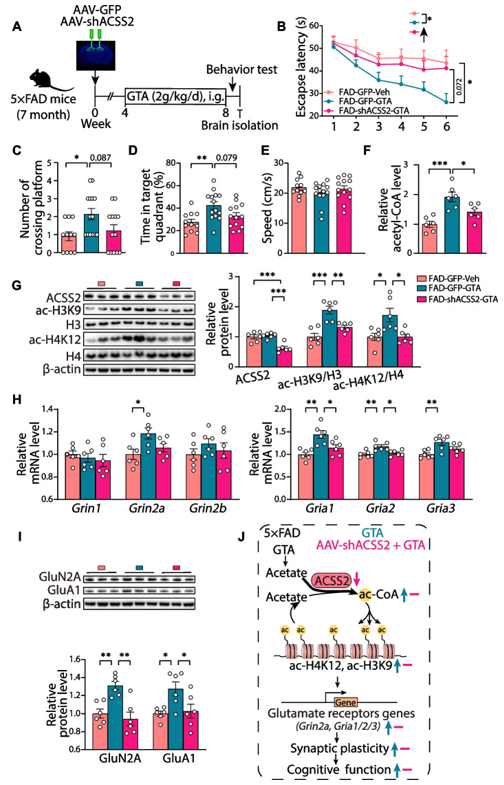
图7 通过沉默ACSS2基因,抑制乙酸盐诱导的谷氨酸受体上调
综上,该研究阐明了ACSS2在AD中的作用机制:ACSS2通过产生乙酰辅酶A促进谷氨酸受体的表达,进而增强突触的可塑性,最终改善小鼠的认知能力;下调ACSS2则通过组蛋白乙酰化降低导致谷氨酸受体表达减少,进一步损害了突触的可塑性。有趣的是,研究人员发现在ACSS2水平降低的5×FAD小鼠中,乙酸盐给予产生了与ACSS2相似的效果。这表明,该物质具有作为药物的潜力。

查看更多

查看更多

查看更多

联系我们

返回顶部