查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
结直肠癌(Colorectal Cancer, CRC)是全球第三大常见恶性肿瘤,也是癌症相关死亡的第二大原因。约70%的CRC患者会发生肝转移,此类转移是导致CRC患者死亡的主要原因。尽管目前已有多种治疗策略,但患者总体预后仍不理。肝脏在CRC肝转移的发生和发展过程中扮演关键角色,然而肝脏如何通过细胞间通讯影响CRC肝转移的具体机制尚不清楚。因此,深入研究结直肠癌肝转移相关机制,并开发有效的靶向治疗策略,具有重要的临床意义与紧迫性。

2025年5月26日,军事医学研究院魏从文教授团队联合北京生物技术研究所、广西医科大学等多位专家团队,在国际顶级肿瘤学期刊Molecular Cancer(IF:27.7)上发表了题为“GP73-dependent regulation of exosome biogenesis promotes colorectal cancer liver metastasis”的研究成果。该研究首次揭示了肝脏中的高尔基体蛋白73(GP73)通过调控外泌体生成促进结直肠癌肝转移的分子机制,为CRC肝转移的治疗提供了新的思路。汉恒生物有幸为本研究提供腺相关病毒AAV-GP73,实现在肝脏中特异性过表达GP73基因,支持该机制的深入探索。
下面,我们一起来看看具体的研究内容。
研究成果
1.结直肠癌肝转移患者的肝脏GP73表达呈现病理性升高
既往研究表明肝细胞癌(HCC)患者血清中GP73水平升高,并与不良预后相关。本研究中作者检测了健康对照组、无肝转移的结直肠癌患者(CRNLM)和结直肠癌肝转移患者(CRLM)的血浆和肝脏中GP73的表达水平,发现CRLM患者血清和肝组织中GP73水平显著升高,且与白蛋白共定位。为进一步探究GP73高表达的肝细胞是否会影响CRC肝转移,作者通过注射AAV-GP73构建了肝脏特异性高表达GP73的小鼠模型。与对照组相比,AAV-GP73处理组小鼠的肝转移灶总面积、数量及占比均显著增加。而在使用外泌体抑制剂GW4869抑制外泌体生成后,AAV-GP73处理组促进转移的作用受到抑制。这些结果表明,肝脏中上调的GP73主要通过外泌体依赖性方式促进结直肠癌肝转移。
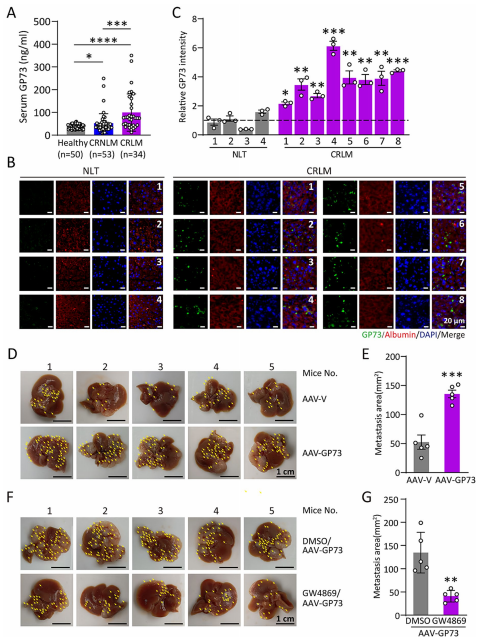
图1 结直肠癌肝转移患者的肝脏GP73表达呈现病理性升高
2.GP73促进外泌体生成
为阐明GP73在外泌体生物发生中的作用,作者从细胞培养基中获得了纯化外泌体。透射电镜(TEM)、纳米颗粒追踪分析(NTA)和免疫印迹结果显示,对照组与高表达GP73的肝细胞组(ExoGP73)分泌的外泌体具有相似的形态学特征、粒径分布和分子组成。过表达GP73能促进外泌体颗粒及外泌体蛋白的释放。为进一步在更接近生理状态的条件下研究GP73对外泌体分泌的作用,作者构建了全身性GP73敲除小鼠(GP73-KO)。基因型对囊泡平均直径无显著影响,但GP73-KO小鼠的外泌体颗粒浓度较WT小鼠降低了70%;相反,AAV-GP73组小鼠血清中的外泌体颗粒数量显著高于对照组。这些数据充分证明,GP73在体外和体内均能调控外泌体的生物合成。
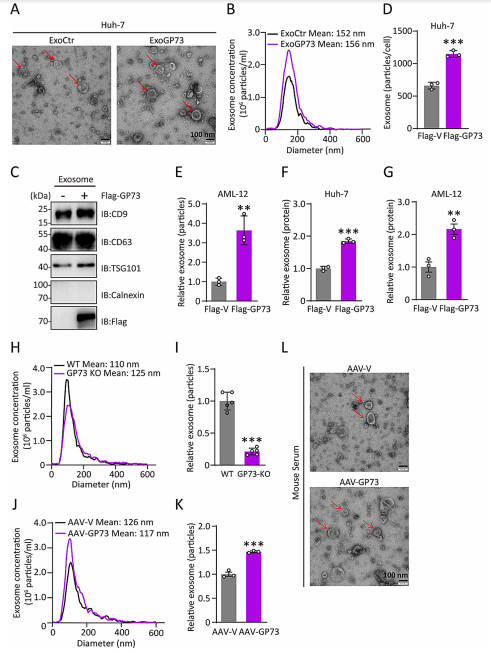
图2 GP73促进外泌体的产生
3.GP73与内体区室共定位并增加多泡体(MVB)数量
外泌体生物发生包含三个关键过程:腔内囊泡(ILV)形成、多泡体(MVB)生成以及这些区室与质膜(PM)融合后的外泌体分泌。鉴于GP73对外泌体生物发生的促进作用,作者探究其是否定位于内体区室。通过免疫荧光染色检测了GP73与早期内体标志物Rab5、循环内体标志物Rab11以及晚期内体标志物Rab7的共定位情况。在GP73过表达细胞中,GP73广泛分布于内吞途径中的早期、循环和晚期内体。活细胞成像显示,GP73荧光点呈现动态运动特征,并与CD63阳性的MVB及其与质膜融合位点持续共定位。采用肝细胞生长因子调节酪氨酸激酶底物(HRS)作为MVB标志物进行染色,发现GP73过表达导致单个细胞内MVB数量增加,而GP73敲除则显著减少MVB数量。这些结果共同表明,GP73主要通过调控MVB促进外泌体生成。
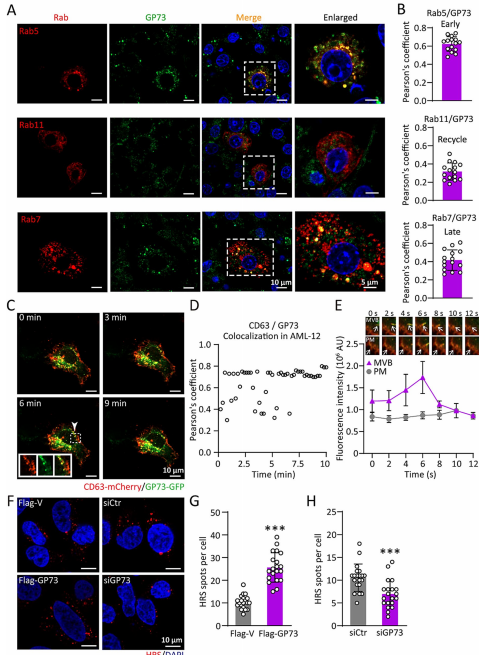
图3 GP73与内体区室重叠并增加MVB数量
4.GP73结合胆固醇并调控内体区室胆固醇含量
过往研究发现小鼠肝脏中高表达的GP73蛋白与胆固醇代谢密切相关。为阐明GP73调控MVB数量及外泌体生成的分子机制,作者对GP73序列进行分析,发现一个潜在的保守胆固醇识别氨基酸共识(CRAC)基序,且该CRAC基序上游紧邻一个相似但反向的胆固醇识别基序(CARC基序)。接着验证GP73与结构不同甾醇的结合能力,证实了GP73对胆固醇和其他四种测试甾醇具有相似的结合亲和力。关键残基(Phe90、Tyr99)的突变或缺失会显著削弱其胆固醇结合能力。GP73通过胆固醇相互作用促进MVB区室胆固醇积聚,扩大MVB区室并增强外泌体生成,而突变体(DM)则丧失此功能。表明GP73通过调控胆固醇流动影响外泌体生物合成。
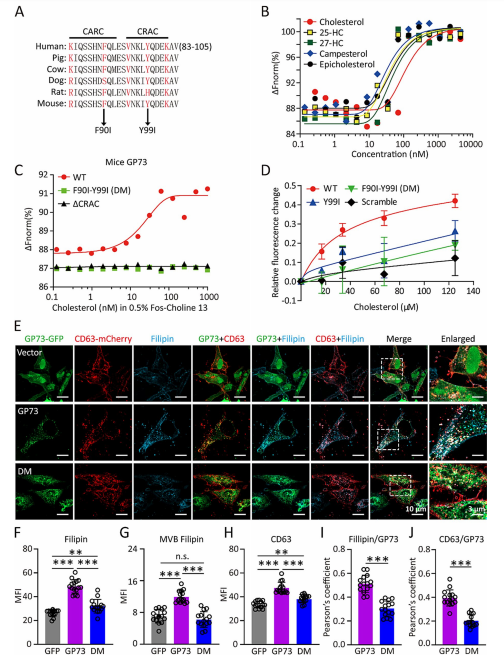
图4 GP73与胆固醇结合并调节MVBs中的胆固醇含量
5.源自高表达GP73肝细胞的外泌体促进肿瘤转移
随后,作者探究外泌体分泌变化是否会影响受体癌细胞的迁移能力。与GP73转染细胞共培养的MC38细胞表现出迁移和侵袭能力增强,而与DM突变体转染细胞共培养时,MC38细胞的迁移速度降低。进一步验证发现,ExoGP73能显著增强受体癌细胞的迁移和侵袭能力。体内实验进一步证实,ExoGP73通过尾静脉注射可促进小鼠肝脏转移瘤的形成,增加转移灶的数量和体积。上述结果表明,GP73通过调控外泌体分泌促进肿瘤肝转移。
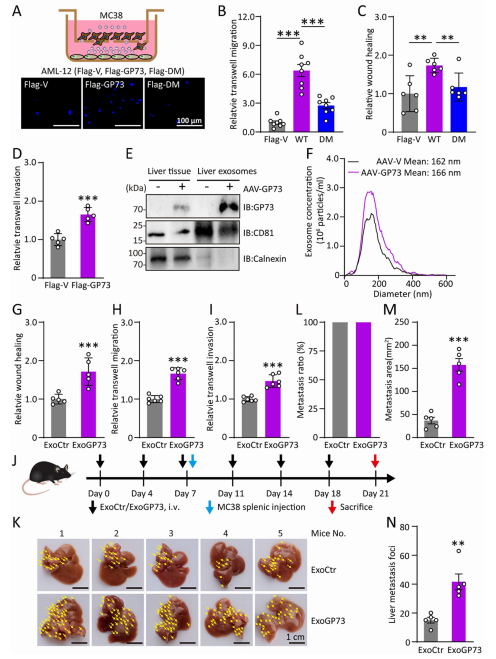
图5 源自高GP73肝细胞的外泌体具有促转移作用
6.GP73调控富含NAV2的外泌体生成
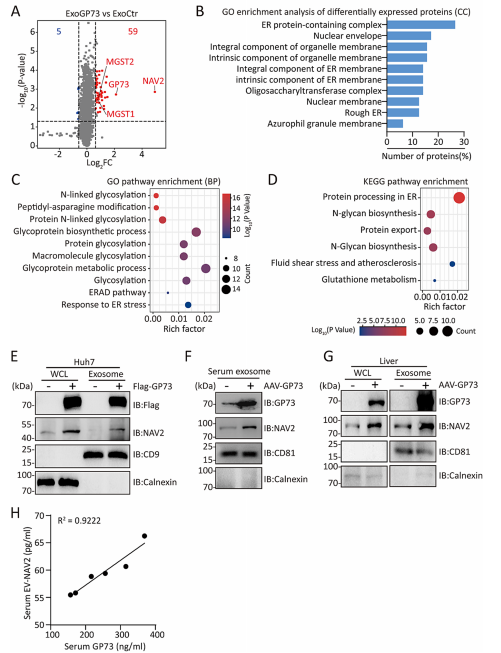
图6 GP73介导富含NAV2的外泌体的产生
7.沉默NAV2可抑制GP73诱导的CRC肝转移
作者将MC38细胞与GP73高表达的AML-12细胞共培养,发现MC38细胞的NAV2表达显著升高。而沉默NAV2时,GP73高表达诱导的细胞增殖率、迁移和侵袭能力增强效应被显著削弱。在动物实验中,通过AAV诱导小鼠肝脏高表达GP73后,其肝脏表现出脂质沉积增加但体重未显著上升的非肥胖型代谢功能障碍相关脂肪性肝病(MASLD)表型,同时结直肠癌肝转移灶数量明显增多。而通过GP73中和抗体或敲低肝细胞NAV2表达,可显著抑制肿瘤转移。这些结果证实,GP73主要通过外泌体递送NAV2来增强癌细胞的侵袭性,促进肝转移的发生。
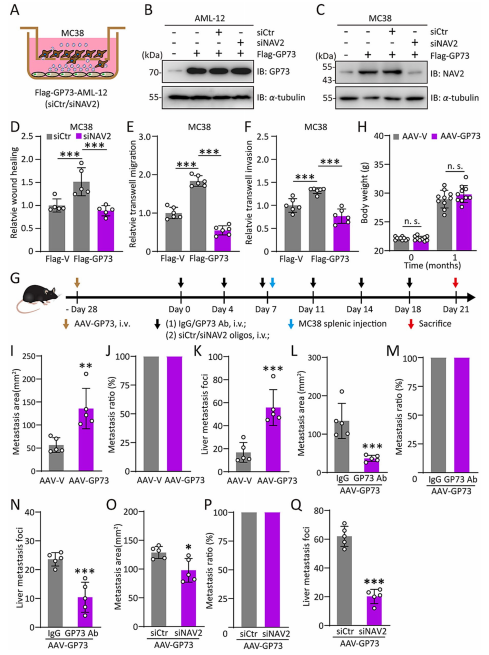
图7 沉默NAV2可抑制GP73诱导的CRC肝转移
8.靶向GP73可抑制高脂或高果糖喂养引起的CRC肝转移
高脂饮食(HFD)或高果糖饮食(HFrD)喂养的小鼠肝脏中GP73表达显著上调,并导致肥胖、肝脏脂肪变性和血糖代谢异常,同时促进CRC肝转移的发生。通过GP73中和抗体治疗或敲低肝脏GP73表达,可有效抑制HFD/HFrD诱导的肝转移,并降低转移瘤中NAV2的表达水平和肿瘤细胞增殖活性。这些结果证实,GP73在营养代谢异常驱动的CRC肝转移中起关键作用,靶向GP73可抑制高脂或高果糖饮食诱发的CRC肝转移增强效应。
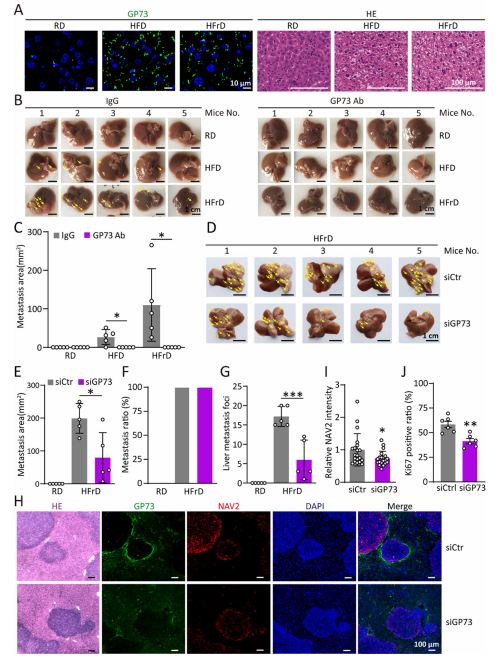
图8 靶向GP73可抑制高脂或高果糖喂养引起的CRC肝转移
综上所述,本研究首次揭示了GP73通过重塑肝脏外泌体组分进而促进癌细胞肝侵袭的作用机制。GP73通过结合胆固醇重塑肝细胞外泌体蛋白组,生成富含NAV2的外泌体,通过NAV2传递促进癌细胞转移侵袭能力。研究还发现GP73在非肥胖型和肥胖型MASLD中均是肝转移的关键驱动因素,阻断GP73可有效抑制肝转移。这一发现为针对不同代谢背景下的结直肠癌肝转移提供新的治疗策略和理论依据。

查看更多

查看更多

查看更多

联系我们

返回顶部