查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
结直肠癌(colorectal cancer, CRC)是全球第三大常见癌症,也是癌症相关死亡的第二大原因。tRNA修饰作为翻译重编程的关键调控因子,在调控癌细胞命运中的作用日益受到关注。然而,其在CRC中的确切作用及分子机制尚未完全阐明。

2025年6月3日,上海交通大学陈萦晅、房静远团队在Nature Cancer(IF=28.5)上发表了题为“TRMT6-mediated tRNA m1A modification acts as a translational checkpoint of histone synthesis and facilitates colorectal cancer progression”的论文。作者发现tRNA N1-甲基腺苷甲基转移酶TRMT6在人类CRC组织中上调,其高表达与CRC患者的低存活率相关;通过小鼠模型确定TRMT6通过维持TRMT6-TRMT61A复合物的稳定性来增加tRNA m1A水平;TRMT6缺失会导致tRNA-Lys-TTT-1-1的快速降解,降低组蛋白mRNA翻译效率,进而减少CRC细胞的组蛋白合成并阻滞细胞周期进程,表明靶向TRMT6具有较好的肿瘤特异性及治疗窗口;此外,胆固醇偶联的siRNA靶向TRMT6可有效抑制CRC肿瘤生长与肝转移,CDK4/6抑制剂进一步增强其抗癌作用,为CRC治疗提供了新的见解。汉恒生物有幸为作者提供了TRMT6、TRMT61A干扰慢病毒用于构建敲低稳转株。下面介绍研究的主要成果。

m1A甲基转移酶TRMT6在CRC中高度上调
通过TCGA、GTEx和CPTAC数据库分析以及实验证实,常见的tRNA修饰酶中,METTL1、PUS7、WDR4、TRMT6、NAT10和PUS1这6个基因的mRNA和蛋白水平在CRC样品中显著上调。这些基因分别调节不同的tRNA修饰,其中m1A是最丰富的、可逆的tRNA修饰,暗示它可能是表观遗传治疗的一个有希望的靶点。免疫组化显示CRC组织中TRMT6水平增加,并与肿瘤大小和AJCC III/IV正相关;Kaplan-Meier分析表明,TRMT6高表达患者的总体生存期(OS)较差;基于TCGA数据库的泛癌分析进一步表明,TRMT6在19种肿瘤中的12种显著过表达,且其高mRNA水平预示癌症患者OS较差。这些数据表明m1A甲基转移酶TRMT6可以作为CRC的预后生物标志物,并突出了tRNA m1A修饰的致癌作用。
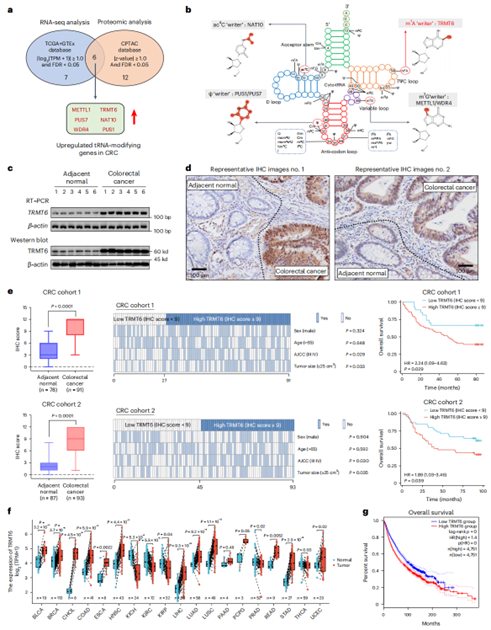
图 1 CRC中TRMT6过表达与不良预后相关
TRMT6对于CRC的发生是不可或缺的
为探究TRMT6在细胞增殖和肿瘤发生中的作用,作者在小鼠体内敲低TRMT6,结果抑制了异种移植肿瘤的生长并降低了m1A水平。作者又构建了TRMT6肠上皮特异性敲除(CKO)小鼠(TRMT6flox/flox, Vil1-Cre),发现其肠上皮组织tRNA m1A修饰显著低于野生型(WT)小鼠。利用AOM/DSS(氧化偶氮甲烷/葡聚糖硫酸钠)诱导建立CRC模型,与WT相比,CKO小鼠的肿瘤数量、总体肿瘤负荷显著减少,肠上皮粘膜破坏和腺癌形成较少,Ki67阳性染色也减弱。以上结果表明,TRMT6对于CRC细胞生长和肿瘤发生至关重要。
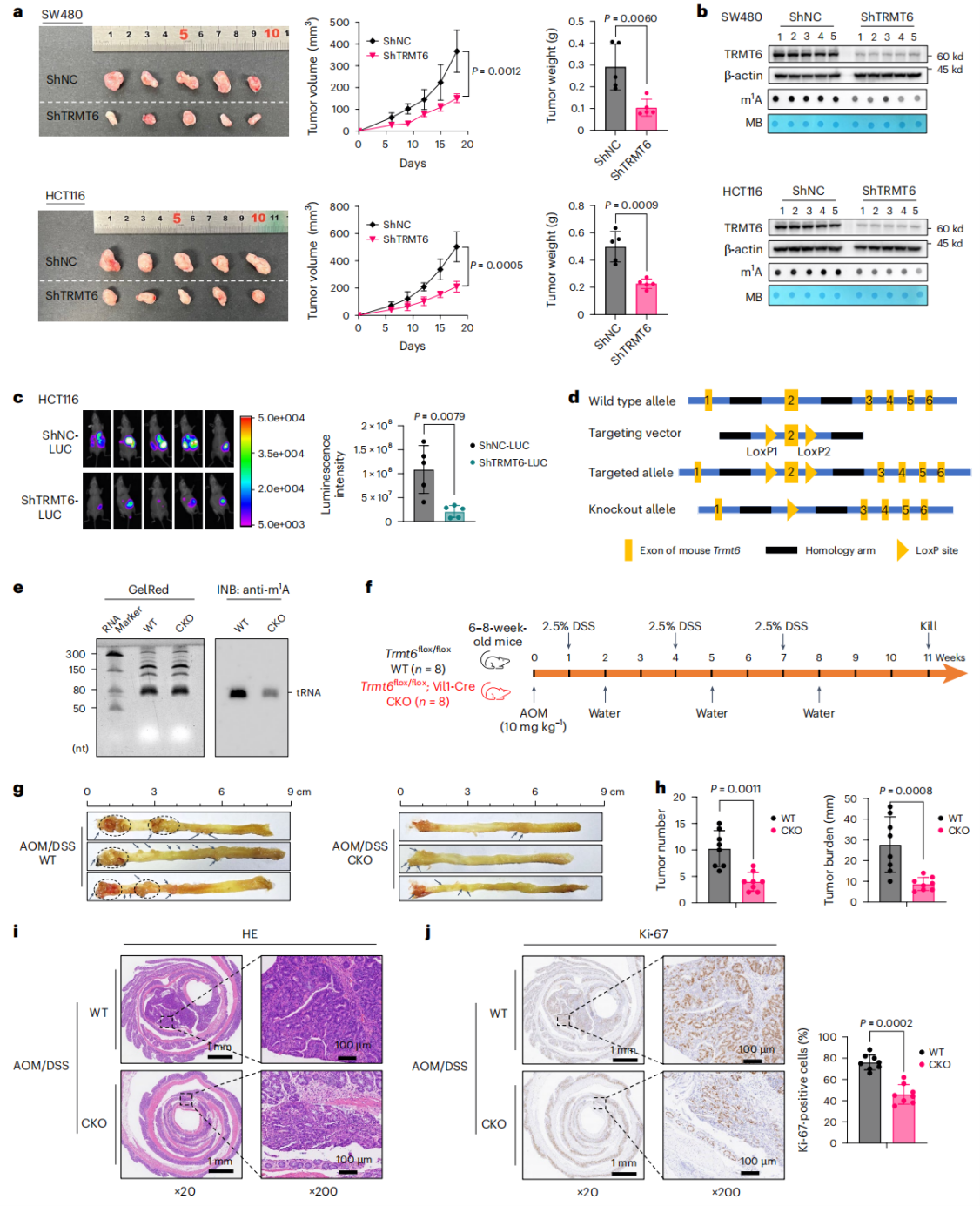
图 2 TRMT6对于CRC细胞生长和肿瘤发生至关重要
TRMT6稳定TRMT6/61A复合物以增强CRC中的tRNA m1A修饰
TRMT6是负责tRNA m1A修饰的酶,然而其在CRC中是否以及如何调节tRNA m1A水平仍不清楚。据报道,tRNA m1A修饰是由tRNA结合亚基TRMT6和催化亚基TRMT61A组成的异源四聚体执行。因此作者研究了多种CRC细胞系、CRC组织和邻近健康组织中TRMT6和TRMT61A的蛋白质水平以及m1A修饰水平,发现在CRC中m1A水平显著升高,且与TRMT6和TRMT61A蛋白水平的升高呈正相关。
在RKO细胞中稳定敲低TRMT6发现TRMT6表达降低的同时,tRNA m1A水平和TRMT61A蛋白水平也出现了显著降低。为深入探究TRMT6对TRMT61A的调控作用,作者在多种CRC细胞系中敲低TRMT6,发现TRMT6的敲低降低了TRMT61A的蛋白水平,但不影响其mRNA水平;有趣的是,TRMT61A的敲低同样导致TRMT6蛋白表达减少,而不影响其mRNA水平;此外,与单独过表达相比,TRMT6和TRMT61A同时过表达能相互提升对方的蛋白水平,且mRNA水平几乎不变,表明在CRC细胞中存在TRMT6-TRMT61A强相互作用来保护复合体不被降解。CHX chase实验进一步证实,TRMT6缺失会显著加速TRMT6和TRMT61A蛋白的降解。这些发现表明TRMT6在转录后水平调节TRMT61A,并保护TRMT6/TRMT61A复合物免于降解。
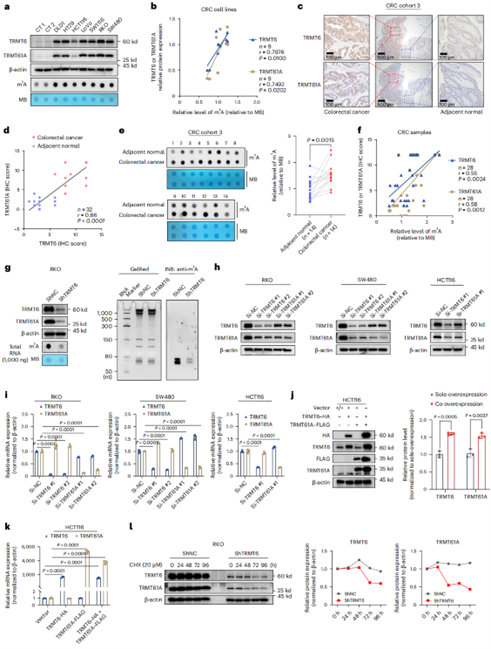
图 3 TRMT6维持TRMT6/61A复合物,在CRC中升高tRNA m1A修饰
TRMT6介导的tRNA m1A修饰维持CRC细胞生长
为明确TRMT6是否通过调节tRNA m1A修饰来发挥其生物学功能,作者使用质谱评估了TRMT6在tRNA m1A修饰中的催化特异性。结果显示,在52种tRNA修饰中,m1A丰度最高,且在TRMT6敲低后显著降低;tRNA斑点杂交也证实,在稳定敲低TRMT6的RKO细胞系中,tRNA m1A水平显著下降。为了探究TRMT6/TRMT61A复合物的催化作用,作者基于同源序列比对和文献分析,鉴定了TRMT61A可能对m1A修饰至关重要的三个残基(Ser114、Glu135和Asp181)。随后,构建了外源过表达质粒TRMT6-TRMT61AWT或TRMT6-TRMT61AMUT(催化突变体),实验结果显示,在TRMT6敲低的CRC细胞中瞬时过表达TRMT6-TRMT61AWT或TRMT6-TRMT61AS114A,能够完全挽救由TRMT6敲低导致的m1A水平下降和细胞活力抑制;而TRMT6-TRMT61AE135A和TRMT6-TRMT61AD181A则无此挽救效果。表明TRMT61A中的Glu135和Asp181是介导m1A修饰的关键残基。在CRC细胞中敲低TRMT61A也可以降低m1A水平并抑制细胞生长。上述发现表明CRC的进展依赖于TRMT6-TRMT61A复合物以及对tRNA m1A修饰的催化作用。
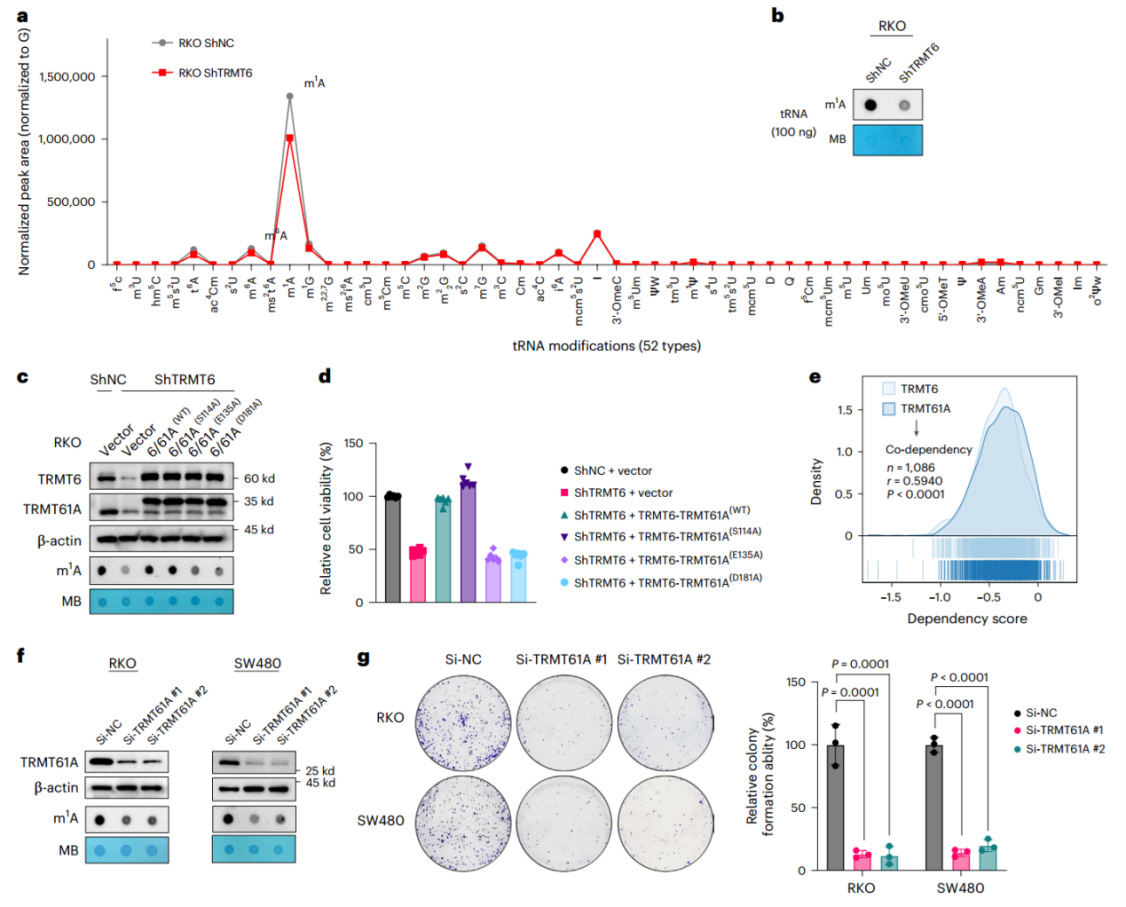
图 4 TRMT6依赖性tRNA m1A修饰维持CRC细胞生长
靶向TRMT6削弱组蛋白mRNA翻译
据报道,tRNA m1A修饰主要位于大多数细胞质tRNA的第58位碱基,对维持tRNA的正确结构和稳定性是必需的。tRNA-seq和Northern blot结果显示,在RKO细胞中敲低TRMT6导致tRNA-Arg-ACG-1-1、tRNA-Tyr-GTA-8-1、tRNA-Thr-AGT-4-1和tRNA-Lys-TTT-1-1的水平显著降低。
鉴于失调的tRNA可通过密码子偏好性参与翻译重编程,作者结合Ribo-seq和RNA-seq数据分析发现,TRMT6敲低后组蛋白mRNA的翻译效率(TE)显著降低。整合TE数据,进一步分析显示,TE降低的基因中富集了AAA、GAA、ATT、GAT、AAG、AAT、GCT、GGA、GTT、TTT、TAT、ATG和GGT密码子,且AGG、ACG、AAC、AAA、AGA、CAA、TCA、AAG、CCG、GGA、AGT和CAT密码子处的核糖体相互作用显著增加(提示核糖体滞留)。交叉比对受影响的密码子,确定AAA和AAG(对应于tRNA-Lys-TTT-1-1)为TRMT6敲低后介导翻译调控的关键密码子。对AAA和AAG密码子的依赖性分析显示,在TRMT6敲低后TE降低的基因中,AAA、AAG密码子的总数更少,但相对频率更高;这种趋势在TE降低的组蛋白基因中尤为明显。
为确定TRMT6在组蛋白翻译重编程中的作用,作者在敲低TRMT6的同时过表达组蛋白。结果显示TRMT6缺失降低了外源HA标记的H3C1的蛋白水平,而其mRNA表达保持不变,表明TRMT6在翻译水平上调控H3C1表达。在双荧光素酶报告基因系统的萤火虫荧光素酶编码序列前插入六个重复的AAA和AAG序列,结果发现,TRMT6敲低显著降低了包含这些重复密码子的报告基因活性。
这些数据表明,TRMT6敲低下调的关键tRNA分子中,tRNA-Lys-TTT-1-1的减少对翻译影响最为显著,其水平降低导致核糖体在AAA和AAG密码子处发生滞留,进而降低整体翻译效率。同时,核糖体与富含AAA、AAG密码子的mRNA结合减少,导致相应mRNA尤其是组蛋白mRNA的TE下降。
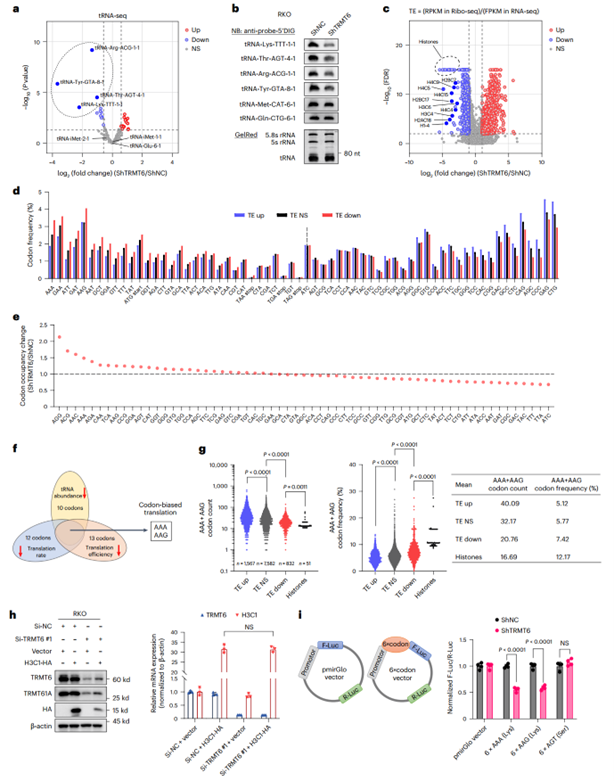
图 5 TRMT6缺失通过密码子偏好性阻断组蛋白mRNA翻译
TRMT6敲除抑制组蛋白合成和细胞周期
组蛋白是包裹DNA形成核小体的结构蛋白。在细胞周期的G1/S期转换阶段,组蛋白合成迅速增加,并与DNA复制密切相关,促进新复制的DNA迅速有序地组装成染色质。鉴于肿瘤细胞具有快速且不受控制的复制特性,通常认为其组蛋白合成能力增强。本研究中,作者观察到与邻近的健康组织相比,CRC组织中新合成的细胞质组蛋白(包括H2B、H3和H4)的水平显著增加,这一发现为上述观点提供了支持。
敲低TRMT6后,观察到新合成的细胞质组蛋白(包括H2A、H2B、H3和H4)水平显著降低,而染色质结合的组蛋白水平维持不变。组蛋白的充足供应是细胞进入S期并启动DNA复制的必要条件,因此作者进一步检测了细胞周期进程。EdU掺入测定和细胞周期分析表明,在RKO和SW480细胞中敲低TRMT6会导致DNA合成受损,细胞在G0/G1期累积,S期进入受阻;通过TdR双阻断法测定发现敲低TRMT6导致S期进程延长,进入G2/M期的细胞显著减少。
这些结果表明,TRMT6介导的tRNA m1A修饰对于维持CRC细胞中足够的新合成的组蛋白是至关重要的,抑制TRMT6会显著削弱细胞复制DNA并进入S期的能力。
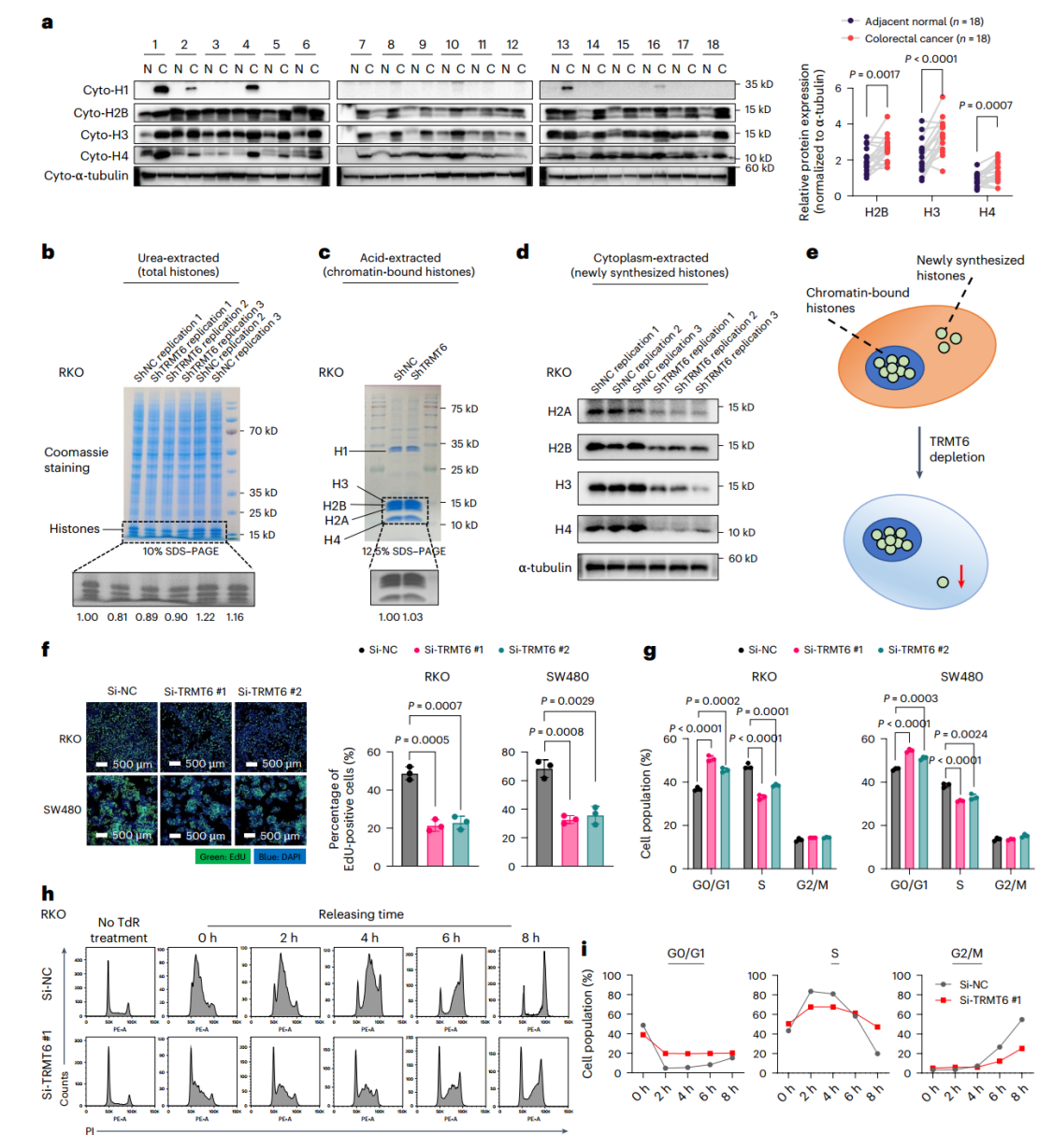
图 6 TRMT6调节组蛋白合成和细胞周期进程
TRMT6-tRNA-组蛋白调节轴在CRC中的致癌作用
为阐明TRMT6介导的m1A修饰在通过组蛋白合成促进肿瘤发生中的作用,作者选取了TRMT6敲低后TE显著降低的代表性组蛋白,在TRMT6敲低的RKO细胞中进行过表达。结果显示,过表达这些组蛋白能够挽救细胞活力,表明TRMT6介导的m1A修饰通过调控组蛋白水平影响细胞活力。类似地,外源性过表达tRNA-Lys-TTT-1-1也能恢复TRMT6敲低细胞中的tRNA水平、组蛋白合成及细胞活力,证实了该tRNA在TRMT6调控通路中的必要性。鉴于前文研究表明,tRNA修饰对tRNA的稳定性至关重要,作者进行了放线菌素D转录抑制实验,结果表明TRMT6的敲低显著加速了tRNA-Lys-TTT-1-1的降解,证实了TRMT6介导的m¹A修饰下降后tRNA丰度的变化是由降解增加引起的。
为验证CRC中的“TRMT6–tRNA-Lys-TTT-1-1–组蛋白”促癌调控轴,作者在低表达TRMT6的HCT116细胞中过表达TRMT6,结果导致TRMT61A蛋白质表达水平、tRNA m1A修饰水平、tRNA-Lys-TTT-1-1相对表达水平均显著升高,并增强了HCT116细胞中组蛋白的合成能力。进一步的体外细胞增殖实验和体内裸鼠异种移植模型证明,TRMT6过表达促进了HCT116细胞的增殖、裸鼠中的肿瘤形成及肝转移。证实CRC中“TRMT6–tRNA-Lys-TTT-1-1–组蛋白”轴在CRC中的致癌作用及其调控机制。
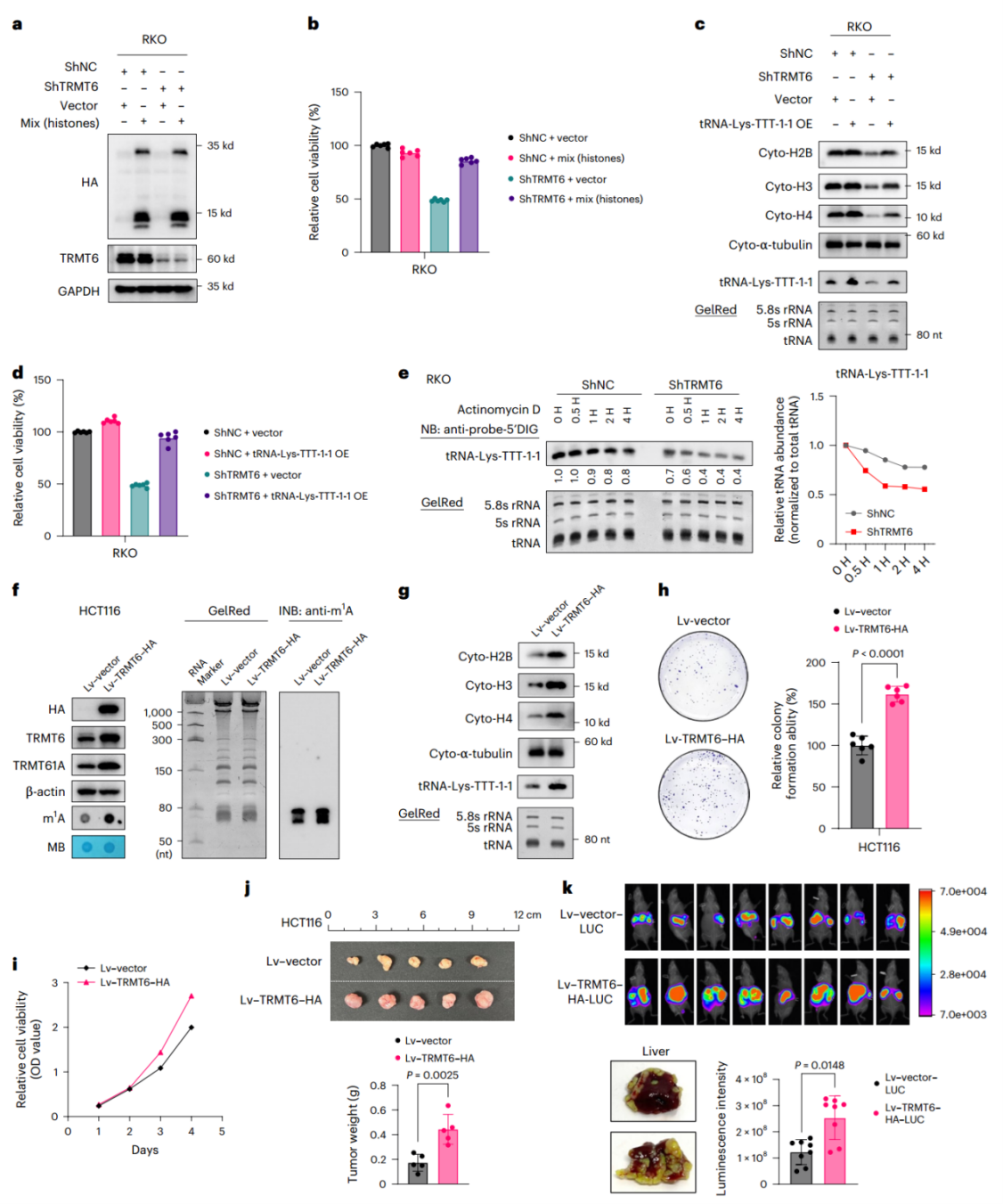
图 7 TRMT6-tRNA-组蛋白调节轴驱动CRC进展
Chol-si-TRMT6与CDK4/6i抑制CRC进展
近年来siRNA疗法已成为新药研发热点,基于此,作者设计了胆固醇修饰的靶向TRMT6 siRNA(Chol-si-TRMT6)用于体内敲低TRMT6,结果表明,Chol-si-TRMT6显著抑制了CRC异种移植小鼠的肿瘤生长。
已有文献报道CDK4/6-Rb-E2F-NPAT信号轴是组蛋白mRNA转录的关键通路,作者探究了CDK4/6抑制剂palbociclib对组蛋白合成的影响以及它在CRC中的抗癌作用。在小鼠实验中,与对照相比,单独皮下注射Chol-si-TRMT6或施用palbociclib均能抑制异种移植物肿瘤生长,而联合治疗则表现出更强的肿瘤生长抑制效果,且该组肿瘤组织的Ki-67阳性率及组蛋白合成能力也显著降低。
综上所述,Chol-si-TRMT6特异性靶向CRC细胞中的TRMT6,抑制肿瘤生长并减少肝转移,CDK4/6抑制剂(palbociclib)可协同增强其抗肿瘤效果,为人类CRC提供了一种有前景的治疗策略。
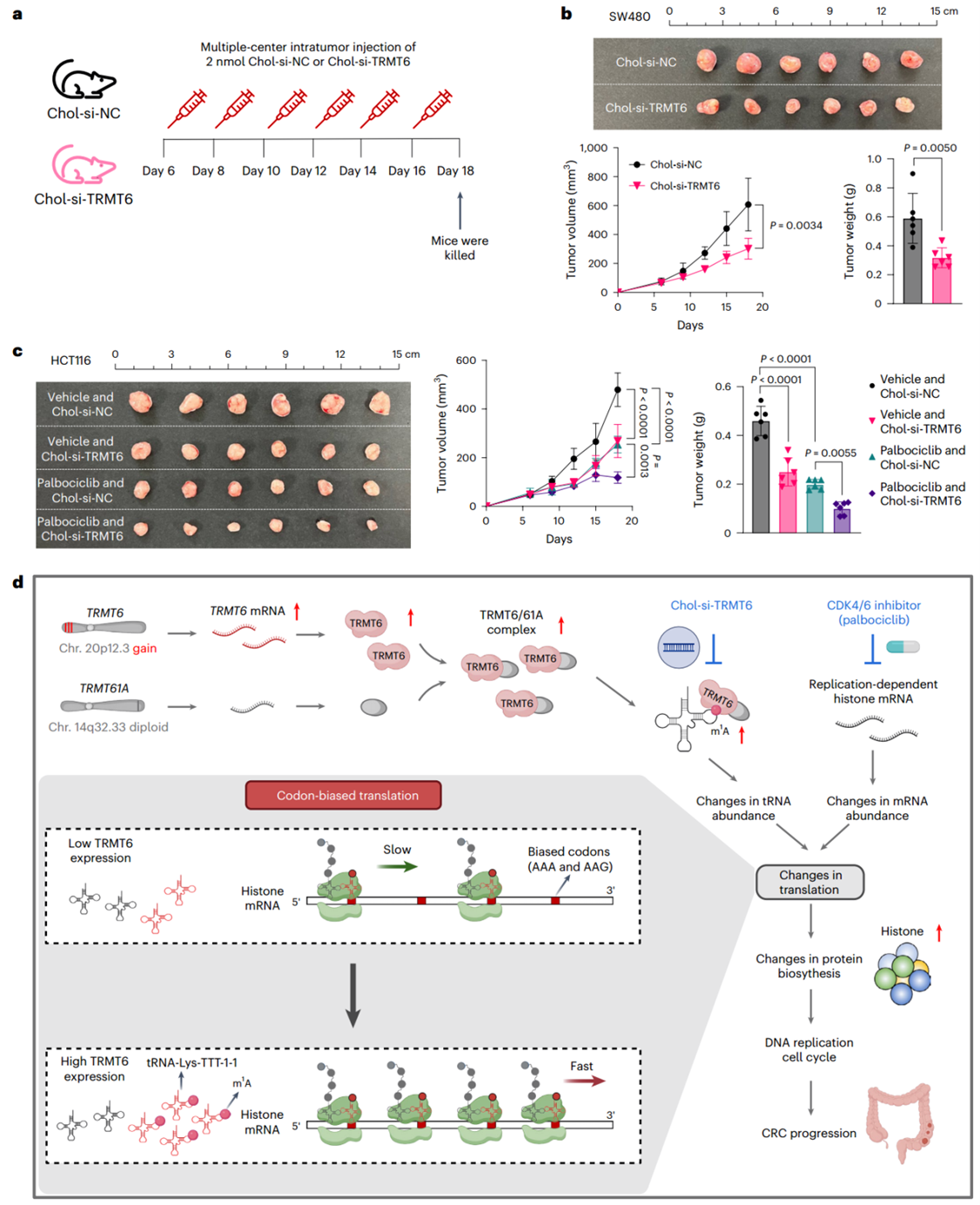
图 8 Chol-si-TRMT6与CDK4/6i抑制异种移植肿瘤生长
在这项最新研究中,研究团队揭示了TRMT6在CRC中作为关键翻译检查点的致病机制:其过表达通过稳定TRMT6-TRMT61A复合物提升tRNA m1A修饰水平,维持tRNA-Lys-TTT-1-1的稳定性,从而以密码子偏好性方式驱动组蛋白高效翻译。当这一通路被破坏时,组蛋白合成受阻并引发细胞周期阻滞,最终抑制肿瘤进展。这不仅解析了CRC发生发展中的关键调控机制,更为临床开发靶向TRMT6/tRNA修饰的创新疗法提供了理论基石与干预窗口。

查看更多

查看更多

查看更多

联系我们

返回顶部