查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
结直肠癌作为第三大常见的恶性肿瘤,严重威胁着人体健康。结直肠癌(CRC)通常引起腹膜种植转移(尤其是手术后)并最终引起腹膜癌(PC),CRC-PC患者的中位生存期仅为6个多月。然而,CRC-PC的治疗在过去十年停滞不前,迫切需要开发新的CRC-PC疗法。
2022年1月1日,第三军医大学(陆军军医大学)缪洪明团队在Theranostics(IF=11.556)发表了一篇题为“5-aza-2′-deoxycytidine potentiates anti-tumor immunity in colorectal peritoneal metastasis by modulating ABCA9-mediated cholesterol accumulation in macrophages”的研究论文,他们建立了小鼠CRC-PC模型,并阐述了5-氮杂-2'-脱氧胞苷(5Aza)在调节CRC-PC中的功能和机制,发现了5Aza在CRC-PC临床治疗中的巨大潜力。值得注意的是文中靶向小鼠DNMT1的ShRNA慢病毒是由汉恒生物提供的。
近年来,DNA甲基化抑制剂在癌症治疗中取得了显著的疗效。5Aza是一种DNA甲基转移酶(DNMT)抑制剂,已被FDA批准用于治疗骨髓增生异常综合症。先前有研究表明,5Aza可以增强CD8+T细胞的活性来抑制肿瘤生长,然而,5Aza调节肿瘤免疫微环境的机制仍未被完全阐明。此次,缪洪明团队发现5Aza明显抑制了CRC-PC,而这种效应与DNMT1无关,他们发现5Aza直接与ATP结合转运蛋白A9(ABCA9)结合,以调节胆固醇积累、巨噬细胞活化和抗肿瘤反应。5Aza对免疫调节的作用最终在CRC患者的基质巨噬细胞和T细胞中得到验证。
接下来,让我们一起来了解一下这篇文章的主要研究结果:
首先,为了确定5Aza在CRC-PC进展中的作用,作者用两种结直肠癌细胞系建立了小鼠CRC-PC模型,发现5Aza明显抑制肿瘤的生长,并显著提高了腹膜转移小鼠的存活率,那5Aza是通过直接影响癌细胞还是通过调节肿瘤微环境(TME)来发挥作用的呢?通过体外测定,5Aza既不影响MC38细胞的活力也不影响细胞凋亡或者细胞周期,而且在裸鼠中没有抑制CRC-PC的进展,表明5Aza通过免疫系统抑制了CRC-PC的进展。更重要的是,用5Aza预处理腹膜巨噬细胞(PMs)可以明显抑制CRC的皮下生长或腹膜转移的进展。一系列实验最终表明,5Aza对CRC-PC抑制依赖于淋巴细胞和巨噬细胞。
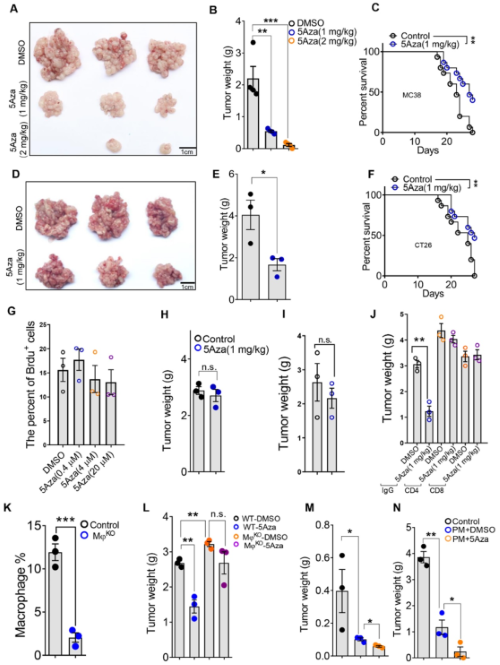
图1 5Aza抑制CRC-PC的进程依赖于巨噬细胞和淋巴细胞
由于巨噬细胞与癌症患者的肿瘤生长、侵袭、转移和预后不良等密切相关,因此,作者观察了TME中巨噬细胞的活性是否受5Aza的影响。结果显示,5Aza处理后,M1样巨噬细胞的比率随时间明显增加,而M2样巨噬细胞的比率显著减低,而且在小鼠PC模型中也观察到了类似的结果,说明5Aza可以激活CRC-PC小鼠中的M1样巨噬细胞。
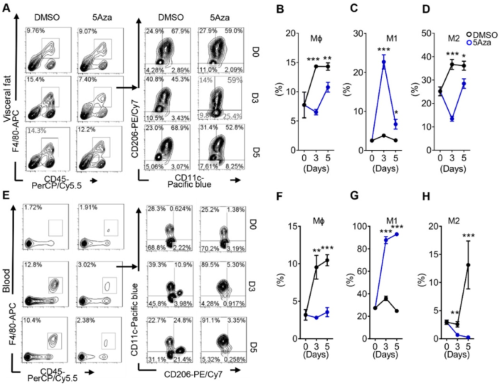
图2 Aza激活CRC-PC中的M1样巨噬细胞
适应性免疫和先天免疫往往在抑制癌症中起协同作用,上述结果表明,淋巴细胞参与了5Aza的抗肿瘤作用。因此,作者分析了成瘤小鼠的淋巴细胞的动态变化。结果显示,在CRC-PC的早期阶段,5Aza处理后,总T细胞的比例显著下降,而B细胞保持不变,CD4+T细胞的比例随时间显著增加,而CD8+T细胞的比率呈下降趋势。结果表明,5Aza调节CRC-PC中的T细胞比例。
作者进一步研究了T细胞中干扰素γ(IFNγ)的分泌水平,发现内脏脂肪中总T细胞、CD4+和CD8+T细胞的IFNγ水平在第5天增加,但是,血液中的并没有改变。巨噬细胞是T细胞活化的重要调节因子,为了进一步探索5Aza介导的巨噬细胞极化与T细胞活化之间的关系,作者设计了一个体外实验,发现5Aza预处理的PMs可以促进内脏脂肪T细胞以及CD4和CD8亚群的IFNγ分泌。这些结果说明5Aza刺激CRC-PC中巨噬细胞依赖的T细胞活化。
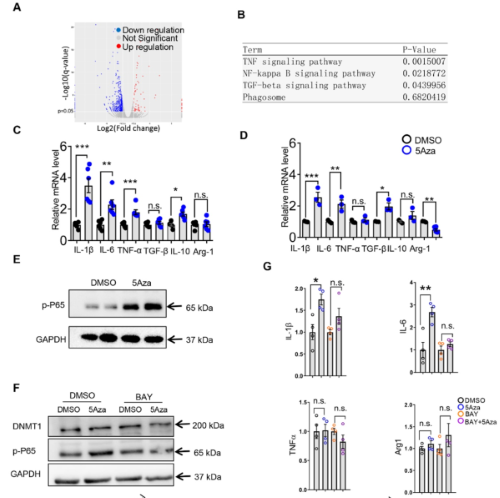
图3 5Aza促进依赖于p65磷酸化的巨噬细胞活化和肿瘤抑制
随后作者研究了5Aza如何刺激巨噬细胞的活化,RNA测序和信号富集分析等结果表明,5Aza处理后,PMs和骨髓来源的巨噬细胞(BMDM)表达更多的促炎细胞因子,而且5Aza明显促进了p65的磷酸化。作者进一步研究了5Aza诱导的M1极化是否由DNMT1介导,发现5Aza没有调节DNMT1的表达,而且敲低DNMT1抑制了促炎细胞因子,表明5Aza激活M1与DNMT1无关。

查看更多

查看更多

查看更多

联系我们

返回顶部