查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
慢病毒(Lentivirus)是逆转录病毒的一种,基因组为双链RNA。但区别于一般的逆转录病毒,慢病毒具有更广的宿主范围,对分裂细胞和非分裂细胞均具有感染能力。
重组慢病毒载体是以HIV-1(人类免疫缺陷 I 型病毒)为基础发展起来的工具载体,其毒性基因已经被剔除并被外源目的基因所取代,属于假型病毒。(一次性感染能力而无复制产生新病毒能力)
将靶基因随机整合到宿主的基因组中,并且能够在细胞系中稳定表达若干代,可以进行稳转细胞株的筛选。被广泛应用于各种细胞系基因敲除、基因过表达、RNA干扰。
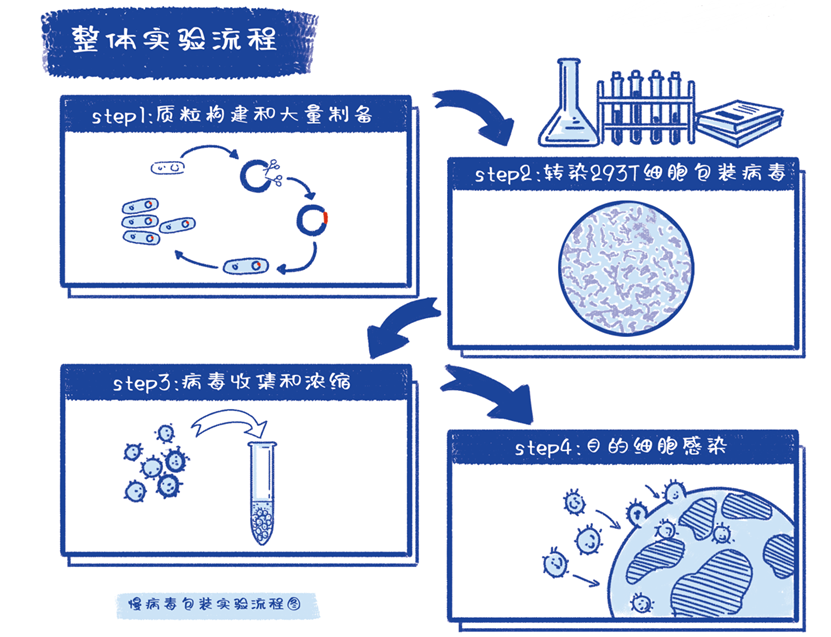
整体实验流程
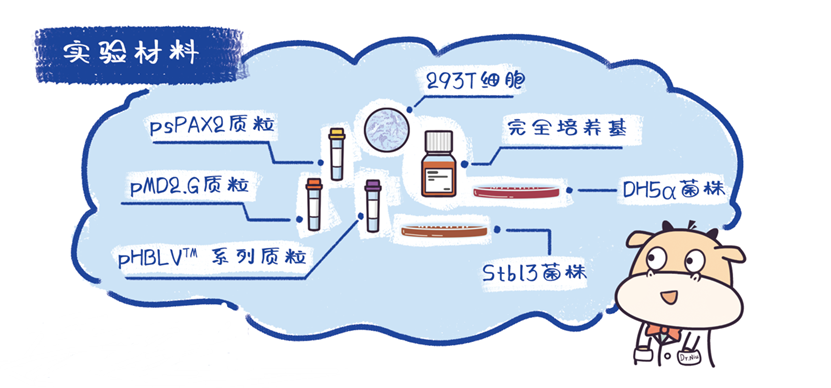
慢病毒包装所需实验材料
实验准备试剂设备
(1)构建含有目的基因的病毒载体,抽提高浓度、高纯度的包装质粒和目的质粒;
(2)指数生长的293T细胞(培养条件:DMEM+10%FBS, 37°,5%CO₂);
(3)试剂:胎牛血清、DMEM、Opti-MEM、lipo2000等;
(4)仪器设备:荧光显微镜、生物安全柜、超速离心机等。
慢病毒包装实验步骤(以293T细胞为例)
①质粒扩增。将构建好的慢病毒载体和包装质粒使用大抽试剂盒进行质粒的去内毒素抽提,浓度建议不低于1 μg/μl,A260/280在 1.7-1.8 间方可用于病毒包装。推荐使用优质大抽试剂盒进行质粒的大量去内毒素抽提(质粒质量会极大影响后续转染效率和病毒的滴度)。
②脂质体转染。转染前一天,在10 cm皿中接种生长状态良好的293T细胞,以第二天汇合度能达到30% ~ 50%为宜。24 h后转染,转染前需要把DMEM 和慢病毒包装专用转染试剂 LentiFitTM 恢复至室温,使用前需摇匀。每个皿的质粒成分如下:
表1、慢病毒包装转染体系
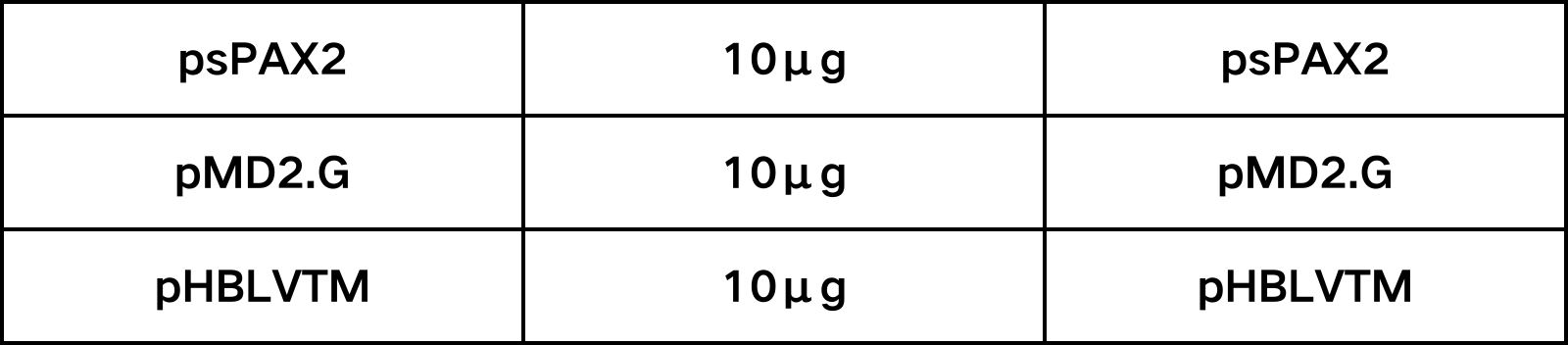
用于包装的三个质粒摩尔比通常为1:1:1,可以根据情况稍加调整。请参考LentiFitTM转染试剂说明书进行转染操作,转染后4-6 h 换新鲜培养基。
③病毒收集和离心。转染后48 h和72 h分别两次收集病毒上清(48 h收集后置换新鲜培液), 将收集的上清用 0.45 μm滤器过滤,然后放于超速离心管中,4 ℃,72000 g离心120 min。
④病毒重悬和保存。弃上清,500 μl重悬液重悬病毒沉淀,一周内使用则置于4 ℃保存,如需长时间存放需置于-80 ℃或液氮罐保存。(注:具体重悬体积根据实验需求而定)
⑤滴度测定。在96孔板中铺合适数量的293T细胞,第二天将慢病毒原液进行梯度稀释后分别感染293T细胞,感染24 h后换成无病毒的培养液,感染72 h后在荧光显微镜下观察结果,对荧光比例合适(10 ~ 30%之间)的孔进行细胞计数。
滴度计算公式为:滴度(TU/ml)=细胞数 ×荧光百分比×103/ 病毒原液体积
慢病毒包装注意事项
1.293T细胞作为常用的包装宿主,其健康状态是影响病毒产量的关键因素。用于慢病毒包装的293T细胞的传代数不宜过高,使用10代以内的293T细胞。且293T细胞贴壁性不是很好,换液时应小心滴加尽量避免冲起细胞。
2.质粒提取的质量,包括浓度和纯度。浓度不低于1ng至少要超过500ng/ul,因为浓度低,加入的体积就会相应增大,会增加细胞污染的风险。
3.慢病毒载体容纳外源基因长度的能力有限。超过3kb就会导致包装效率大大降低;质粒过大,也会导致转染效率降低,进而影响滴度。
4.转染后的第24h~48h,是慢病毒的生产高峰,可收获第一批慢病毒。在 48 h~72 h,滴度下降,可使用小体积培养基收获1~2次慢病毒,并和第一次收获的慢病毒合并。如果单纯追求高滴度,收获一次即可。实际上第一次收获的慢病毒,即可满足多次实验需求。
5.慢病毒的保存
(1)保存条件:置于-80℃冰箱保存;使用病毒时,取出置于4℃融化后进行细胞感染。
(2)避免反复冻融降低病毒滴度:每次冻融会降低病毒滴度10%~20%左右;为避免反复冻融建议按照每次的使用量进行分装。
(3)需要稀释慢病毒滴度时,从-80℃冰箱取出适量病毒,置于4℃融化,用无血清的细胞基础培养基或1×PBS (无Ca2+ /Mg2+ )稀释至合适滴度后进行细胞感染实验,稀释后的病毒4℃保存,尽量在三天内用完,不建议进行分装冻存。

查看更多

查看更多

查看更多

联系我们

返回顶部