查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,可有效地感染分裂细胞和非分裂细胞,大大提高目的基因或目的shRNA的转导效率,能够方便快捷地实现基因的长期、稳定表达。慢病毒包装也逐渐成为科研必备的实验技能之一,下面让我们来了解一下慢病毒的发展史吧!

慢病毒载体是在慢病毒基因组的基础上对慢病毒自身元件进行改造获得的一类能携带外源基因的病毒载体。其毒性基因被外源目的基因替代,只有一次性感染能力,不能复制产生新病毒。慢病毒载体的发展经历了以下阶段:
第一代慢病毒载体通过三质粒进行包装:(1) 一个包装元件质粒,表达gag/pol以及各种辅助蛋白;(2) 一个包膜蛋白质粒,表达VSV-G;(3)穿梭质粒携带目的基因。需要注意的是,包装元件质粒与包膜蛋白质粒均不含有包装信号ψ及LTRs,因此可以避免他们被包装进入慢病毒病毒载体颗粒中,降低了产生具有复制能力慢病毒的可能性。穿梭质粒上带有必要的顺式调控元件(RRE,ψ,LTRs)。同时,由于穿梭质粒上不表达tat基因,5‘LTR在没有tat蛋白的作用下转录能力非常弱。因此导入的外源基因一般需要通过一个额外的启动子进行表达。
通过三质粒包装系统,极大地降低了产生具有复制能力慢病毒的可能性。这意味着至少需要两次完整的重组事件才能产生一个具有复制能力的慢病毒。而VSV-G蛋白的使用也降低了这种重组的可能性。
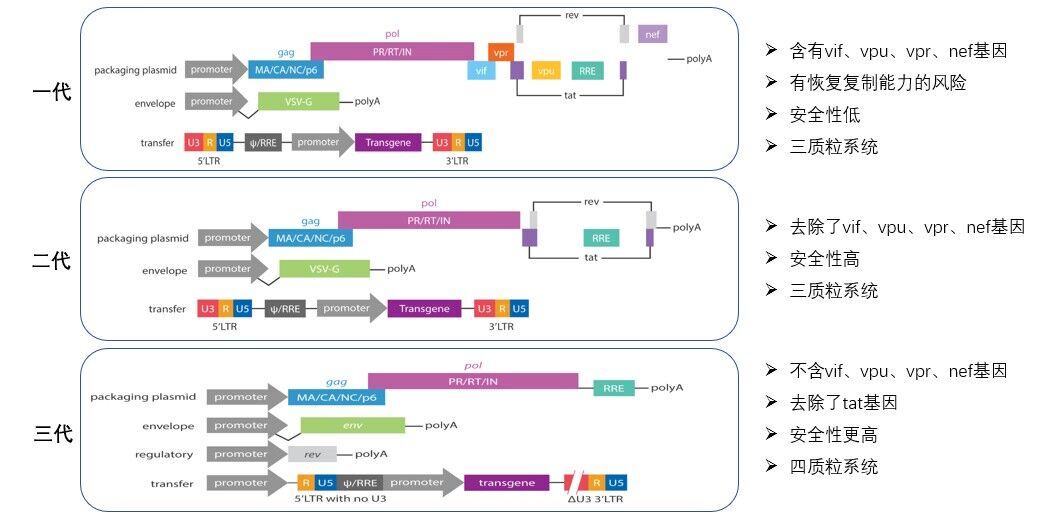
图1.历代慢病毒包装系统
研究发现,HIV-1的Vif、 Vpu、 Vpr 和Nef四个辅助蛋白,在缺失后不会影响病毒的复制能力。但是原代细胞和体内实验均证明这些蛋白对于病毒的致病性是必需的。例如淋巴细胞对于vif缺失的HIV-1病毒具有抵抗性,这是因为vif可以失活宿主细胞中的一个抗病毒因子APOBEC3G。类似的,vpu会失活细胞内的另外一个抗病毒因子Tetherin。而nef可以降解宿主蛋白比如MHV class Ⅰ和CD4,这将增加病毒的产生,加速免疫系统的崩塌。因此,第二代慢病毒载体包装系统删除了Vif、 Vpu、 Vpr 和Nef四个基因。加上用VSV-G取代HIV-1的env,第二代慢病毒载体只包含了HIV-1 的9个基因中的4个:gag、pol、tat、rev。
穿梭质粒两端被LTR包围,LTR含有3个区域:U3,R,U5。5‘LTR的U3具有增强子和启动子的作用,含有多个宿主细胞转录因子结合位点(Sp1、NF-κB等)。3’LTR的R区域充当mRNA加尾信号。而5’LTR的U3和3’LTR的U5不存在于病毒RNA中。LTR元件的复制在逆转录过程完成,此时3’LTR的U3将被复制然后转接到5’LTR上。自失活载体(SIN)删除了5’LTR的U3,并删除了3’LTR的U3的TATA 盒及Sp1,NF-κB结合位点,使其丧失了启动子活性。
由于第三代慢病毒载体删除5’LTR的U3区域,导致该穿梭质粒无法独立起始病毒的基因组RNA的转录,因此在5’LTR添加了CMV启动子以起始病毒基因组RNA的转录。同时由于不需要激活病毒5’LTR的启动子活性,tat基因也被从包装系统中删除。第三代慢病毒包装系统只包含了HIV-1的9个基因中的3个:pol、gag、rev。这进一步增加了该慢病毒载体的安全性。并且,即使发生重组导致pol、gag和rev被完整地整合到穿梭质粒中,由于LTR丧失了活性,该病毒也难以进行扩增,同时Vif、 Vpu、 Vpr 和Nef的删除也将该病毒的致病性降到最低。
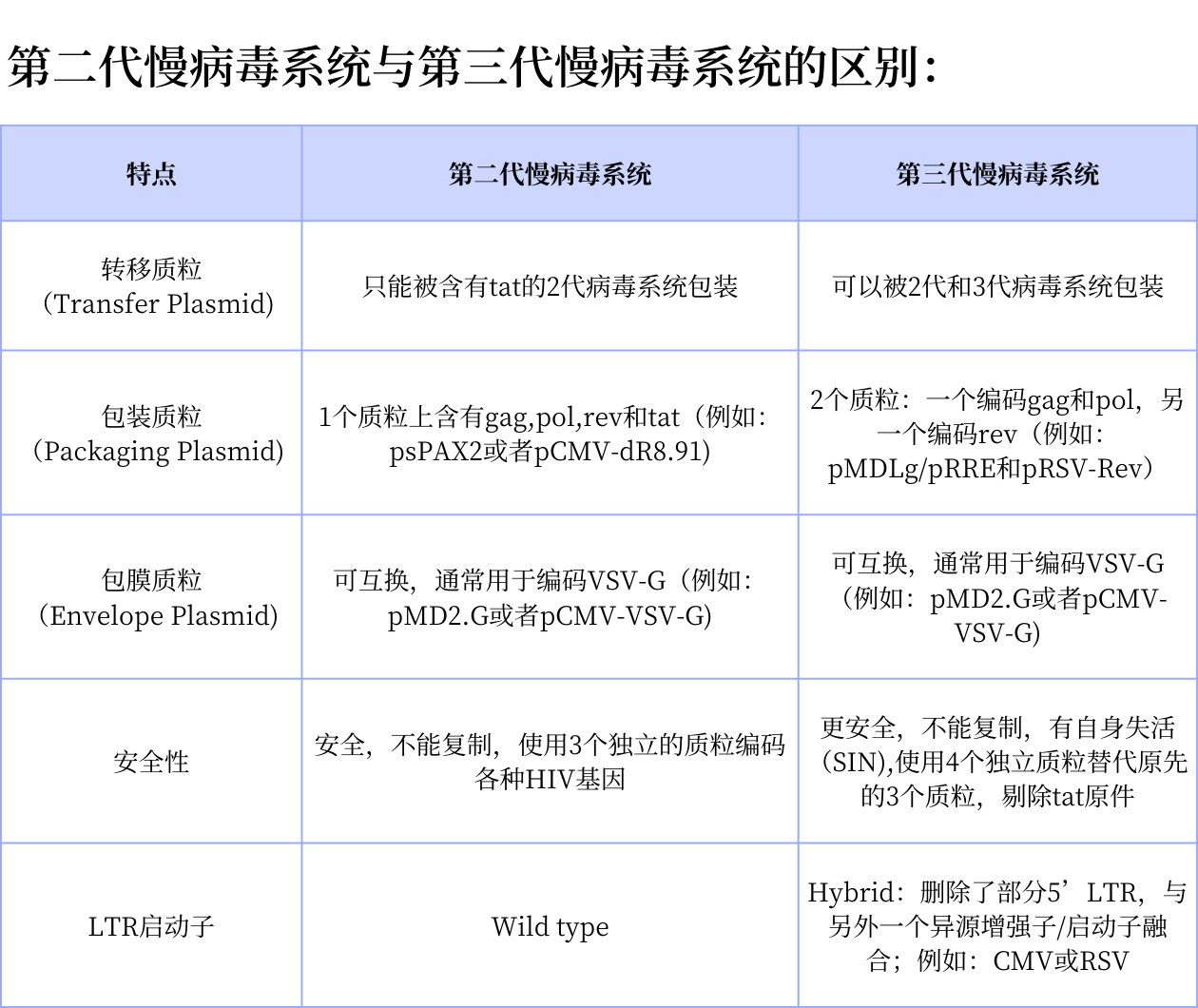
图2.第二代慢病毒系统与第三代慢病毒系统的区别
考虑到安全性和实验难度,第二代系统是目前比较常用的慢病毒包装系统,将穿梭质粒、包膜质粒、包装质粒共转染293T细胞,在细胞内进行病毒的包装,继而收集病毒上清,经浓缩、纯化、滴度测定、质检后得到所需慢病毒,可用于感染靶细胞。再通过包膜蛋白与细胞表面受体结合的方式感染细胞,即慢病毒与宿主细胞膜融合后释放结构蛋白、酶蛋白和RNA。RNA在逆转录酶的作用下逆转录并与整合酶形成整合前复合物。整合前复合物进入细胞核后,可以将病毒基因有效地整合到宿主染色体上,达到持久性表达。
汉恒生物采用第二代包装系统,提供优质的慢病毒包装服务,欢迎咨询了解。

查看更多

查看更多

查看更多

联系我们

返回顶部