查看更多

 明星产品
明星产品
 关注我们
关注我们

扫码关注我们
了解更多信息
前几期特异性基因调控干货文章介绍了靶向心血管系统、神经系统、视网膜、肌肉、胰腺等组织和器官的特异性基因调控策略,今天我们继续介绍其他组织器官的特异性基因调控。耳(Ear)是哺乳动物的听觉器官,也是识别方位维持身体平衡的器官。内耳(Inner ear)是耳的重要组成部分,在感知声音和平衡的过程中发挥重要作用,本期就为大家详细介绍内耳研究中的特异性调控策略。
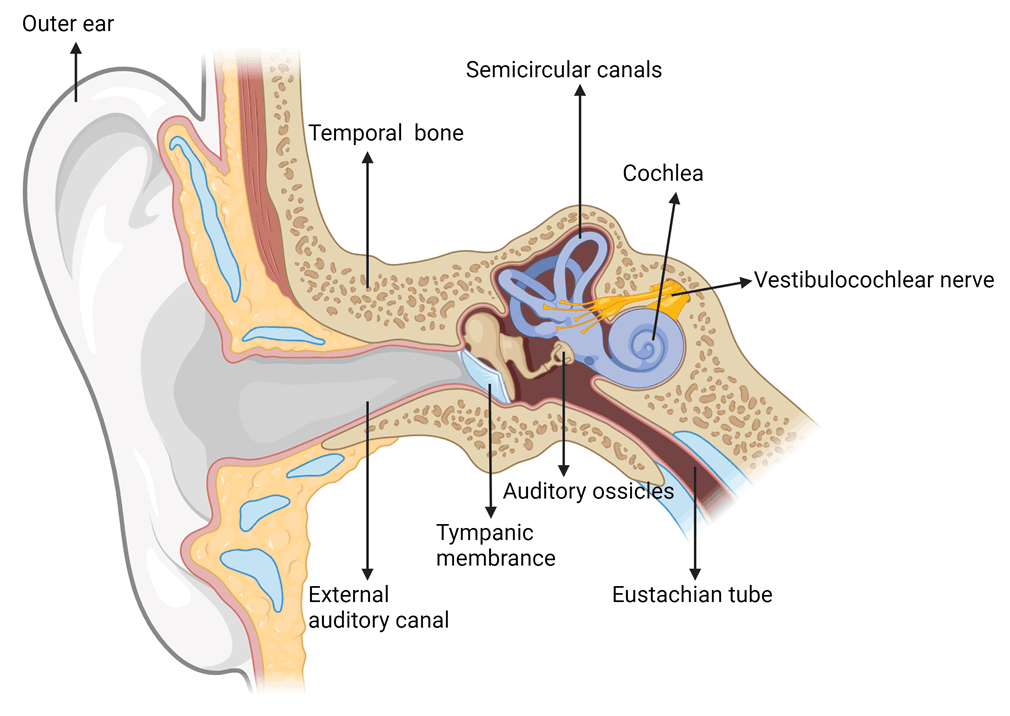
图1.耳结构(图片来源biorender)
耳主要由3个部分组成:外耳(Outer ear)、中耳(Middle ear)和内耳。外耳包括耳廓(Auricle)和耳道(External auditory canal),负责搜集声音;中耳包括鼓膜(Tympanic Membrane)、听小骨(Auditory ossicles)、咽鼓管(Eustachian tube),负责放大声音;内耳包括耳蜗(Cochlea)、前庭(Vestibular)、半规管(Semicircular canals)三个部分,主要负责感知声音和感知平衡。内耳部分充满了淋巴液 ,当声音传到内耳时,首先引起外淋巴的波动,继而影响到中阶和其中的内淋巴,从而刺激毛细胞产生生物电,后者沿着听神经和听觉传导路向听觉中枢传导,听觉中枢对接收到的信号进行分析和综合,从而产生“听”的感觉。
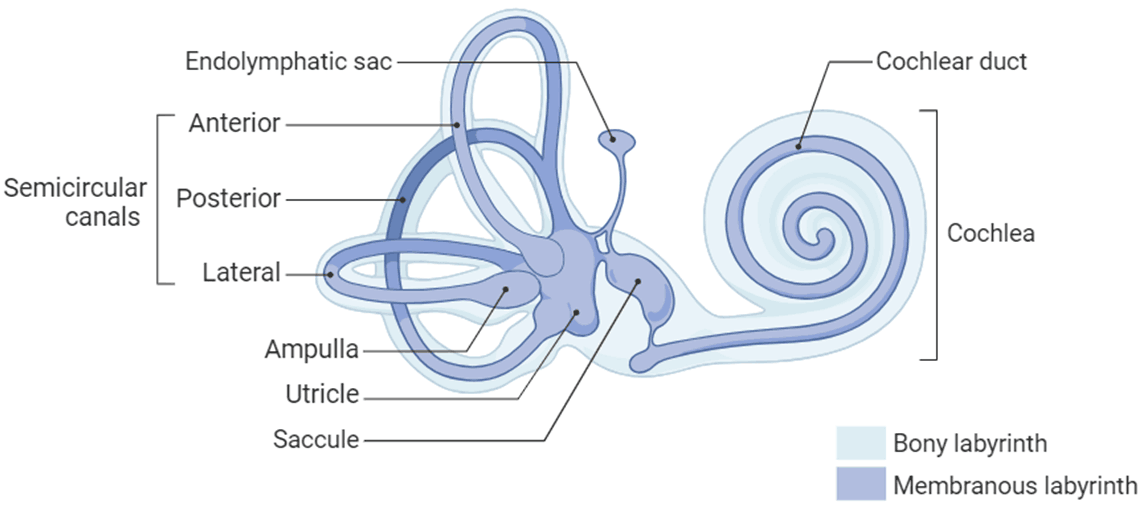
图2.内耳解剖图(图片来源biorender)
耳聋是最常见的致残性疾病之一,据WHO的最新统计,全世界范围内约有近15亿人受到听力损伤的困扰,其中感音神经性耳聋(内耳毛细胞或听神经、听觉中枢发生病变导致的耳聋)占大部分。在我国,每年新生约3万聋儿,其中60%与遗传因素相关,目前已发现了150多个基因与耳聋相关,但至今临床上尚无任何可用于治疗遗传性耳聋的药物。腺相关病毒载体(Adeno-associated virus,AAV)安全性高、宿主范围广、免疫原性低、在体感染特异性强,被认为是基因治疗的利器。AAV可以直接向内耳细胞局部递送,而不必暴露体外的其他组织,减少潜在风险;此外,内耳毛细胞不分裂,通过AAV递送的基因可以长期持续表达,从而产生持久的治疗效果,因此,基于AAV的内耳基因治疗,是一种治疗听力损伤和平衡障碍的颇具前景的治疗方法。本文将结合相关研究案例,从血清型、特异性启动子以及常用注射方式三个方面详细介绍内耳靶向性AAV的选择,希望能够为相关研究的科研工作者们提供一些思路和帮助。
一、内耳嗜性血清型
内耳包含三种主要的功能细胞:毛细胞(Hair Cells,HCs)(包括内毛细胞(Inner hair cells,IHCs)和外毛细胞(Outer hair cells,OHCs))、支持细胞(Supporting Cells,SCs)和螺旋神经节(Spiral Ganglion Neurons,SGNs)。这三类细胞在听力产生和感知过程中起着重要作用。rAAV通过改变包装质粒中Cap基因从而获得不同的血清型,使其具有不同的组织趋向性或者易感细胞类型,为了更高效特异的感染内耳,科学家通过对现有血清型的衣壳蛋白进行改造,研发了内耳特异性血清型:AAV-Anc80L65、AAV2.7m8、AAV-PHP.eB(BBB)、AAV-ie、AAV-ie-K558R等血清型。
Anc80L65
2017年Landegger LD等[1]用AAV1、AAV2、AAV6、AAV8、AAV9以及AAV80L65与耳蜗外植体孵育,48h观察到Anc80L65可以高水平地转导HCs(60-100%),与AAV2相比,Anc80L65可以使eGFP在HCs持续大量地表达(图3);另外,作者经圆窗膜(Round window membrane,RWM)注射新生小鼠耳蜗,结果显示与体外实验结果一致,Anc80L65可以高度靶向HCs细胞,并且Anc80L65在低20倍(对于AAV1)至3倍(对于AAV2)的剂量下转导了近100%的IHCs和约90%的OHCs。此外,单细胞生理机能测试、听性脑干反应和畸变产物耳声发射测试结果表明,通过RWM注射Anc80L65不会损害听觉功能(图4)。
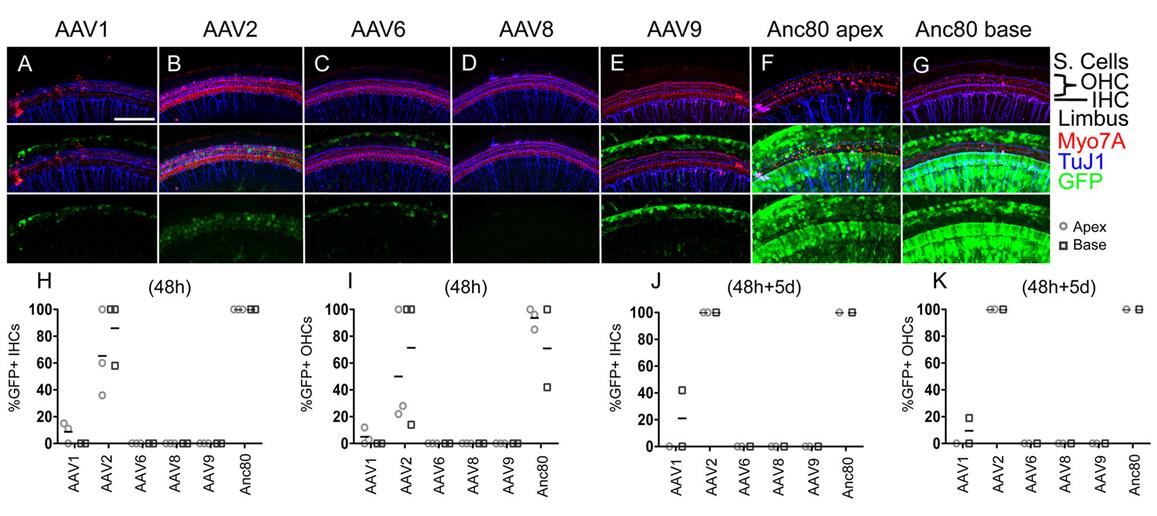
图3.不同血清型AAV感染耳蜗外植体
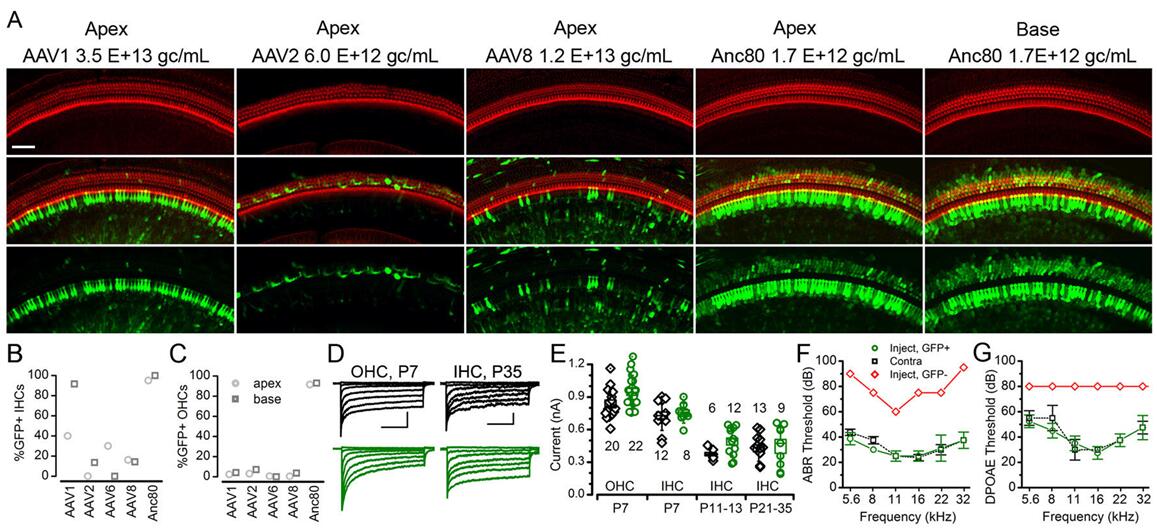
图4.不同血清型AAV感染新生小鼠耳蜗HCs
AAV2.7m8
2019年Isgrig K等[2]利用后半规管(Post semicircular canal,PSCC)注射的方法将AAVs(AAV2.7m8-GFP、AAV8BP2-GFP、AAV2-GFP、AAV8-GFP)注射到小鼠耳蜗,发现人工合成的AAV2.7m8能够高效感染耳蜗HCs(IHCs和OHCs转导效率均在80%以上,图5),且能高效感染Lgr5阳性内柱细胞(转导效率约80%~90%,支持细胞的一种)和内指细胞(转导效率约50%~70%,支持细胞的一种)(图6),但是感染前庭毛细胞效率较低(转导效率约20%,图7)。
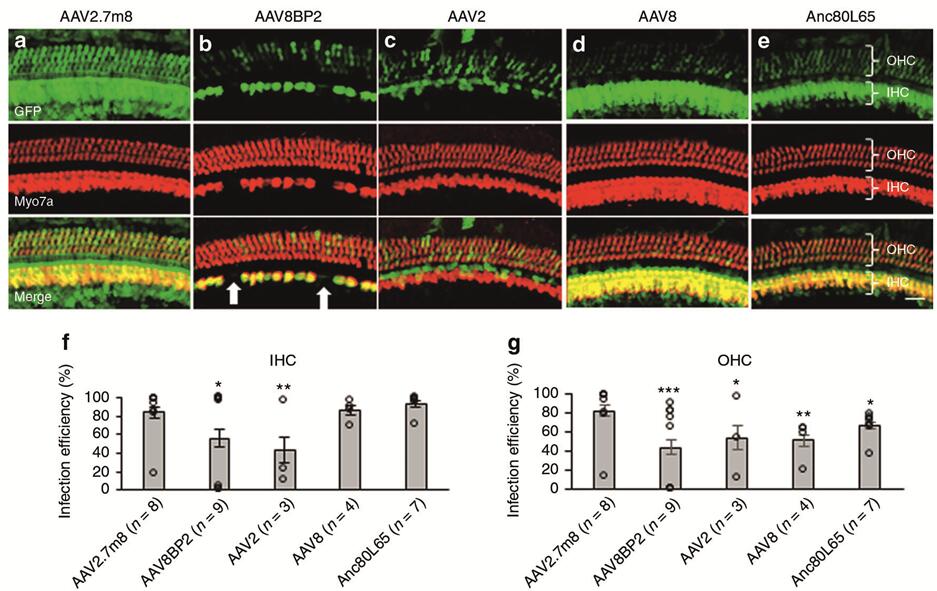
图5. 不同血清型AAV感染新生小鼠耳蜗HCs
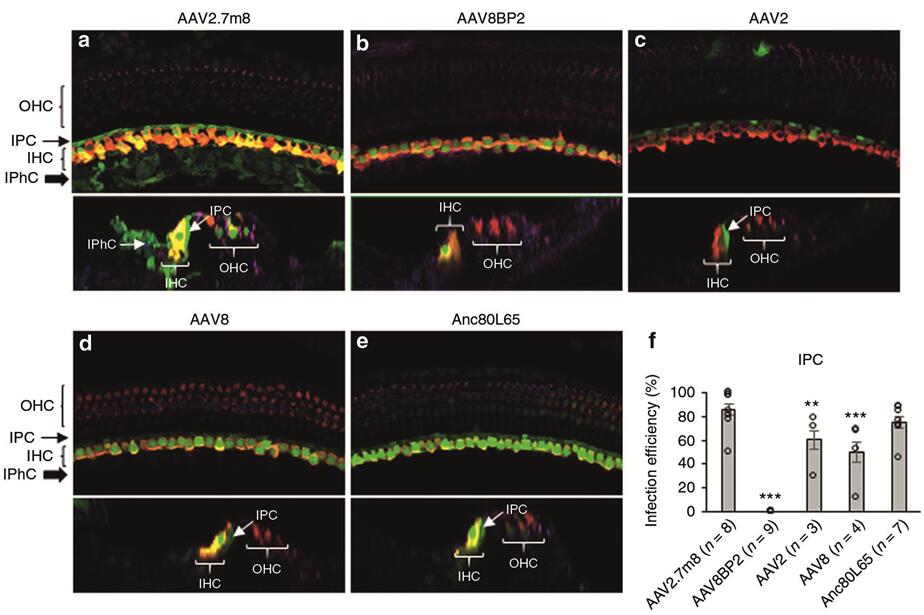
图6. 不同血清型AAV感染新生小鼠耳蜗内柱细胞和内指骨细胞
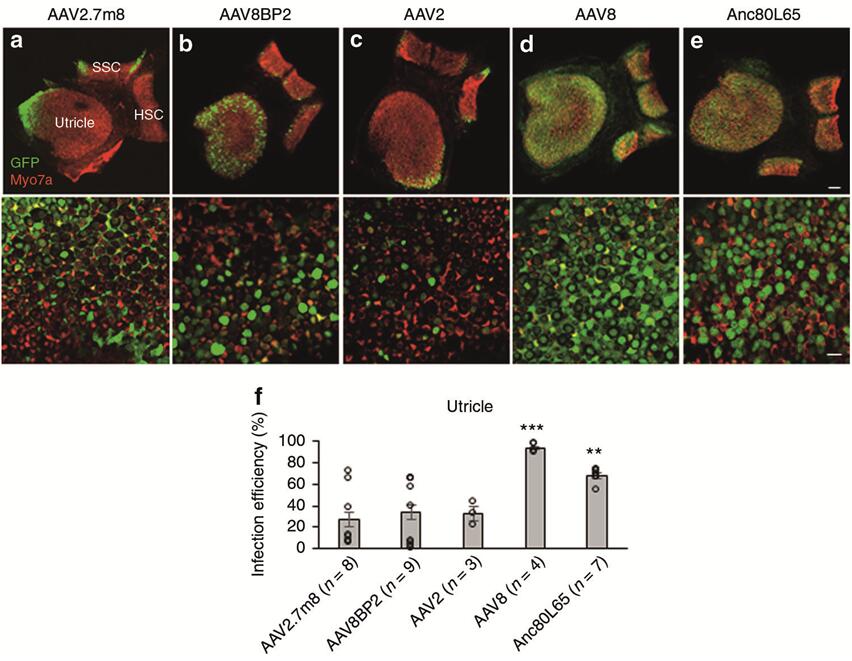
图7. 不同血清型AAV感染新生小鼠前庭HCs
AAV-PHP.B(BBB)
2019年György B等[3]将AAV9-PHP.B血清型通过RWM的方式注射新生小鼠耳蜗,结果显示AAV-PHP.B能有效感染耳蜗OHCs(转导效率约为30%-40%)和IHCs(转导效率约为60%-80%)(图8),但是几乎不感染SCs。此外,研究结果表明,AAV-PHP.B也能有效感染大鼠耳蜗OHCs和IHCs(图9)。
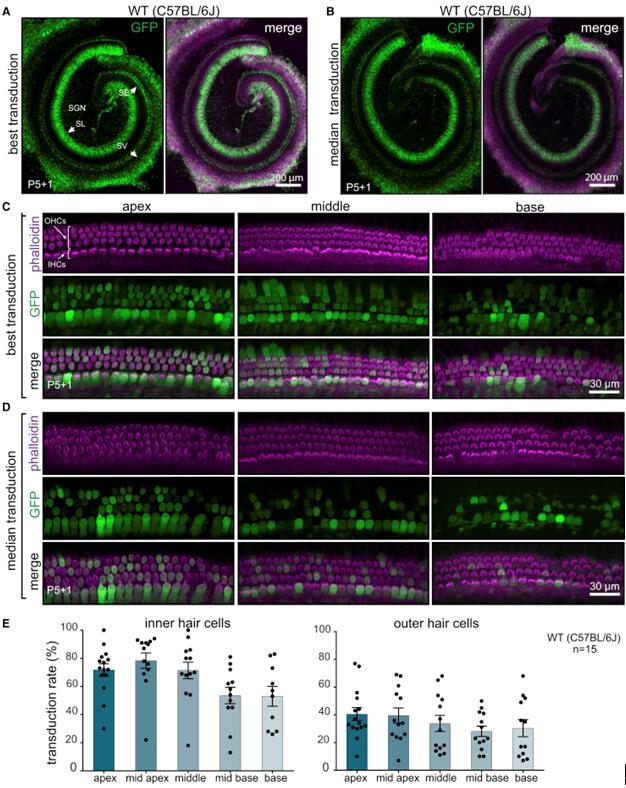
图8. AAV-PHP.B感染新生小鼠耳蜗HCs
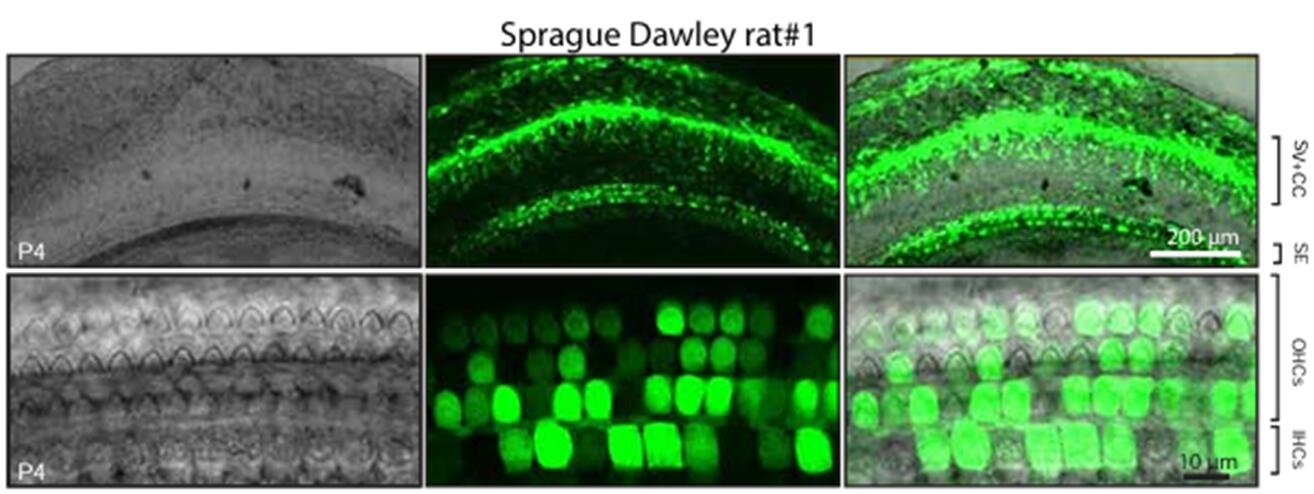
图9. AAV-PHP.B感染新生大鼠耳蜗HCs
AAV-ie
2019年上海科技大学钟桂生研究团队[4]在AAV-DJ的基础上筛选优化出AAV-ie血清型,作者通过RWM的方式将不同血清型的AAV注射到小鼠耳蜗,结果显示:AAV1、AAV6、AAV8和PHP.eB对SCs具有较低的转导效率(低于20%),Anc80L65和AAV-DJ对SCs的转导效率约55%,而AAV-ie对SCs具有较高的转导效率(转导效率约77%,图10);此外,AAV-ie可以高效感染小鼠耳蜗HCs(IHCs转导效率约100%,OHCs转导效率约75%-100%,图11)和SGNs(转导效率60%,图11)。
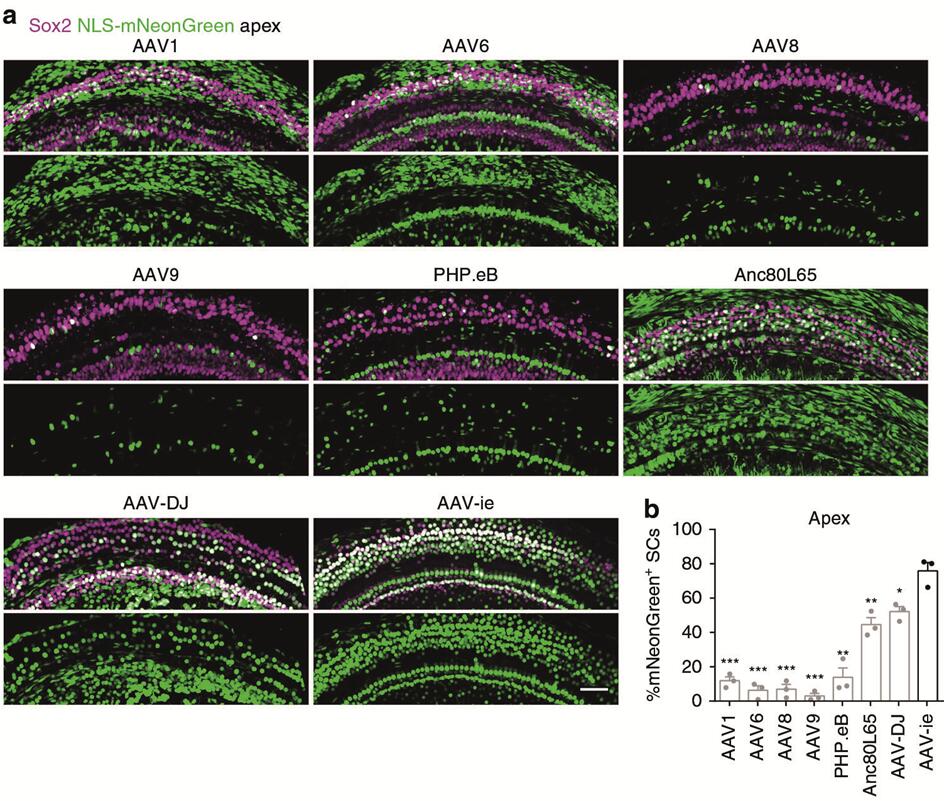
图10. 不同血清型AAV感染小鼠耳蜗SCs

图11. AAV-ie感染小鼠耳蜗HCs和SGNs
AAV-ie-K558R
2022年上海科技大学钟桂生研究团队[5]在AAV-ie的基础上筛选优化出AAV-ie-K558血清型,与AAV-ie比较,AAV-ie-K558R对耳蜗中间区域的OHCs和基底区域的SCs的转导效率显著增加(图12)。
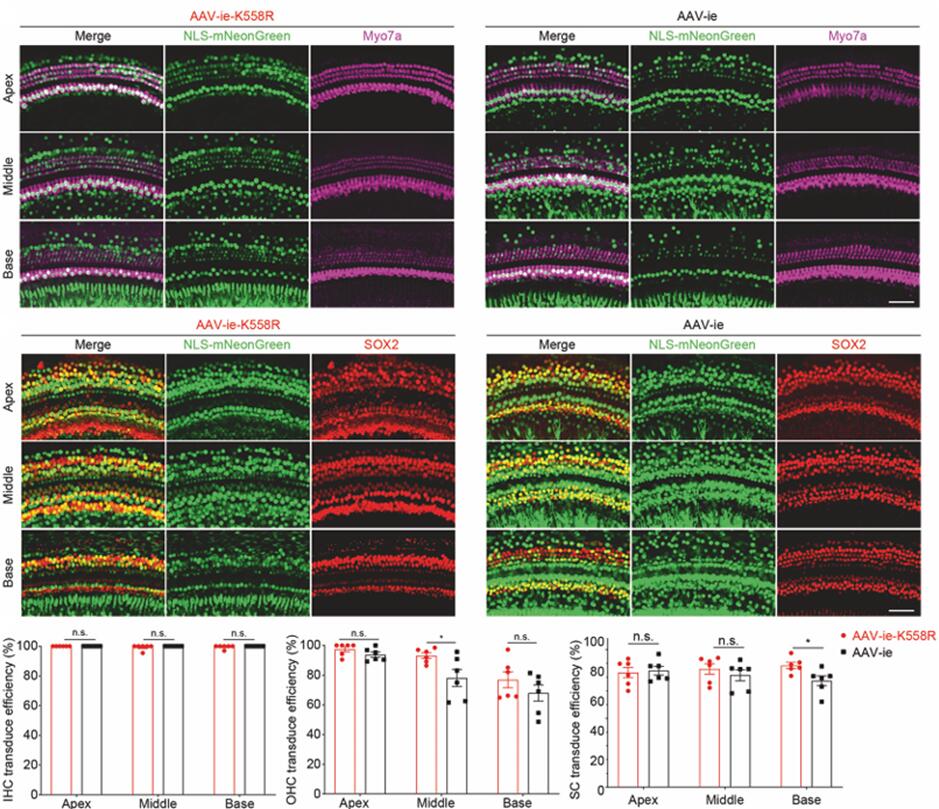
图12. AAV-ie和AAV-ie-K558R感染小鼠耳蜗HCs和SCs
表一所列为汉恒生物提供的用于内耳感染的血清型,可提供试用装,欢迎咨询。
表1. 汉恒生物可提供的靶向内耳的血清型

二、特异性启动子的选择
除了选择靶向血清型外,不同细胞的基因特异性调控还可以借助特异性启动子来实现。Myo15a基因是最常见的常染色体隐性非综合征型耳聋致病基因之一,其编码的肌球蛋白XVa对维持耳蜗毛细胞内肌球蛋白组织结构及毛细胞静纤毛的长度至关重要,Caberlotto E等[6]曾研究Myo15-Cre小鼠的耳蜗毛细胞能特异性表达Cre。2023年复旦大学附属眼耳鼻喉科医院(上海市五官科医院)李华伟科研团队设计了由毛细胞特异性启动子Myo15驱动表达hOTOF基因的AAV(AAV1-Myo15-hOTOF),通过RWM的方式注射新生小鼠耳蜗,能显著改善Otof-/-小鼠的听力,并且这一结论在成年小鼠中也得到了验证。此外,Myo15启动子可以驱动GFP在非人灵长类动物(NHP)耳蜗IHCs(转导效率63%-93%)和OHCs(转导效率27%-49%)的表达(图13);次年,该研究团队[7]包装了Myo15启动子或CAG启动子启动GFP的AAV-PHP.eB病毒,并通过RWM的方式注射新生小鼠耳蜗(10^10 vg/耳蜗),2周后通过免疫荧光染色观察感染效果,结果显示:Myo15启动子指导GFP仅在HCs中表达,而CAG启动子指导GFP不仅在HCs中有表达,在SGNs中也有表达(图14),并且Myo15特异性启动子能降低GFP在中枢系统(大脑皮层,嗅球,海马和小脑)的表达(图15)。
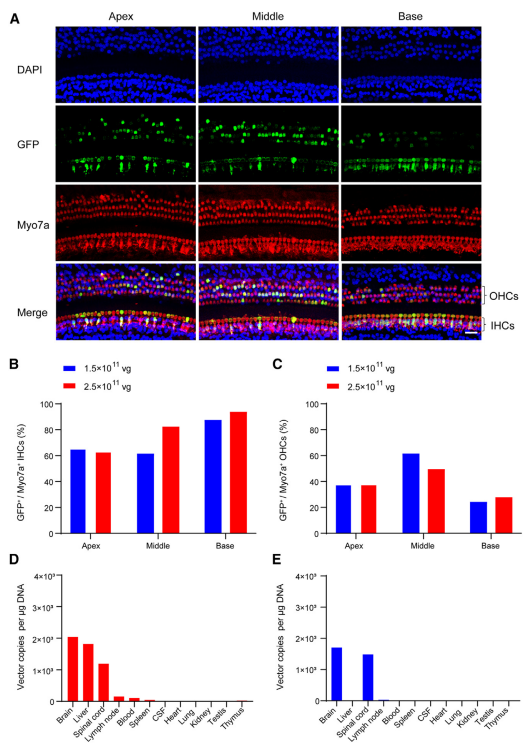
图13. Myo15启动子启动GFP在NHP耳蜗HCs中的表达分布
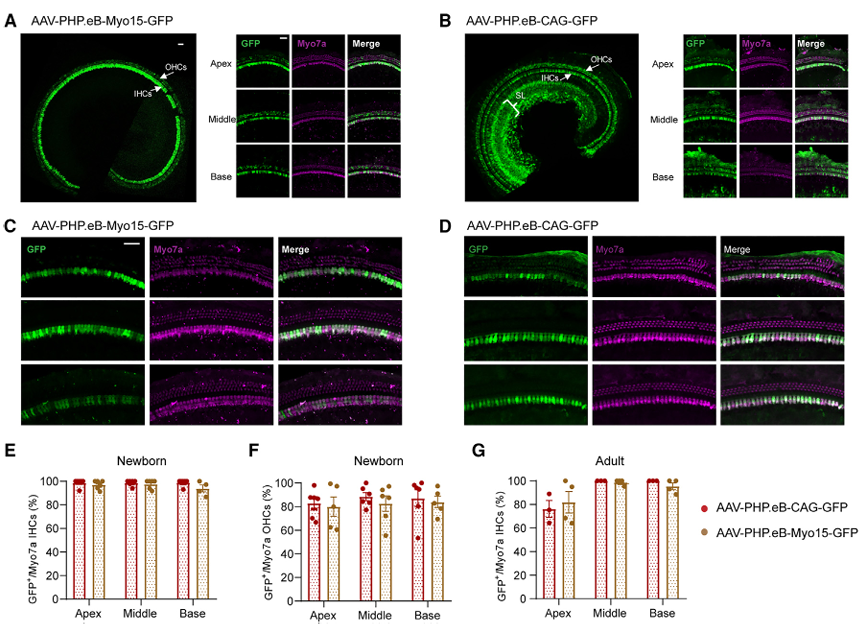
图14. Myo15和CAG启动子启动GFP在小鼠耳蜗HCs中的表达分布
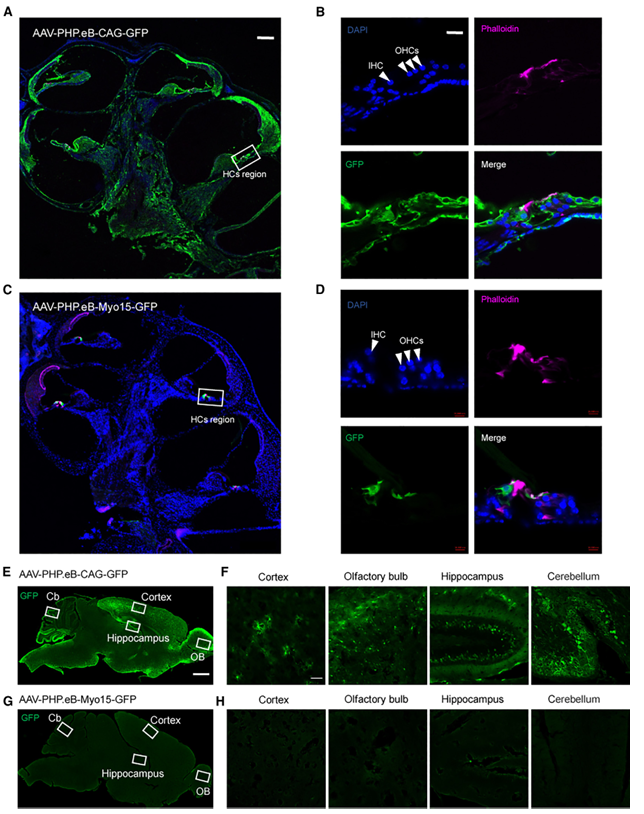
图15.Myo15和CAG启动子启动GFP在耳蜗和中枢神经系统中的表达分布
三、注射方式和剂量
常见的内耳给药有两种方式:原窗膜RWM注射或后半规管PSCC注射,Shu等[8]比较了2种方式注射对成年小鼠耳蜗的影响:结果显示:RWM注射方式几乎不感染成年小鼠耳蜗OHCs,而PSCC注射方式可以同时感染成年小鼠耳蜗IHCs和OHCs,且转导效率跟体积相关(PSCC注射1 µl AAV-Anc80L65能有效感染成年小鼠耳蜗HCs,注射过量会导致耳蜗毛细胞的死亡)(图16,图17)。
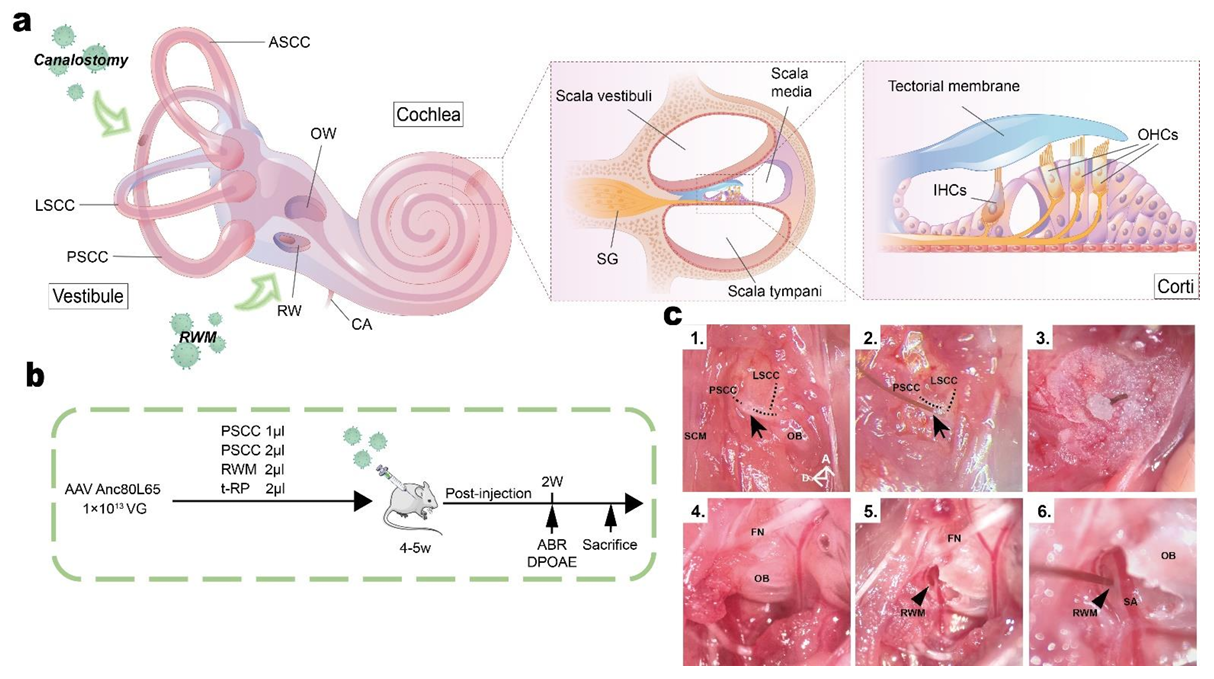
图16.小鼠内耳结构及RWM和PSCC注射示意图(1-3:PSCC注射;4-6:RWM注射)
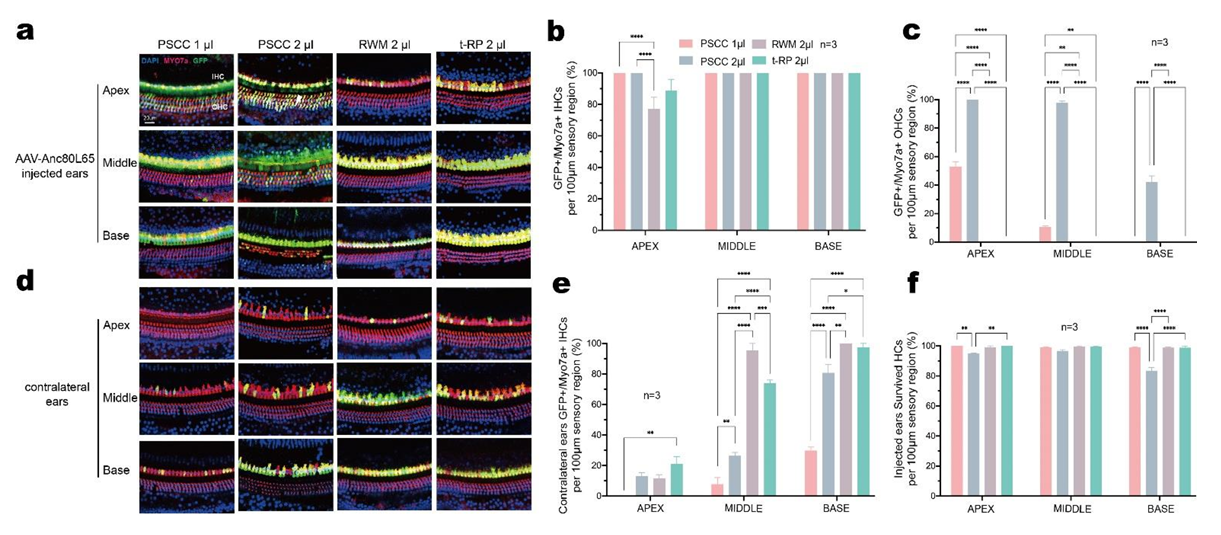
图17.不同注射方式和体积对小鼠耳蜗毛细胞感染效率和存活的影响
表2.内耳注射方法及参考剂量

经过以上介绍,相信大家对内耳领域的AAV应用有了一个初步了解,除本文介绍的内耳组织特异性启动子AAV病毒外,汉恒生物还研发了靶向神经、肌肉、肾脏、肝脏、视网膜、胰腺等组织器官的AAV特异性启动子和特异性血清型,欢迎各位老师同学咨询。使用合适的血清型和特异性启动子,可对不同组织器官进行靶向高效感染,在下期的内容中我们将会分享肠道相关的AAV特异性基因调控策略,敬请关注。
参考文献:
[1] Landegger LD, Pan B, Askew C, Wassmer SJ, Gluck SD, Galvin A, Taylor R, Forge A, Stankovic KM, Holt JR, Vandenberghe LH. A synthetic AAV vector enables safe and efficient gene transfer to the mammalian inner ear. Nat Biotechnol. 2017 Mar;35(3):280-284.
[2] Isgrig K, McDougald DS, Zhu J, Wang HJ, Bennett J, Chien WW. AAV2.7m8 is a powerful viral vector for inner ear gene therapy. Nat Commun. 2019 Jan 25;10(1):427.
[3] György B, Meijer EJ, Ivanchenko MV, Tenneson K, Emond F, Hanlon KS, Indzhykulian AA, Volak A, Karavitaki KD, Tamvakologos PI, Vezina M, Berezovskii VK, Born RT, O'Brien M, Lafond JF, Arsenijevic Y, Kenna MA, Maguire CA, Corey DP. Gene Transfer with AAV9-PHP.B Rescues Hearing in a Mouse Model of Usher Syndrome 3A and Transduces Hair Cells in a Non-human Primate. Mol Ther Methods Clin Dev. 2018 Nov 20;13:1-13.
[4] Tan F, Chu C, Qi J, Li W, You D, Li K, Chen X, Zhao W, Cheng C, Liu X, Qiao Y, Su B, He S, Zhong C, Li H, Chai R, Zhong G. AAV-ie enables safe and efficient gene transfer to inner ear cells. Nat Commun. 2019 Aug 19;10(1):3733.
[5] Tao Y, Liu X, Yang L, Chu C, Tan F, Yu Z, Ke J, Li X, Zheng X, Zhao X, Qi J, Lin CP, Chai R, Zhong G, Wu H. AAV-ie-K558R mediated cochlear gene therapy and hair cell regeneration. Signal Transduct Target Ther. 2022 Apr 22;7(1):109.
[6] Caberlotto E, Michel V, Foucher I, Bahloul A, Goodyear RJ, Pepermans E, Michalski N, Perfettini I, Alegria-Prévot O, Chardenoux S, Do Cruzeiro M, Hardelin JP, Richardson GP, Avan P, Weil D, Petit C. Usher type 1G protein sans is a critical component of the tip-link complex, a structure controlling actin polymerization in stereocilia. Proc Natl Acad Sci U S A. 2011 Apr 5;108(14):5825-30.
[7] Wang H, Xun M, Tang H, Zhao J, Hu S, Zhang L, Lv J, Wang D, Chen Y, Liu J, Li GL, Wang W, Shu Y, Li H. Hair cell-specific Myo15 promoter-mediated gene therapy rescues hearing in DFNB9 mouse model. Mol Ther Nucleic Acids. 2024 Feb 2;35(1):102135.
[8] Zhao Y, Zhang L, Wang D, Chen B, Shu Y. Approaches and Vectors for Efficient Cochlear Gene Transfer in Adult Mouse Models. Biomolecules. 2022 Dec 26;13(1):38.
[9] Guo JY, He L, Qu TF, Liu YY, Liu K, Wang GP, Gong SS. Canalostomy As a Surgical Approach to Local Drug Delivery into the Inner Ears of Adult and Neonatal Mice. J Vis Exp. 2018 May 25;(135):57351.
[10] Akil O, Lustig L. AAV-Mediated Gene Delivery to the Inner Ear. Methods Mol Biol. 2019;1950:271-282.
[11] Akil O, Rouse SL, Chan DK, Lustig LR. Surgical method for virally mediated gene delivery to the mouse inner ear through the round window membrane. J Vis Exp. 2015 Mar 16;(97):52187.

查看更多

查看更多

查看更多

联系我们

返回顶部